来源 | NIRO(ID:NIRO-keyanmiao)
在PCR实验中,有多种因素共同影响了PCR反应的效率、特异性和产物质量。对于PCR实验,我们已经熟悉得不能再熟悉了,但是要想真正了解PCR实验的有趣之处,还是要对其组分分析并了解,这些组分在PCR实验中分别起了什么作用?对PCR实验有什么影响?
如果这些都了解了,相信你已经是一名合格的科研打工吗喽了
!

PCR反应中的抑制因素主要来源于样本处理、试剂质量、反应条件以及外部污染等多个方面。
以下主要分为3个部分进行讲述:
-
PCR反应抑制因素
-
标本中PCR抑制物来源及作用机制
-
PCR增强剂
随着PCR反应中,其成分主要依旧为引物、DNA聚合酶、dNTPs以及Mg
2+
等,作为整个体系的内部核心因素,同时为了让PCR试剂适用于不同的应用场景,也加入了不少其他成分对PCR试剂起到不同的作用。
① 引物长度要合适。一般引物的长度为15-30个碱基,引物过短会降低扩增的特异性,而过长则会使退火温度提高,不利于引物模板结合,容易形成二聚体。长不利于引物与模板结合且引物易形成二级结构,过短则特异性差。
② 引物GC含量要适宜。引物的GC含量(鸟嘌呤和胞嘧啶含量)一般为40-60%之间,上下游引物的GC含量不能相差太大,尽量保持一致,避免GC含量过高或过低都不利于PCR反应的进行。GC含量过高可能导致非特异性扩增,而GC含量过低则可能使引物稳定性降低。
一般建议避免在引物3'端使用A/T
,由于A和T之间只有两个氢键,相对于G和C之间的三个氢键来说稳定性较差。如果3'端以A/T结尾,可能会增加错误引发的风险,即DNA聚合酶可能在非特异性位点开始合成新链。同时应尽量
避免在
3'端出现连续G/C序列
,连续的G/C序列(尤其是3个或3个以上)可能会形成稳定的二级结构(如发夹结构),这些结构会干扰引物与模板DNA的结合,从而降低PCR的特异性和效率。
③ 引物自身及引物之间不应存在互补序列,这个设计原则很重要。碱基要随机分布,引物自身和引物之间不能有连续4个碱基的互补,否则引物自身会折叠成发夹结构,这种结构会改变引物的三维形状,使其难与模板DNA正确结合,从而降低PCR的扩增效率,还可能干扰DNA聚合酶的活性,阻碍DNA聚合酶在引物
3'端的结合和延伸。
此外,还会产生二聚体结构,这是由于两个引物分子之间的互补序列相互配对而形成的双链结构,在PCR反应体系中,如果引物浓度较高且存在互补序列,那么引物之间有可能形成二聚体。在二聚体的形成会消耗大量的引物分子,从而降低有效引物的浓度,从而影响引物与模板的结合效率。
④ 引物5'端可以修饰,3'端不可修饰。引物的延伸是从3'端开始的,不能进行任何修饰。引物5'端不决定扩增的特异性可以被修饰,引物5'端修饰包括:加酶切位点,标记荧光素/生物素,引入点突变、插入突变、缺失突变序列,引入启动子序列等。
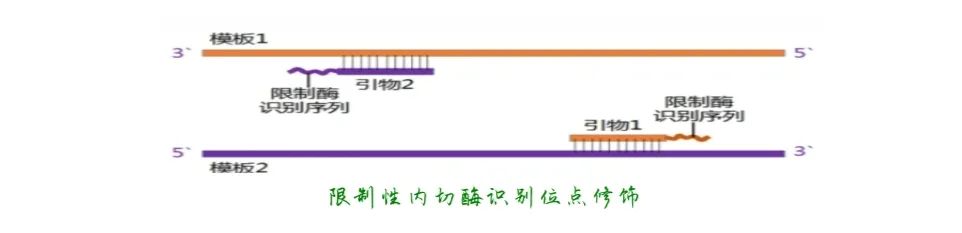 ⑤ Tm值在合适范围。Tm值是引物的一个重要参数,它反映了引物与模板DNA结合的稳定性。Tm值一般通过公式: Tm=4(G+C)+2(A+T)来估算,
理想的Tm值应接近PCR反应的退火温度,一般在55℃-80℃之间,最好接近72℃以使复性条件最佳。同时,上下游引物Tm值要保持接近,一般Tm值不超过5℃
。
⑥ 产物不能形成二级结构。因为二级结构会阻碍PCR扩增过程中的引物结合和DNA聚合酶的延伸,从而降低PCR的效率和特异性。要如何避免呢?使用NCBI-Blast在线预测或Primer5等,尽可能避免高GC含量、引物的互补性等。
⑦ 引物3'端不要终止于密码子(UAA、UAG、UGA),因终止密码子的第3位易发生简并,会影响扩增特异性与效率。
(3) dNTPs的质量和浓度: dNTP
s
溶液呈酸性,一般配置成体系需将其调节至7.0-7.5,正常情况下4种dNTP的浓度应该相等,如果其中某一种过高就会引起错配,浓度过低又会影响PCR产物的产量。
(5) Mg
2+
浓度: 主要影响PCR扩增的特异性和产量,一般要对应dNTPs的浓度。
当Mg
2+
浓度过高时,反应的特异性会降低,导致非特异性扩增的出现。这是因为高浓度的Mg
2+
能够稳定磷酸盐骨架上的负电荷,从而促进引物与DNA模板的非特异性结合,增加错误扩增的机会。相反,Mg
2+
浓度过低则会降低DNA聚合酶的活性。DNA聚合酶需要Mg
2+
作为辅因子来催化dNTPs的聚合反应,缺乏足够的Mg
2+
会导致酶活性下降,从而使反应产物减少。
⑤ Tm值在合适范围。Tm值是引物的一个重要参数,它反映了引物与模板DNA结合的稳定性。Tm值一般通过公式: Tm=4(G+C)+2(A+T)来估算,
理想的Tm值应接近PCR反应的退火温度,一般在55℃-80℃之间,最好接近72℃以使复性条件最佳。同时,上下游引物Tm值要保持接近,一般Tm值不超过5℃
。
⑥ 产物不能形成二级结构。因为二级结构会阻碍PCR扩增过程中的引物结合和DNA聚合酶的延伸,从而降低PCR的效率和特异性。要如何避免呢?使用NCBI-Blast在线预测或Primer5等,尽可能避免高GC含量、引物的互补性等。
⑦ 引物3'端不要终止于密码子(UAA、UAG、UGA),因终止密码子的第3位易发生简并,会影响扩增特异性与效率。
(3) dNTPs的质量和浓度: dNTP
s
溶液呈酸性,一般配置成体系需将其调节至7.0-7.5,正常情况下4种dNTP的浓度应该相等,如果其中某一种过高就会引起错配,浓度过低又会影响PCR产物的产量。
(5) Mg
2+
浓度: 主要影响PCR扩增的特异性和产量,一般要对应dNTPs的浓度。
当Mg
2+
浓度过高时,反应的特异性会降低,导致非特异性扩增的出现。这是因为高浓度的Mg
2+
能够稳定磷酸盐骨架上的负电荷,从而促进引物与DNA模板的非特异性结合,增加错误扩增的机会。相反,Mg
2+
浓度过低则会降低DNA聚合酶的活性。DNA聚合酶需要Mg
2+
作为辅因子来催化dNTPs的聚合反应,缺乏足够的Mg
2+
会导致酶活性下降,从而使反应产物减少。
 (6) Mg
2+
浓度与dNTPs浓度的关系。
Mg
2+
浓度通常需要与dNTPs(dATP、dGTP、dCTP、dTTP)的浓度相匹配。一般来说,Mg
2+
的浓度应比dNTPs的浓度稍高,以确保足够的酶活性和反应效率。具体的比例关系可能因实验条件和PCR体系的不同而有所差异,但通常建议Mg
2+
浓度比dNTPs浓度高0.2~2.5 mM。
(7) 温度与时间的设置: PCR原理三步骤涉及变性-退火-延伸三个温度点,也就是变性温度与时间、退火温度与时间、延伸温度与时间。
①
模板GC含量高要延长变性时间:
当模板DNA的GC含量较高时,GC碱基对之间的氢键比AT碱基对更强,因此需要更长的变性时间才能确保双链DNA完全分离成单链。延长变性时间有助于增加模板DNA在后续退火和延伸步骤中的可用性,从而提高PCR的效率和特异性。
②
引物碱基数较少,可以适当提高退火温度:
较短的引物与模板DNA的结合位点可能相对较少,因此提高退火温度可以减少引物与模板之间的非特异性结合,增加特异性扩增的机会。较高的退火温度有助于筛选出与模板DNA完全匹配的引物,从而提高PCR的特异性。
③
引物碱基数较多,可以适当降低退火温度:
如果引物的碱基数较多,那么它们与模板DNA的结合位点也会相应增加。在这种情况下,适当降低退火温度可以使引物更容易与模板DNA结合,从而提高PCR的扩增效率。然而,需要注意的是,降低退火温度也可能增加非特异性扩增的风险,因此需要在保证扩增效率的同时,避免非特异性产物的产生。
④
产物长度长需要对应延长延伸时间:
PCR的延伸步骤是DNA聚合酶在引物的引导下,沿着模板DNA链合成新DNA链的过程。如果目标产物的长度较长,那么就需要更长的延伸时间来确保新DNA链的完整合成。因此,在设计PCR程序时,应根据目标产物的长度来设置合适的延伸时间,以确保PCR产物的完整性和产量。
(6) Mg
2+
浓度与dNTPs浓度的关系。
Mg
2+
浓度通常需要与dNTPs(dATP、dGTP、dCTP、dTTP)的浓度相匹配。一般来说,Mg
2+
的浓度应比dNTPs的浓度稍高,以确保足够的酶活性和反应效率。具体的比例关系可能因实验条件和PCR体系的不同而有所差异,但通常建议Mg
2+
浓度比dNTPs浓度高0.2~2.5 mM。
(7) 温度与时间的设置: PCR原理三步骤涉及变性-退火-延伸三个温度点,也就是变性温度与时间、退火温度与时间、延伸温度与时间。
①
模板GC含量高要延长变性时间:
当模板DNA的GC含量较高时,GC碱基对之间的氢键比AT碱基对更强,因此需要更长的变性时间才能确保双链DNA完全分离成单链。延长变性时间有助于增加模板DNA在后续退火和延伸步骤中的可用性,从而提高PCR的效率和特异性。
②
引物碱基数较少,可以适当提高退火温度:
较短的引物与模板DNA的结合位点可能相对较少,因此提高退火温度可以减少引物与模板之间的非特异性结合,增加特异性扩增的机会。较高的退火温度有助于筛选出与模板DNA完全匹配的引物,从而提高PCR的特异性。
③
引物碱基数较多,可以适当降低退火温度:
如果引物的碱基数较多,那么它们与模板DNA的结合位点也会相应增加。在这种情况下,适当降低退火温度可以使引物更容易与模板DNA结合,从而提高PCR的扩增效率。然而,需要注意的是,降低退火温度也可能增加非特异性扩增的风险,因此需要在保证扩增效率的同时,避免非特异性产物的产生。
④
产物长度长需要对应延长延伸时间:
PCR的延伸步骤是DNA聚合酶在引物的引导下,沿着模板DNA链合成新DNA链的过程。如果目标产物的长度较长,那么就需要更长的延伸时间来确保新DNA链的完整合成。因此,在设计PCR程序时,应根据目标产物的长度来设置合适的延伸时间,以确保PCR产物的完整性和产量。





