药物掩味技术及其评价方法研究进展
Advances of Taste Masking Technologies and Assessment Approaches
黄蓓莉1,2,钱 勇2,林巧平2*
(1. 中国药科大学,江苏南京 211198;2. 江苏先声药业有限公司,江苏南京 210042)
摘要:
药物的苦味等不良嗅味是提高患者用药顺应性的重要制约因素,合适有效的掩味方法能够改善患者尤其是儿童的顺应性,增加疗效,提高药品的临床价值。近年来发展的掩味技术主要包括添加矫味剂等感官手段,包衣、微囊化、环糊精包合、形成离子交换树脂复合物等物理手段,以及结构修饰等化学手段;溶出试验、电子舌系统、口尝评价法等体内外分析方法在掩味制剂的开发中发挥着重要作用。
关键词:
掩味技术;矫味剂;包衣;微囊化;电子舌;口尝评价法;综述
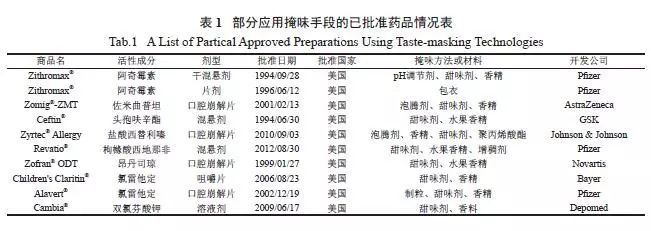
大多数药物都具有苦味、金属味等不良嗅味,严重影响着患者顺应性,限制了药品的临床使用,如何在有效掩味的同时不影响药物在体内的有效释放是一大挑战。目前,上市药品中绝大部分仍采用传统掩味方式,如添加矫味剂、进行包衣等[1],部分品种见表1 ;但近年来越来越多的制剂工艺和技术应用于掩味领域并发挥了显著效果,如微囊化、固体分散体、环糊精包合、离子交换树脂复合物等[2—5]。掩味主要基于以下原理:①物理掩味:形成物理屏障,阻止或减缓药物在口腔内释放,减少苦味药物与味蕾接触;②化学掩味:阻止苦味药物与口腔苦味受体结合[6],阻止信号传递;③感官掩味:干扰中枢信号整合,混淆大脑味觉。本文介绍了苦味形成机制,并对药物掩味技术和掩味制剂的体内外评价方法进行了综述。
1 苦味形成机制
人体通过味蕾( taste bud) 感受味觉,而味蕾由味觉受体细胞(taste-receptor cells,TRCs) 组成,主要分布于舌头上的乳突状结构以及咽部、软腭上皮组织等处[6]。不同TRC 对应不同味觉类型,而每个味蕾包含50 ~ 150 个TRCs,可以感受到所有的基本味觉。
研究表明,苦味受体(bitter taste receptor,T2Rs) 是一类约30 种高度相异的G 蛋白偶联受体,苦味物质在口腔中与T2Rs 结合,激活异三聚体G蛋白味转导素(heterotrimeric G proteins gustducin)或G 蛋白α 亚基,导致β、γ 亚基释放,随后刺激磷脂酶C β2(PLC-β2)。PLC-β2 的兴奋导致磷脂酰肌醇4,5- 双磷酸(PIP2) 水解产生细胞内第二信使分子三磷酸肌醇( IP3) 和甘油二酯(DG),最终打开味觉传导通道—— 瞬时受体电位蛋白TRPM5。随后,兴奋信号沿神经进入延髓束核,更换神经元到丘脑,最后投射至大脑味觉中枢,经过中枢整合最终感受到苦味。
2 苦味药物的共性特征
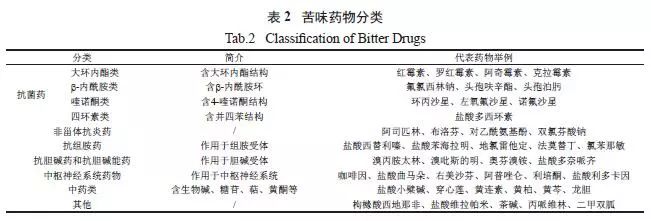
苦味物质在化学结构上多含-NO2、=N-、≡N、-S-、-S-S-、-SH、-SO3H、=C=S 等基团,大多呈一定疏水性或带正电荷。苦味物质的疏水基团易与苦味受体膜相互作用,而正电荷易与膜表面负电荷静电吸附,刺激苦味受体细胞。根据苦味药物的结构和作用类型,可将其进行如下分类( 表2)。
3 掩味技术
需要掩味的剂型包括:①口服固体制剂:口腔崩解片(orally disintegrating tablets)、口腔速溶片(orally dissolving tablets)、咀嚼片(chewable tablets)、口腔分散片(orodispersible tablets)、口腔膜剂(orally films);②口服液体制剂:混悬剂(orally suspensions)、口服溶液(orally solutions) ;③牙科用口腔注射剂等。目前,国内外常用的掩味方式有以下几种( 图1)。
3.1 添加矫味剂或苦味抑制剂
3.1.1 添加矫味剂(flavoring agents)
药物制剂中使用的矫味剂包括甜味剂(sweeteners)、芳香剂(aromatic agents)、味觉增效剂(potentiators)、增稠剂(viscosity enhancers)、味蕾麻痹剂(paralyzants) 等。
3.1.2 苦味阻滞剂(bitter blockers)
苦味阻滞剂包括单磷酸腺苷(AMP)、脂蛋白、γ- 氨基丁酸、苯乙烯酸衍生物等[7]。AMP 通过与苦味物质竞争性结合T2Rs 位点而发挥掩味作用,已于2003 年通过美国FDA 批准作为食品添加剂用于食品和药品的掩味。
3.2 包衣
包衣是最常用的掩味技术之一,通过形成物理屏障阻止或减少药物在口腔内释放。常用包衣材料包括:水溶性( 或不溶性) 高分子、脂质和糖类等,其中不溶性高分子又分为胃溶性、肠溶性和非pH依赖型不溶性高分子。
3.3 制粒
常用的有湿法制粒和熔融制粒。将苦味药物与矫味剂、亲水性( 或疏水性) 高分子或脂质混合制得掩味颗粒,能够有效掩盖药物苦味。制粒具有经济适用、耗时短、易放大规模等优势。美国辉瑞公司的上市产品Alavert® 即通过制粒并添加矫味剂达到了良好的掩味效果。
3.4 微囊与微球
微囊掩味原理与包衣相似,通过药物外层的囊膜阻止或减少药物与味蕾的直接接触而掩味;而微球则通过减缓药物的释放达到掩味效果。常用制备方法包括喷雾干燥法、喷雾凝结法、流化床法、液中干燥法等。
3.5 形成复合物
3.5.1 包合物
环糊精(cyclodextrins,CyDs) 可将药物包合在疏水空腔内形成包合物,避免药物与味蕾接触而掩味;同时有研究表明,环糊精可能与TRCs 细胞膜成分,如胆固醇、磷脂等相互作用而减弱T2Rs 功能[4]。
3.5.2 离子交换树脂复合物
离子交换树脂是一类带有酸性或碱性功能基团的高分子材料,通过静电作用或弱离子键与带相反电荷的药物形成复合物,使药物在口腔内释放量低于苦味阈值而掩味。
3.5.3 其他类型复合物
Rahman 等用溶剂蒸发法制备了马来酸氯苯那敏- 单宁酸复合物、马来酸溴苯那敏- 单宁酸复合物[27—28]。研究显示,该复合物溶解度呈pH 依赖性,可明显掩盖药物苦味。而Ogata 等则考察了9 种丙哌维林- 有机酸晶体复合物的理化性质及掩味效果,其中,有机酸为琥珀酸( Ⅰ型、Ⅱ型)、富马酸、丙二酸、DL- 酒石酸、苯甲酸、对甲苯甲酸、水杨酸和邻苯二甲酸。结果显示,丙哌维林- 水杨酸晶体复合物能够有效掩味,但尚不明确该复合物是药物与有机酸成盐还是形成了共晶[29]。
3.6 固体分散体
固体分散体中药物高度分散于载体基质,通过与基质形成氢键等分子间作用而改变药物释放模式,阻止与味蕾直接接触。热熔挤出(HME) 是常用的制备工艺。前面已经提到,Eudragit EPO 是有效的掩味材料,由于它的阳离子性、pH 依赖溶解性及热稳定性等特点,也常用于HME 中。Alshehri等以Eudragit EPO 为载体,通过HME 制备了甲芬那酸固体分散体并压制成片,溶出速率明显提高并能够有效掩味[3]。Maniruzzaman 等则使用EudragitL100 为载体,通过HME 在药物周围形成惰性物理屏障,有效地掩盖了西替利嗪和维拉帕米的苦味[32]。
3.7 pH 调节剂
pH 调节剂可用于pH 依赖溶解性药物,通过在口腔内形成低溶解度的pH 环境,抑制药物溶解而掩味。辉瑞公司利用阿奇霉素溶解度随pH 值上升而急剧下降的性质,以无水磷酸三钠为碱化试剂,并添加香蕉香精等矫味剂开发了ithromax® 干混悬剂,口感良好。
3.8 药物化学结构修饰
将苦味药物分子进行结构修饰制成前药或成盐,抑制其与苦味受体的结合或降低在口腔内的释放,也可达到掩味效果,但此法难度较大。Karaman 将阿莫西林结构上的氨基进行修饰形成前药,该前药在中性条件下稳定不溶解、在酸性条件下则水解为阿莫西林,推测其具有掩味效果[34]。
3.9 多孔物质吸附
通过将药物吸附或包埋于多孔物质基质中,使药物经过口腔时释放减缓而发挥掩味作用。常用的吸附材料有二氧化硅、硅酸镁铝等。Kashid 等将药物与硅酸镁铝混合,再与不溶性高分子制粒,最后制成片剂或其他固体制剂,体内外试验均表明其掩味效果良好[35]。
4 掩味制剂的评价方法
4.1 体外评估
4.1.1 溶出试验
通常考察口腔和胃肠道2 种环境下药物的释放情况。①模拟口腔:以水或模拟唾液( simulated salivary fluid,SSF) 为介质,根据国际药学联合会和美国药学科学家协会(FIP/AAPS) 指导原则,在前5 min 内多点取样,对药物溶出进行考察,重点关注30 s 内药物的释放情况。将样品用紫外光谱法或高效液相色谱法进行检测,当前5 min 内药物释放量低于苦味浓度阈值或低于含量的10%时认为其能够有效掩味。在模拟口腔溶出试验中,介质的体积、温度、pH、渗透压、离子强度、模拟唾液流速及舌头力矩等问题值得关注。②模拟胃肠道:掩味制剂在有效掩味的同时不能影响药物的体内释放,因此还要根据药典相关指导原则,考察药物在胃肠道中的溶出。若为崩解片,还需考察其崩解特性。
4.1.2 电子舌掩味评估
电子舌(E-tongue) 是一种利用传感器阵列感测样品的特征响应信号,通过信号识别处理对样品进行定量或定性分析的检测设备。目前用于掩味研究的主要有法国Alpha MOS 公司的α-Astree 电子舌系统和日本Insent 电子舌系统。整个系统模拟人体对味觉的感知,传感器阵列相当于味觉受体组成的味觉细胞,用于采集信号,而软件分析系统则相当于大脑皮层的味觉中枢,用于处理和输出信号。传感器阵列中每个独立的传感器均具有交互敏感作用。根据作用原理,可以分为电势型、伏安型和阻抗谱型。Insent 系统采用人工脂膜传感器技术,通过记录膜电位变化评价样品的酸、甜、苦等各种味觉;而α-Astree 则使用晶体场效应电极,通过测定液体样品的综合味觉信息来输出结果。用于电子舌系统的分析方法包括主成分分析法(principal component analysis,PCA)、判别因子分析法(discriminant factorial analysis,DFA)、偏最小二乘法( partial least analysis,PLA) 等。检测过程包括样品的溶出、取样、测量、结果分析等阶段,其中,样品溶出过程中介质的选择、温度、是否搅动等因素,以及取样过程中取样时间点、样品过滤等问题均值得关注。国内外多数研究表明,电子舌检测法与体外溶出试验及体内口尝评价法均具有较高的一致性[2,19,25,32],重复性好,避免了口尝法的主观性,且可用于具有潜在毒性药物的检测,降低了口尝人员的风险[36] ;但其价格昂贵、探头寿命短,目前多为科研应用[37],商业应用较少。
4.1.3 形态表征
在制得颗粒、微囊等中间体后,需要考察其外观( 如圆整度、包衣或囊膜完整性)、粒度分布、药物晶型变化、包封率、载药量等性质,若要进一步制备口崩片或混悬剂等剂型,还需考察其流动性、可压性等。常用分析方法有:热重分析法( thermal gravimetric analysis,TGA)、差示扫描量热法(differential scanning calorimetry,DSC)、X 射线粉末衍射法(powder X-ray diffractometry,PXRD)、扫描电镜法(scanning electron microscopy,SEM)、拉曼光谱(Raman spectra,RM)、核磁共振(nuclear magnetic resonance,NMR)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR) 等。Guo 等在研究中采用了同步辐射X 射线显微断层成像技术(SR-μCT) 来研究载药微球的形态和结构并定量测量药物的含量与释放,观察到其结果与体外实测数据高度一致,表明微粒的形态及结构特征对掩味微球的设计具有一定指导意义[38]。
4.2 体内掩味效果评估
4.2.1 经典人群口感评价法
口尝法是最直接、最能真实反映药物口感的体内分析方法,但也存在主观性强、个体差异大、操作繁琐、重复性差等不足,当药物处于早期研发阶段时,还存在潜在毒性等风险。
4.2.2 动物偏好测试和电生理模型法
动物偏好测试通过观察小鼠等动物对苦味物质的反应来评价苦味;电生理法则使用电极测量麻醉动物对苦味刺激的神经响应以评价苦味。Formaker等以大鼠为模型,使用电生理法研究了舌鼓索神经对谷氨酸盐- 蔗糖混合物的味觉响应[40]。
5 结语
药物的不良嗅味普遍存在,涉及抗菌药、心血管药、抗肿瘤药、解热镇痛药、神经系统药物等多个用药领域,严重影响着儿童、老年患者以及其他特殊用药人群如吞咽困难者、精神病患者等的用药顺应性,进而影响到药物疗效。因此,药物的掩味对于提高患者生活质量、保证治疗效果和实现药品的商业价值具有重大意义。
添加矫味剂与包衣是应用最多的2 种掩味手段,通常以矫味剂为基础,与其他掩味手段联用以保证掩味效果;而多层包衣则是目前包衣掩味的发展趋势。制粒、固体分散体的应用在稳定增长;微囊化、形成复合物、添加pH 调节剂的有关研究也越来越多,其应用依赖于药物性质。目前的掩味趋势是将2 种或以上的技术联合使用,加强掩味效果,且同时不影响药物在体内的有效释放。
近年来,药物掩味技术和评估方法的研究进展有目共睹,但仍存在以下不足:①能够投入产业化应用的新型掩味技术少。目前已批准的药品中大多使用添加矫味剂、进行包衣、制粒等掩味方式,原因是这些方式可使用传统设备且经济简便、效果可靠;而制备复合物、固体分散体以及微囊化等工艺则尚处于实验室研究阶段,并且存在载药量低等问题,与产业化应用尚有相当大的距离。此外,对于一些苦味强烈、高剂量的药物,如何有效掩味仍是一个难题,甚至已成为某些药物临床应用的制约因素。因此,开发有效的、能应用于商业化生产的掩味技术将成为掩味领域未来几年的研究重点。②掩味制剂的评价体系亟需进一步完善和规范化。虽然国内外已经发展了多种掩味评价方式,但由于没有统一的标准或指导原则,各研究结果之间可比性差。因此,对于常用的溶出试验、电子舌试验以及口尝评价法等体内外评价方法,应分别建立起系统规范的指导原则,对溶出介质、pH、离子强度、在线( 或离线) 检测方法、志愿者培训标准、年龄、性别等作出详细而明确的规定。同时,各种评价方法本身也存在着局限性,如溶出试验与体内情况的相关性问题,建立起具有生理代表性的口腔- 胃- 小肠连续模型是溶出试验的发展方向;因此,将各种评价方法合理联合使用,才能更好地辅助掩味制剂的开发研究。随着制药行业水平的不断提高和掩味研究的不断深入,药物的临床应用将会不再受口感问题的制约,患者用药顺应性也会得到不断的改善。
作者简介:黄蓓莉(1993—),女,硕士研究生,专业方向:药物新剂型、新技术研究。
Tel:15250956612
E-mail:[email protected]
通信联系人:林巧平(1978—),女,高级工程师,从事药物新剂
型、新技术与新制剂研究。
Tel:13813954157
E-mail:[email protected]















