NO的供体药物(如硝酸甘油,NG)已被广泛用于治疗心血管疾病(如心绞痛和慢性心力衰竭)超过130年。这些药物通过释放NO来发挥作用,但直接使用NO气体存在生物利用度低、半衰期短和难以精确剂量控制等问题。为了实现基因治疗和细胞治疗的潜力,需要开发一种能够通过安全、方便、临床许可的小分子化合物来控制治疗性蛋白生产的基因开关。
近期,
瑞士联邦理工学院Martin Fussenegger团队
开发了一种由硝酸甘油(NG)响应的基因调控系统(hNORM),通过经皮贴片实现对治疗性蛋白(如GLP-1)的按需生产和释放,有效恢复了糖尿病小鼠的血糖稳态,且未对心率和血压产生不良影响。这种创新的应用方式为糖尿病等慢性疾病的治疗提供了全新的思路,使得硝酸甘油从传统的心血管药物转变为一种可以精准调控基因表达和蛋白质生产的新型治疗工具,真正意义上实现了“老药开新花”!
相关研究成果以
“Nitroglycerin-responsive gene switch for the on-demand production of therapeutic proteins”
为题于2025年2月14日发表在《
Nature Biomedical Engineering
》
上。
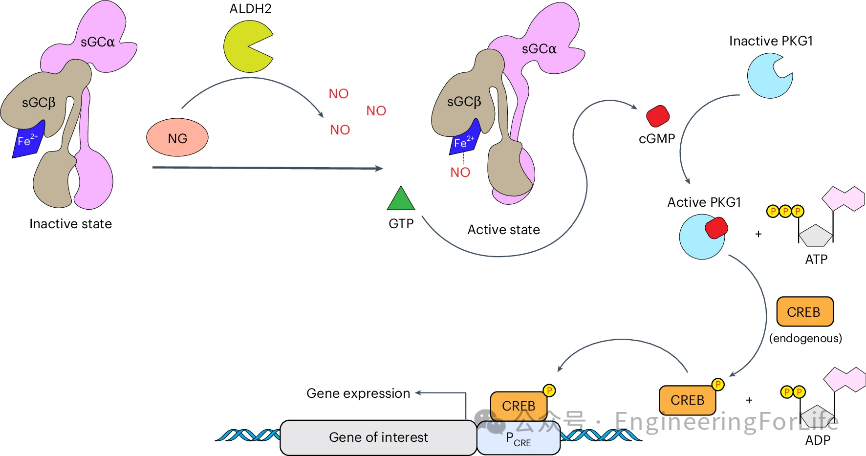
图1 hNORM在哺乳动物细胞中的分子成分和作用机制的示意图
该系统利用人类线粒体乙醛脱氢酶2(ALDH2)将NG转化为一氧化氮(NO),进而激活可溶性鸟苷酸环化酶(sGC)产生环状鸟苷一磷酸(cGMP),然后蛋白激酶G1(PKG1)放大信号并触发靶基因表达(图1)。
1. hNORM在哺乳动物细胞中的表现
首先,研究者在不同哺乳动物细胞中测试了hNORM系统的功能。在HEK-293细胞中仅表达sGC时,NO供体DETA NONOate 和SNAP(S-亚硝基-N-乙酰青霉胺)未能在24小时内诱导人胎盘分泌的碱性磷酸酶(SEAP)表达,表明该系统对NO的敏感性不足(图2a)。当共表达PKG1时,NO供体显著诱导了SEAP表达,说明
PKG1的引入增强了sGC介导的NO信号传导
(图2b)。随后,研究者进一步验证了hNORM 系统在多种哺乳动物细胞系(包括 HEK-293、HepG2、HeLa、HDFn、CHO-K1、A549、BHK-21和HT-1080)中的有效性和通用性,其中HEK-293细胞表现出最佳效果(图2c)。这些结果表明,
hNORM系统通过引入PKG1和优化细胞系,显著提高对NO的响应能力
,为后续的体内应用奠定了基础。
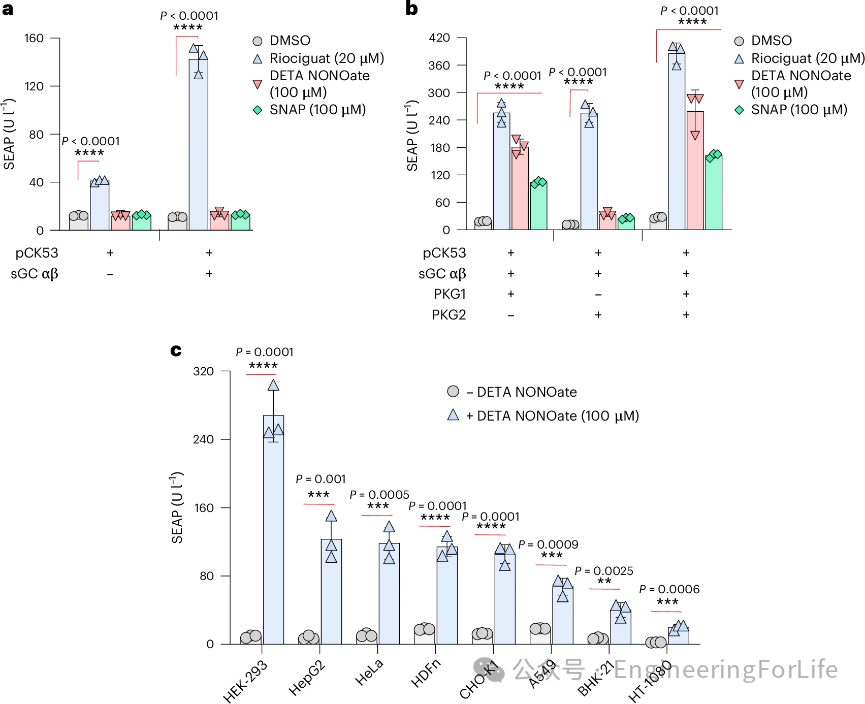
图2 哺乳动物细胞中hNORM的工程设计
2. 稳定hNORM转基因人类细胞系的生成与表征
随后,作者详细描述了构建和表征一个稳定表达hNORM系统的转基因人类细胞系(HEKhNORM1)的过程。通过将sGC(可溶性鸟苷酸环化酶)、PKG1(cGMP依赖性蛋白激酶G)以及由PCRE启动子驱动的NLuc(纳米荧光素酶)基因共转染到HEK-293细胞中,并利用Sleeping Beauty转座酶系统实现稳定整合,成功构建了HEK
hNORM1
细胞系。
HEK
hNORM1
细胞系能够高效感应NO并诱导报告基因表达(图3a)。通过检测细胞内cGMP水平,进一步证实了DETA NONOate诱导的NO能够激活sGC,产生cGMP,从而触发下游信号通路(图3b)。此外,长时间暴露于DETA NONOATE才能实现明显的转基因表达(图3C)。接着,图3d评估了该系统的可逆性,结果显示在DETA NONOate添加和移除后,NLuc表达水平能够反复上升和下降,表明hNORM系统具有良好的可逆性。DETA NONOate对HEK
hNORM1
细胞的生存和代谢无显著负面影响。此外,sGC抑制剂甲苯蓝对hNORM系统的抑制作用,表明通过甲苯蓝可以调节NLuc的表达,这为hNORM系统提供了一种应急调控机制(图3g)。
综上所述,该部分详细描述了hNORM系统的构建过程,并通过一系列实验验证了其高效性、可逆性、低毒性和可调控性,为后续体内应用奠定了基础。
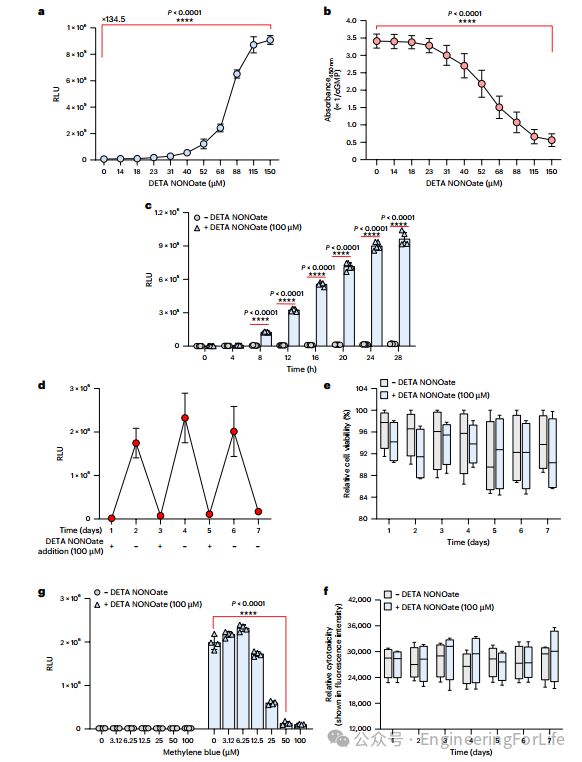
图3 HNorm显示出高功效和可调性
3. 线粒体ALDH2在体内提高未触发的HNORS性能
作者进一步探讨了线粒体乙醛脱氢酶2(ALDH2)如何增强hNORM系统在体内的性能。该团队通过在小鼠体内植入微囊化的hNORM转基因细胞(HEKhNORM1),并在植入部位上方放置硝酸甘油(NG)贴片,验证了通过皮肤给药NG来控制hNORM系统的可行性(图4a)。





