
精准医疗,亦称为个性化医疗,代表了现代医疗的一种方法,它考虑了个体的遗传、环境和生活方式差异。与传统的一刀切方法不同,精准医疗根据每位患者独特的生物特征和个人情况定制治疗方案。精准医疗的概念长期以来一直是医学实践的基础,指导着疾病的分类和基于特定诊断的治疗方案的制定。今天的新颖之处在于诊断和治疗选择的快速进步。基因学、信息学和影像学的整合,以及细胞分选、蛋白质组学、表观遗传学和代谢组学的创新,显著扩展了精准医疗的能力。对疾病异质性的深入理解凸显了精准医疗的迫切需要。微流控技术凭借其独特的优势,如高度可调性、多样化材料选择、低成本、高处理效率和低样品需求,成为精准医疗应用的理想平台。随着生物来源和治疗用纳米颗粒在精准医疗中的重要性日益增加,微流控纳米颗粒分离技术在处理个性化医疗中的宝贵样品方面表现出特别的优势。该技术不仅提高了检测、诊断、监测和治疗的准确性,还减少了医疗程序的侵入性。
来自澳大利亚阿德莱德大学的Chun-Xia Zhao团队
综述了用于精准医疗的微流控纳米颗粒分离技术的基本知识,从研究分离所需的纳米颗粒特性和指导各种微流控方法的核心原则开始。接着探讨了被动、主动和混合分离技术,详细描述了它们的原理、结构和应用。此外,本综述强调了这些技术在液体活检和纳米药物领域的贡献。最后,讨论了现有的挑战并展望了由先进材料科学、3D打印和人工智能等新兴技术推动的未来发展方向。预计这些跨学科合作将推动微流控分离技术的平台化,显著扩展其在精准医疗中的潜力。相关工作以题为
“Microfluidic Nanoparticle Separation for Precision Medicine”
的综述文章发表在2024年12月04日的期刊
《Advanced Science》。

【内容】
液体活检为诊断和预后应用提供了一种微创方法。它允许分析易于获取的生物体液,如血液、尿液和唾液,便于动态监测疾病。生物活性纳米颗粒,包括分泌蛋白和细胞外囊泡(EVs,包括外泌体),为临床医生提供了对疾病进展的敏感而持续的见解。因此,将这些生物活性纳米颗粒从复杂的体液中分离出来可以有效提高诊断和分析的准确性(图1)。例如,有效地分离EVs可以去除微囊泡、蛋白质、核酸等污染物,从而提高检测精度。
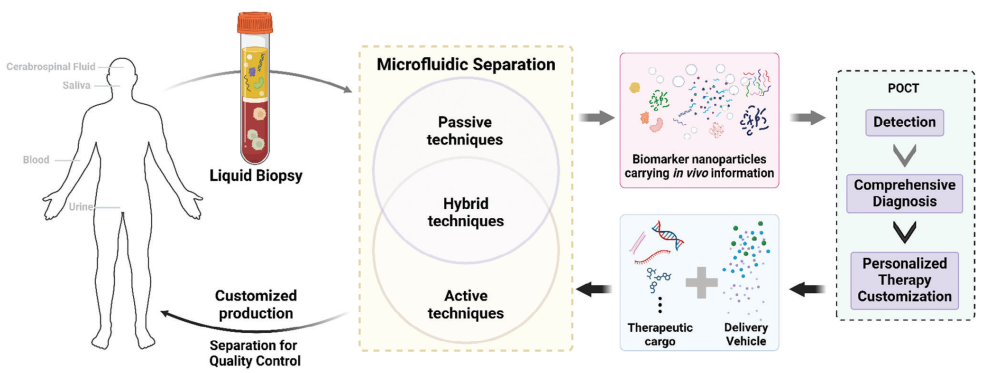
图1 微流控纳米颗粒分离在精准医学中的作用
传统方法,如超滤、超离心和尺寸排阻层析,依赖于颗粒大小,通常会导致大量样品损失和潜在的颗粒损伤。在当前的精准医疗背景下,保持纳米颗粒所携带的生物信息的完整性,以及其他特性,如电荷、形状和机械特性,已成为至关重要的。微流控技术的出现为这些纳米颗粒的分离开辟了广阔的前景,促进了疾病个性化诊断的发展,并在精准医疗中推动了纳米药物的临床转化。最初,微流控平台上的颗粒分离依赖于复杂的结构设计,通过流体动力学和通道几何形状实现,称为被动技术。随后,出现了由物理场介导的分离设计,称为主动技术。最近,各种技术的整合,即混合技术,已被报道作为一种方法,用于提高异质样品混合物中纳米级产品的分离能力,同时在分离过程中减少潜在的颗粒损伤(图2)。
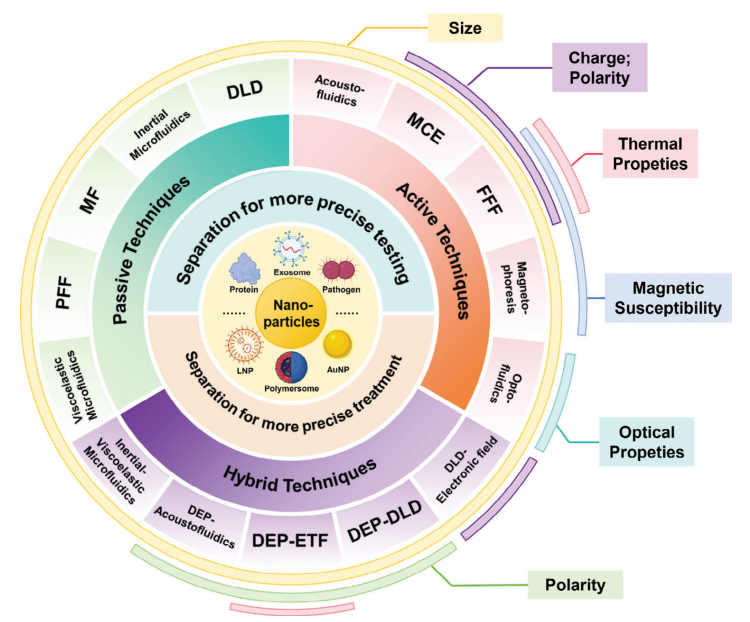
图2 微流控分离技术用于纳米颗粒
【被动微流控技术】
被动微流控技术通过设计复杂的微流控结构来控制流体相互作用,从而实现颗粒分离,特别是在分离软颗粒(尤其是生物颗粒)方面表现出优势。已报道了五种方法,包括确定性侧向位移(DLD)、微流控过滤(MF)、惯性微流控、夹流分馏(PFF)和粘弹性微流控,用于纳米颗粒分离。确定性侧向位移(DLD)通过在微流控通道中构建倾斜的柱阵列,产生具有多个分支的层流,从而分离不同大小的颗粒。自Huang等人于2004年首次报道DLD技术以来,它主要应用于生物医药相关的颗粒分离或分析,特别是对于较小的纳米颗粒(>20 nm)。一般来说,矩形和菱形两种阵列设计被认为是DLD单元(图3a,b)。
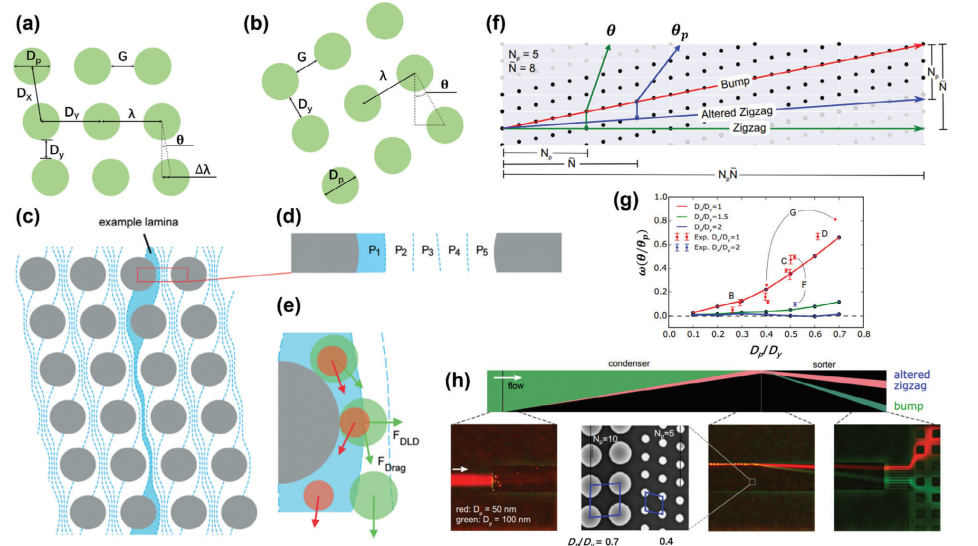
图3 基于DLD的微流控分离技术的原理和代表性例子
【微流控过滤】
微流控过滤(MF)与微流控芯片中的窄幅超滤(UF)和切向流过滤(TFF)类似,这三种方法都使用不同孔径的多孔膜进行分离。在纳米颗粒的背景下,类似于窄幅超滤的死端过滤需要高泵压。虽然这种高压在某些情况下有效,但可能会损坏脆弱的颗粒,并且经常导致堵塞问题。然而,这种方法通常被认为在实现所需纯度水平方面是可行的。另一方面,TFF的特点是分离路径或周期较长,通常需要更长的处理时间。尽管存在这些挑战,MF已经在分离EVs、生物大分子、和纳米颗粒方面展示了成功的应用。Liu等人开发了一种高度模块化的MF策略(ExoTIC),用于获得不同类型的EVs(图4a)。具有不同孔径的过滤器模块可以组装起来,以连续操作的方式富集和分离不同大小的颗粒。与传统的UC方法相比,其生产能力提高了约4–1000倍,并且相同的模块可以并行增加处理通量。该平台已成功应用于从血浆、尿液和其他液体中分离和收集不同粒径的EVs。研究表明,从EVs中提取的蛋白质和microRNA水平与黄金标准的超离心法相关性良好,这表明该设备在癌症和其他疾病中具有广泛的适用性。此外,它能够从小样本量中获得高产量分离的能力,使得基于EVs的蛋白质组和转录组生物标志物检测在下游即时检验应用中变得敏感。
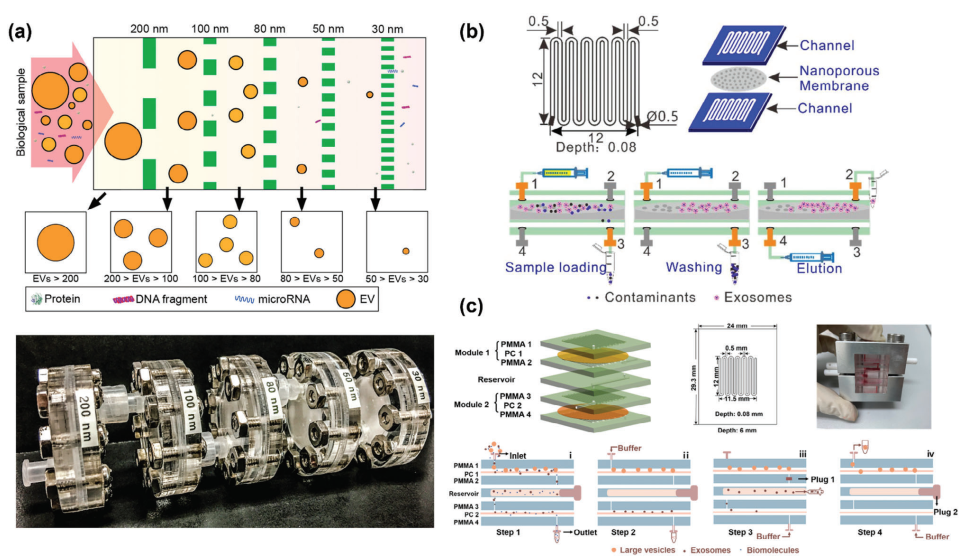
图4 微流控技术的典型例子
【夹流分馏】
夹流分馏(PFF)通过引入另一条流动线并在两条流动线的交汇处设置一个狭窄通道(夹持段),实现压缩。如图5a所示,微通道中心受到的力主要通过扩散流剖面作用于较大的颗粒。而向侧壁方向的力主要作用于较小的颗粒,在夹持段中颗粒位置的微小差异随后在拓宽段被显著放大,从而导致颗粒根据其大小相对于流动方向垂直分离。到目前为止,PFF主要用于生物颗粒分离。
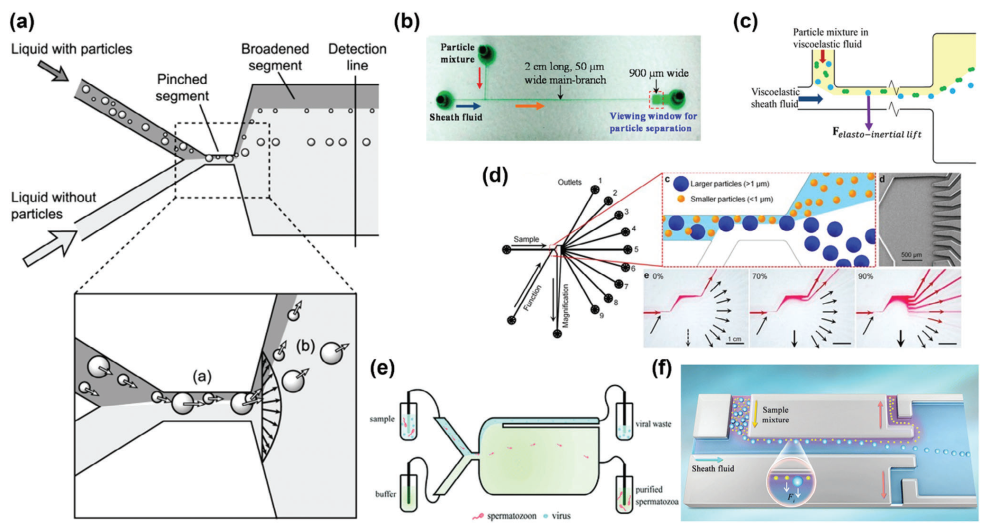
图5 夹流分馏的典型例子
【粘弹性微流控】
粘弹性微流控的聚焦效果在一定程度上受到各种参数的影响。Fan等人应用了一个截面逐渐缩小且高纵横比的微通道,以增强流体动力并改变力的方向(图6b)。这种方法可以有效地聚焦大小在500到860纳米之间的颗粒。由于血浆的自然粘弹性,它已被用于从血液中分离EVs和外泌体。Nam等人开发了一种并行粘弹性微流控系统(图6c),并实现了比离心法高出约4.8倍的微泡分离效率。该系统还由于没有外部场的存在而表现出优异的生物相容性。为了改进这种方法,Meng等人引入了一个双模块粘弹性流体系统来处理全血,去除细胞并分离外泌体(图6d)。该方法实现了87%的回收率和超过97%的外泌体纯度,展示了低成本和高效率的优势。更重要的是,他们通过质谱和蛋白质组学分析证实,使用这种微流控方法纯化的血液来源的小EVs与常规超速离心法纯化的EVs具有相似的蛋白质组成,表明该方法有效地保留了小EVs携带的信息。此外,他们还验证了从20名健康供体和20名癌症患者的血液中分离出的小EVs的浓度和尺寸分布与黄金标准的超速离心法一致。当与下游分析相结合时,如基于表面等离子体共振的检测,用于精确的疾病特异性小EVs监测,这种方法成为一种多功能的临床工具。
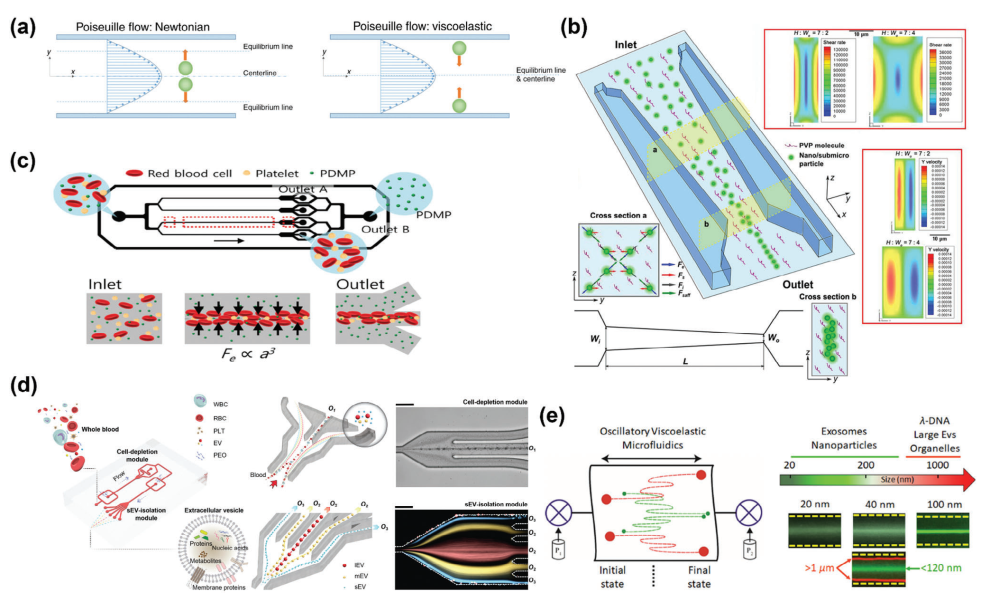
图6 粘弹性微流控的原理和代表性例子
【动微流控技术方法】
主动微流控分离技术,包括声学、电学、光学和磁场,已被广泛应用于纳米颗粒(包括EVs和生物大分子)的操作和分离。这些方法通过在微流控环境中引入外部场,促进了对较小颗粒的操控,并基于电荷、形状和磁性等额外的颗粒特性拓宽了应用范围。值得注意的是,它们允许表面特异性标记策略,适应电荷和生物颗粒特性,从而为区分和分离相似大小的颗粒提供了更多可能性。
【混合微流控技术】
混合微流控技术在纳米级颗粒分离方面取得了显著进展,新兴研究正在探索其在纳米颗粒分离中的有效性。上述讨论主要集中在应用于各种纳米颗粒的技术,特别是关注流体中对颗粒施加的力,这些力对于其独特的行为至关重要。虽然一些技术声称能实现高处理吞吐量,并同时分离较小的纳米颗粒或达到更高的纯度,但它们通常采用串联或并联配置。例如,惯性微流控或粘弹性微流控经常与夹流分馏结合使用。本节将深入探讨不同技术之间的混合策略,特别强调整合不同技术进行颗粒操控。
免疫亲和技术因其高特异性而广泛应用于分离、筛选和检测。在分离技术中,免疫亲和技术由于其标记特性而独树一帜,提供卓越的特异性和准确性。然而,它也伴随着更高的成本、有限的应用范围,并且需要特定的专业知识和对某些后处理操作的见解。由于上述其他技术并不直接与免疫亲和中使用的配体或抗体相互作用,因此与其他技术的混合通常是通过使用载体(如免疫磁珠)或将抗体修饰以附着于颗粒或基底上,用于分离和捕获目的来实现的。
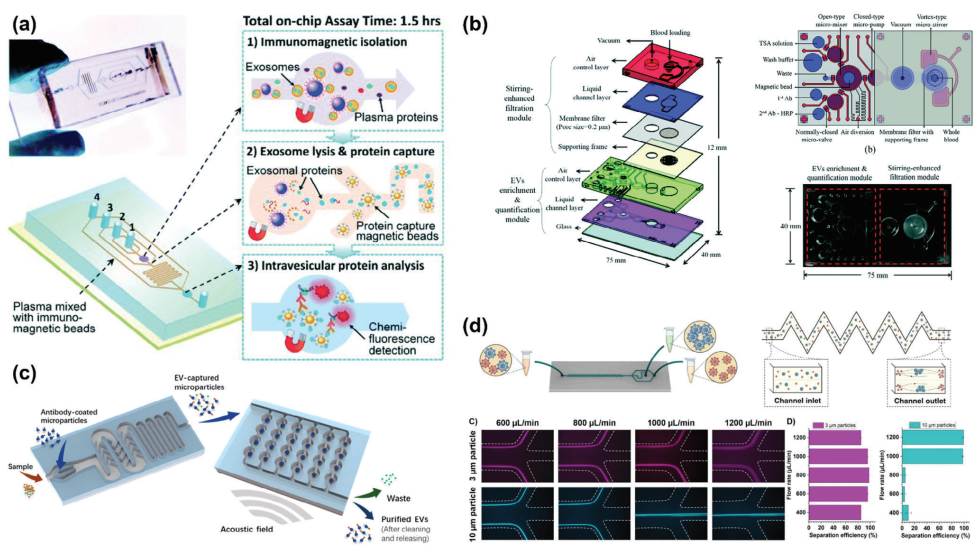
图7 基于免疫亲和性的混合微流控技术
被动微流控技术的混合通常通过串联集成来实现。例如,Liu等人串联连接了模块化的MFs(微流体装置),以实现EVs和外泌体的级联分离。Kim等人构建了两个方向相反的DLD(确定性侧向位移)设备,以实现聚焦和分离功能。然而,不同非外部场介导的微流控技术的混合并没有显示出太多优越性,因为这些方法大多主要依赖于颗粒大小进行分离。















