 关注小药说药,一起成长!
关注小药说药,一起成长!
T细胞耗竭是一个笼统的术语,泛指抗原特异性CD8+T淋巴细胞存在的所有丧失功能的状态,这种现象最早在人类免疫缺陷病毒(
HIV
)感染的患者中观察到,这些细胞持续存在,但无法清除致病性威胁。阻断耗竭的CD8+T细胞(
CD8+Tex
)表面共抑制受体,如程序性死亡受体1(
PD-1
),可以重新激活T细胞的细胞溶解作用。
在癌症中,CD8+Tex对肿瘤细胞同样反应低下。这些丧失功能的CD8+Tex表达高水平的PD-1,主要存在于肿瘤微环境(
TME
)中,通过检查点阻断剂(
ICB
)的作用可以将这些表达PD-1的细胞从无反应、耗竭状态中拯救出来。
然而,目前对CD8+Tex的理解正在发生转变。最新的单细胞转录组学和全基因组表观遗传学研究进展对这一观点提出了挑战,关于CD8+Tex的空间分布、异质性以及ICB对它们的作用,已经有了新的见解。我们现在知道PD-1的表达并不是细胞功能障碍和衰老的绝对指标,相反,PD-1的表达强度反映了CD8+Tex的复杂异质性。最新的数据表明CD8+Tex是一个发育连续体,其中谱系由干细胞样
PD-1
lo
CD8+Tex
前体祖细胞到终末功能失调的
PD-1
hi
CD8+Tex
。在癌症中,这些CD8+Tex亚群在正常外周组织和肿瘤组织中的分布不均匀,并且对ICB的反应不同。
T细胞耗竭与抗原的持续驱动作用息息相关。在急性感染的状态下,幼稚的CD8+T细胞分化为短命效应细胞(
SLEC)
或记忆前体效应细胞(
MPEC
)。在抗原清除后,大多数SLEC死亡,而MPEC存活形成记忆性CD8+T细胞,形成长期保护性免疫。
而在慢性感染下,观察到高亲和力抗原特异性的CD8+T细胞分化为SLEC迅速清除,死亡,但没有形成MPEC亚群。相反,针对低抗原亲和力的CD8+T细胞扩增、耗竭,表现为增殖、细胞毒性和细胞因子产生的显著减少,并在对抗持久性抗原的僵持中死亡。

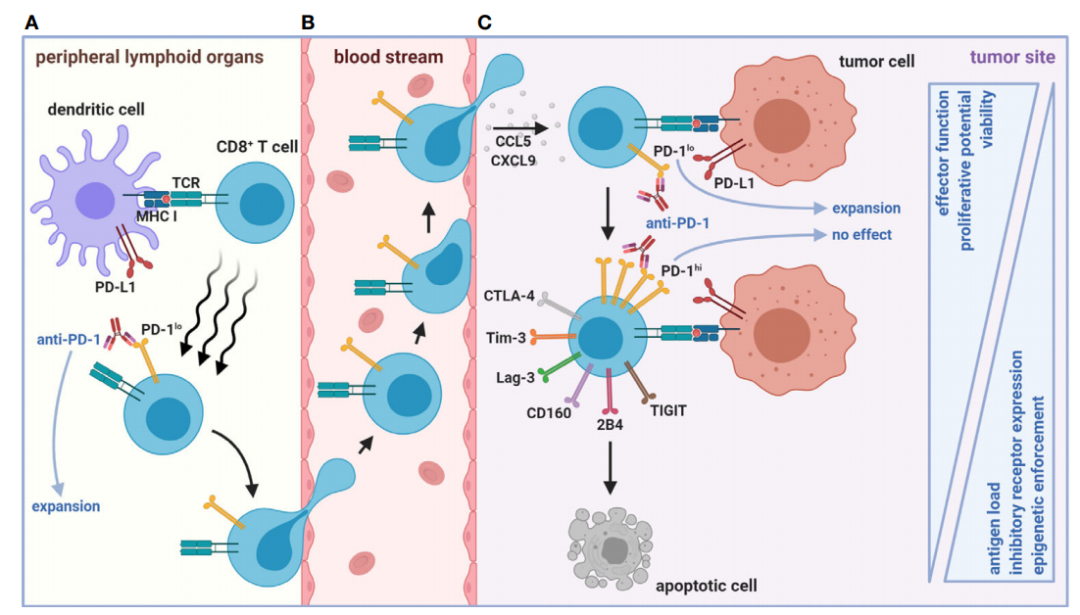
慢性病毒感染和癌症的一个共同特征就是,两者都是以抗原的持久性作用为特征的长期疾病。针对肿瘤抗原的幼稚CD8+T细胞首先在外周淋巴组织启动,产生具有自我更新特性的干细胞样
PD-1
lo
CD8+T
细胞,在趋化因子CCL5和CXCL9的作用下,向TME迁移并形成具有效应作用的
PD-1
lo
CD8+Tex
。然而,TME中持续的抗原负荷最终迫使这些细胞持续分化为丧失功能的
PD-1
hi
CD8+Tex
。
PD-1
hi
状态伴随着协同抑制受体表达的增强(包括Tim-3、LAG-3、CD160、2B4、TIGIT和CTLA-4)以及效应器功能的逐渐丧失。一旦CD8+Tex进入
PD-1
hi
状态,表观遗传会强制阻止去分化回到功能性干细胞样和效应器样
PD-1
lo
状态。ICB(例如,抗PD-1)促进的抗肿瘤反应仅来自淋巴或肿瘤内
PD-1
lo
CD8+Tex
亚群的扩增,功能低下、ICB抵抗的
PD-1
hi
CD8+Tex
最终会凋亡。
肿瘤和慢性病毒特异性CD8+T细胞都具有与TCR信号相关基因的显著富集(
Batf、Egr2、Ezh2、Irf4、Nfatc1、Nfatc2、Nr4a1、Nr4a2和Nr4a3
)。这一观察结果进一步证实了抗原的持久性参与是耗竭的主要驱动因素。
耗竭的开始伴随着共抑制受体的表面表达,共抑制受体控制着CD8+T细胞的功能。这些免疫检查点,包括PD-1,进一步抑制T细胞活化,防止过度的不良炎症和自身免疫事件。在针对病毒的研究中,人们首次发现PD-(L)1的ICB可使CD8+Tex恢复活力。重要的是,反应的恢复源于PD-1+CD8+Tex,而不是从头开始的PD-1−CD8+T细胞启动。这项早期研究提出了这样一个观点,即CD8+Tex的重新激活实际上是耗竭“逆转”的同义词。此时,ICB迅速进入临床,并建立了癌症治疗的新模式,在有限的患者群体中产生了持久的反应。尽管ICB早期取得了成功,但ICB背后的作用机制仍然难以捉摸。
进一步的研究发现, PD-1+CD8+Tex可进一步分为
PD-1
lo
和
PD-1
hi
亚群。
由此产生了一个假设,即PD-1lo细胞随着CD8+T细胞的耗竭而分化为
PD-1
hi
亚群。
在这一理论中,复苏并不等同于衰竭的逆转,即由
PD-1
hi
转变为
PD-1
lo
或
PD-1
-
。
有益的反应完全来自于动员未完全耗竭的
PD-1
lo
细胞,而不是
PD-1
hi
终末衰竭的T细胞。
体外研究表明,将抗原特异性的
PD-1
lo
和
PD-1
hi
分选细胞转移到小鼠体内后,在有无抗PD-L1的情况下用抗原再次激发,结果表明,只有
PD-1
lo
CD8+Tex
能够对ICB产生反应。
PD-1
hi
亚群与随后其他共抑制受体的表达相关,包括Tim-3、LAG-3、CD160、2B4, CTLA-4以及TIGIT,其中具有共抑制受体高表达的细胞显得更加耗竭。
同样明显的是,CD8+Tex的异质性存在于比表面PD-1表达更深的水平,其中CD8+Tex似乎使用相同的T-box家族转录因子, T-bet和eomesodermin(
Eomes
)的表达,来区分SLEC和MPEC谱系,它们具有不同的表达模式、核定位以及发育的连贯性。
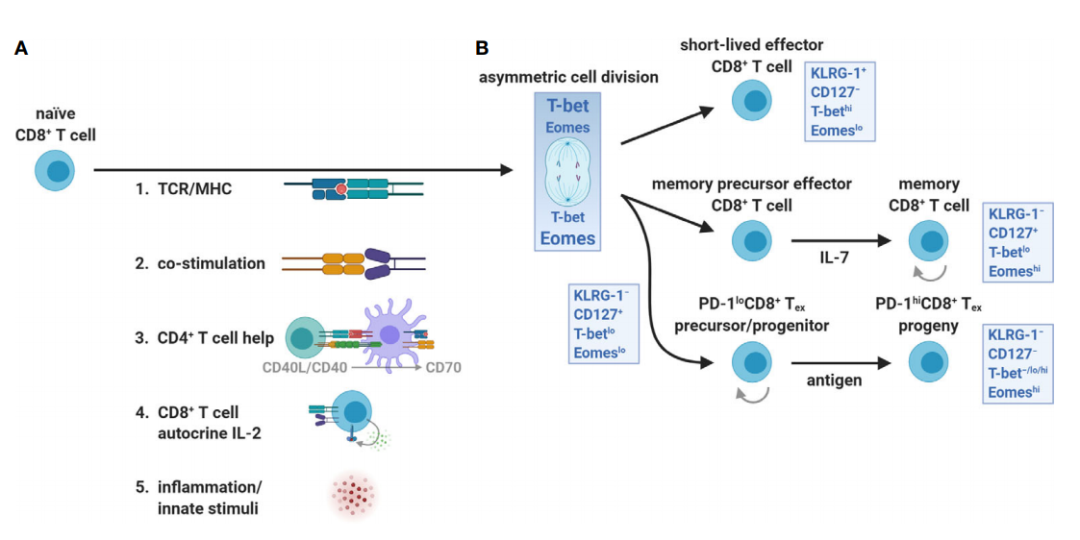
作为对TCR/MHC结合和免疫突触形成的响应,一个幼稚的CD8+T细胞将不对称分裂和分割T-bet和EOME,分别从第一次分裂中决定效应器细胞与记忆细胞的命运。与SLEC和MPEC不同,T-bet和EOME是CD8+Tex发育的双重需要。此外,这些转录因子似乎出现在CD8+Tex的不同阶段,其中
PD-1
lo
T-bet
lo
CD8+Tex
被发现Eomes表达增加并维持其核定位,分裂和分化为
PD-1
hi
T-bet
−
/lo/hi
Eomes
hi
CD8+Tex
。T-bet和Eomes的这种变化也表明CD8+Tex是一个独特的谱系。
PD-1lo群体的转录组分析显示ICSO,CXCR5,Bcl-6和TCF-1的表达,这使人联想到CD4+滤泡辅助T细胞(
Tfh
),这就是为什么CD8+Tex有时被称为Tfh样细胞。TCF-1作为Notch受体下游的主要转录因子,作为进化保守的Wnt信号通路的一部分,已知对T细胞胸腺发育和记忆形成至关重要。
PD-1
lo
CD8+Tex
在TCF-1介导的生存作用下,胸腺细胞选择相关的高迁移率组(
HMG
)盒蛋白TOX与PD-1共同上调,TOX是一种以结构依赖性方式结合DNA的核蛋白,TOX直接与结合到ORC1(
HBO1
)的组蛋白乙酰转移酶相互作用,并与DNA甲基转移酶3A(
DNMT3A
)、3B(
DNMT3B
)和zeste同源物2增强子(
EZH2
)间接协调活性,以表观遗传的方式引导CD8+Tex到终末耗竭。
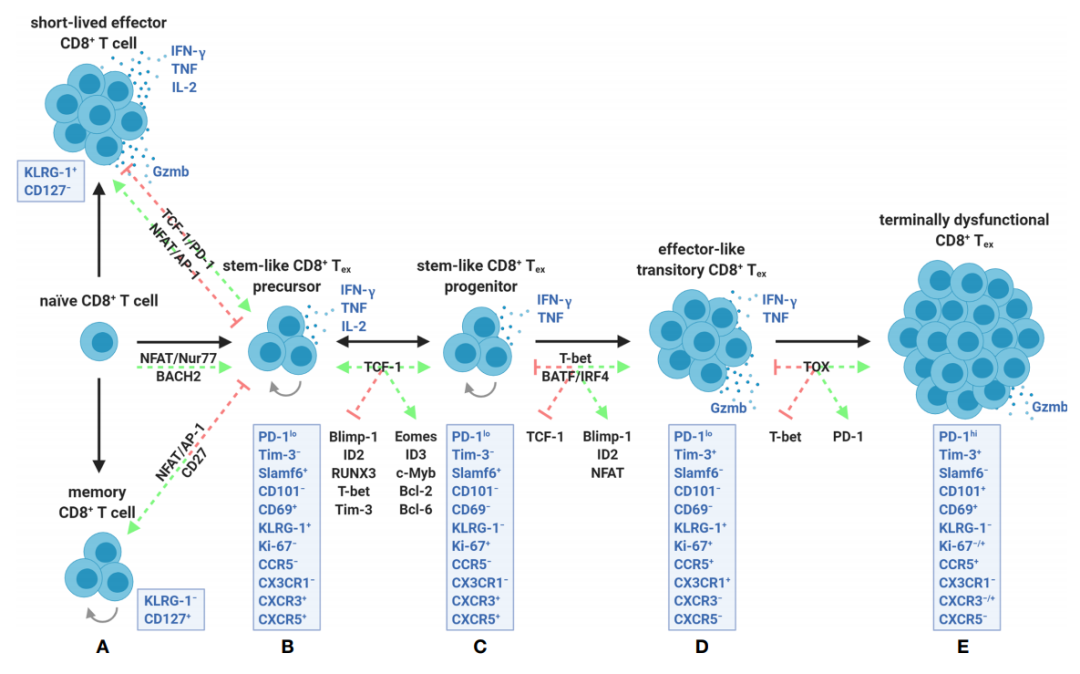
研究发现,干细胞样CD8+Tex细胞最初是稳定的。然而,在ICB治疗后,这些细胞迅速进入T-bet驱动效应器样的短暂状态,标记为
CX3CR1
+
KLRG-1
+
CD101
−
PD-1
lo
Tim-3
+
,其快速增殖,暂时产生颗粒酶B,最终转变为完全耗竭的
CX3CR1
−
KLRG-1
−
CD101
+
PD-1
hi
Tim-3
+
CD8
+
Tex
。
CD8+Tex似乎代表了一个分化能力有限的谱系,存在于一系列固定顺序的表观遗传作用中。尽管
PD-1
lo
CD8+Tex
的重新激活可产生效应器样转录活性,但细胞似乎受到限制,因为它们最终会响应ICB而耗竭,并且无法分化为急性感染期间存在的真正效应器记忆细胞。因此,在肿瘤免疫的背景下,了解这些转化在体内发生的位置(
LN与TME
)以及如何稳定暂时效应器样状态是最大限度地发挥干细胞样CD8+Tex的细胞溶解潜能的关键。
干细胞样
TCF-1
+
PD-1
lo
CD8+Tex
在控制ICB预后方面的意义可能在于其治疗前的频率以及癌症期间其他免疫细胞类型之间的串扰。使用单细胞RNA测序(
scRNA-Seq
)对TIL异质性进行的研究表明,活化、扩增和耗竭的CD8+T细胞亚群在不同的肿瘤样本中存在差异,并基于TCF-1的表达有效地聚集。
一项研究分析了48例转移性黑色素瘤活组织检查,包括接受ICB治疗的17名应答者和31名无应答者。CD8+T细胞根据scRNA-Seq表型分为早期激活、记忆、效应和耗竭谱系。在大多数患者中观察到所有CD8+T细胞亚群,尽管程度不同。然而,肿瘤内
TCF-1
hi
与
TCF-1
lo
TIL的相对频率可预测患者对ICB的反应性。此外,在多个肿瘤适应症中也观察到了类似的CD8+Tex。
此外,研究发现干细胞样
PD-1
lo
CD8+Tex
表达CXCR5,CXCR5的功能在肿瘤免疫学中不太为人所知,但可能与干细胞样CD8+Tex的定位有关。CXCR5+TIL在非小细胞肺癌(
NSCLC
)肿瘤中被发现,并且可能与肿瘤内三级淋巴结构(
TLS
)相关。CXCR5促进这些结构内的定位很有诱惑力,虽然只有少数肿瘤内干细胞样T细胞表达CXCR5,但
TCF-1
+
PD-1
lo
CD8+Tex
似乎也定位为TME中,这意味着肿瘤内可能存在支持抗肿瘤免疫的其他微环境。
在前列腺癌、膀胱癌和肾癌活检的组织学分析中,
TCF-1
+
CD8+















