癌症的临床治疗方案面临诸多棘手问题,如药物递送效率低、潜在副作用大以及治疗过程不够便捷等,严重制约了治疗效果。
压电催化疗法(PCT)作为一种新兴的基于活性氧(ROS)的动态治疗策略,凭借其深层组织穿透能力和在缺氧肿瘤中的优势,展现出巨大的应用潜力
。
随着纳米医学的进步,基于压电纳米粒子(PNPs)的PCT在精度上比传统的放化疗具有潜在的优势,但可能会引起疼痛和潜在的组织损伤。可溶微针(MN)贴片是一种新兴的微创透皮给药方法,允许负载的药物局部作用于浅表肿瘤或进入体循环进一步分布,
但其局限性包括渗透深度有限,药物分布不均匀以及难以获得足够的治疗剂量以治疗更深或更大的肿瘤。

为攻克这些难题,
来自四川大学的吴家刚教授团队
创新性地提出了一种可穿戴柔性超声微针贴片(wf-UMP)
,
旨在通过一体化设计,将可拉伸的无铅超声换能器阵列、生物粘附水凝胶弹性体和可溶解的微针贴片有机结合,为癌症治疗提供一种方便、高效且微创的便携式平台。
相关研究成果以
“Wearable flexible ultrasound microneedle patch for cancer immunotherapy”
为题于2025年3月18日发表在
《Nature Communications》
上。
1.wf-UMP的设计
wf-UMP用于癌症治疗的设计如图1a所示,旨在适应肿瘤部位并以最小的活动限制实现便携式治疗。它有序集成了可拉伸的US换能器阵列、生物粘附水凝胶弹性体以及用于药物递送的可溶解MN贴片(图1b)。当wf-UMP贴附时,可溶解的MN贴片刺入皮肤并溶解,随后释放负载的压电纳米颗粒,在超声刺激下加速扩散并产生ROS用于肿瘤治疗,进一步诱导改善抗癌免疫反应(图1c, d)。MNs呈圆锥形,高度为600μm,基部直径为250μm,针间距为550μm,以20×20阵列排列在10mm×10mm的区域上,实现有效皮肤穿透并进入真皮层(图1e)。负载的化学改性mKNN压电纳米颗粒作为压电催化剂,尺寸小于100纳米,对超声压力引起的结构变形敏感,有助于电荷分离,从而确保高效ROS生成(图1f, g)。NHS酯基生物粘附水凝胶厚度约为1mm,应用于US阵列和MN贴片之间,以实现最佳的组织-设备整合。该水凝胶具有显著的拉伸性能,可以与界面(换能器和皮肤)形成共价酰胺键,从而实现强粘附,用于持续的可穿戴US治疗。US换能器包含一个4×6矩阵的高性能mKNN 1-3压电复合单元,通过岛桥电极互连并封装在生物相容性硅橡胶中,实现整体拉伸性能。作者进一步量化了传感器沿x轴拉伸60%时的应变,结果表明铜互连的最大拉伸应变为~1.5%(图1i, j)。总体而言,MN贴片尺寸小且背衬膜薄,可以被较大的生物粘附水凝胶层完全覆盖并牢固粘附到皮肤上,确保wf-UMP在整个应用过程中可靠附着。最终的换能器阵列如图1k所示,突出了其在弯曲表面上的柔韧性和贴合接触。此外,wf-UMP能够承受高拉力(~5N)并保持与皮肤的无缝粘附,表明其应用于非平面表面的潜力(图11, m)。此外,H&E染色证实了MNs在小鼠皮肤中的有效渗透(图1n)。
总之,wf-UMP对软组织具有稳定而强大的粘附性,即使在与复杂表面耦合时也能确保无缝接触,从而促进有效,无痛的药物传递和持续治疗。
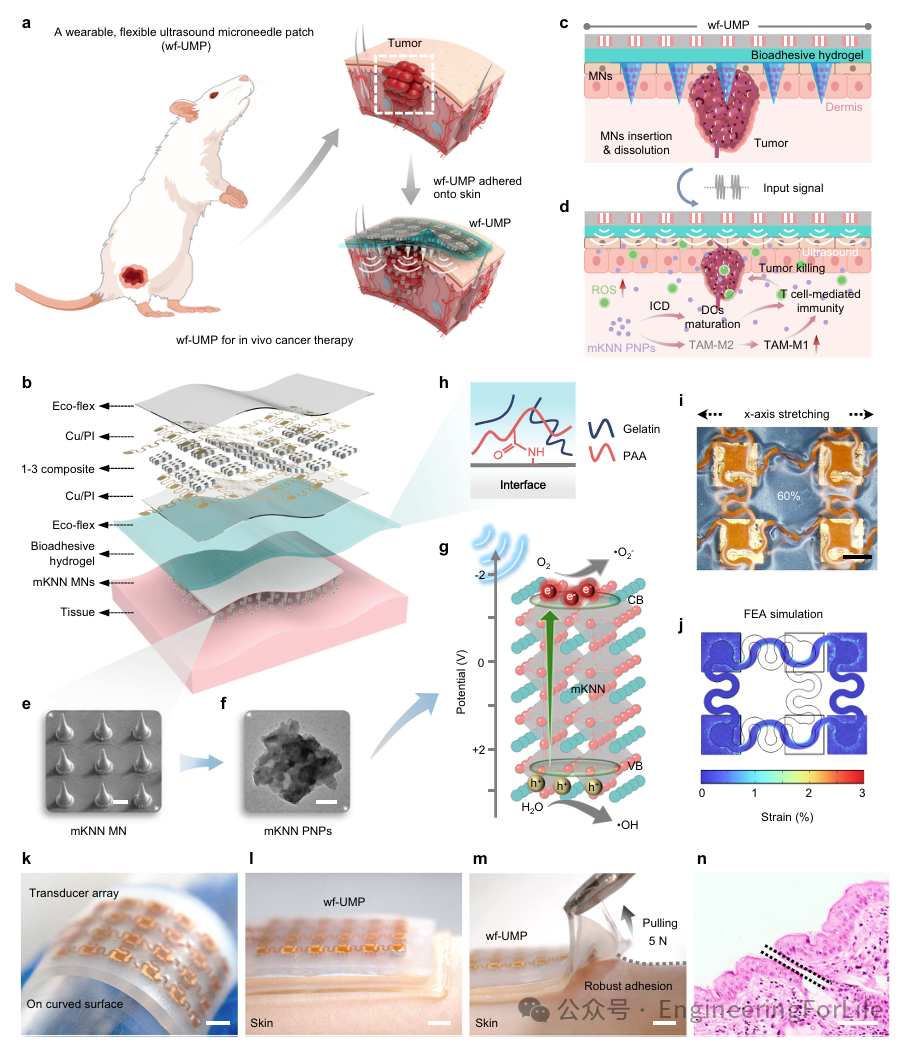
图1 wf-UMP的概述
2.wf-UMP的表征
在可穿戴电子设备的生物安全性背景下,选择高性能的mKNN陶瓷作为换能器阵列的机电转换功能材料,并进一步加工成1-3压电单元,以增强厚度机电耦合系数(k
t
)并降低声阻抗(Z
a
)。通过阻抗谱的共振频率(f
r
)和反共振频率(f
a
)可以量化机电转换效率(图2b)。与各向同性的块状陶瓷相比,各向异性的1-3压电单元由于抑制了剪切振动模式,表现出更高的k
t
(
~0.53
)(
图2c
)
。此外,1-3压电单元的更低声阻抗进一步提高了声耦合和声传输效率。最终,1-3压电换能器的中心频率为1.2MHz,- 6dB带宽为58%(图2d)。作者评估了设备在变形下的电阻抗。wf-UMP在增加弯曲曲率下的稳定阻抗表明,机械变形对设备性能影响很小(图2e)。拉伸性能通过wf-UMP沿着x轴从0到80%的拉伸实验来评估。蛇形互连在拉伸应力下解开、旋转和扭曲,从而缓解电极岛上的应变。wf-UMP在一个方向上可逆拉伸至60%。当进一步拉伸至80%时,可以观察到蛇形互连的塑性变形以及从硅橡胶中部分剥离(图2f)。这些特殊的几何和电气设计使wf-UMP具有~60%的弹性应变水平和1.2MHz的最佳工作频率。然后通过标准的180°剥离测试证实wf-UMP在软组织上具有坚固的粘附性(图2g)。有限元分析(FEA)模拟了由wf-UMP发出的超声束模式,结果显示与表现出扩散超声场的块状陶瓷单元相比,1-3压电单元发出的超声束在纵向方向性、幅度和穿透深度方面表现出改善(图2h)。对于wf-UMP,其超声束更加汇聚,穿透深度可达约100mm,能够有效扩散并激活通过MN贴片直接注入皮肤或通过后续系统循环进入体内的mKNN PNPs(图2i)。作者测量了wf-UMP在输入电压从10 Vpp到120 Vpp范围内产生的声压,其随着输入电压的增加而增加,且高于由mKNN陶瓷制造的设备产生的声压(图2j)。关于超声暴露对人类组织的安全性评估,作者计算了wf-UMP的安全参数,发现其与输入电压呈正相关,表明wf-UMP的声输出可以灵活调整,以确保安全操作(图2k)。此外,通过红外相机直接成像评估了wf-UMP的热效应,结果显示设备热效应和热诱导药物扩散均可忽略不计(图2l)。此外,作者进一步证实超声刺激能够改善药物的扩散,表明wf-UMP具有高效的经皮药物递送潜力(图2m, n)。
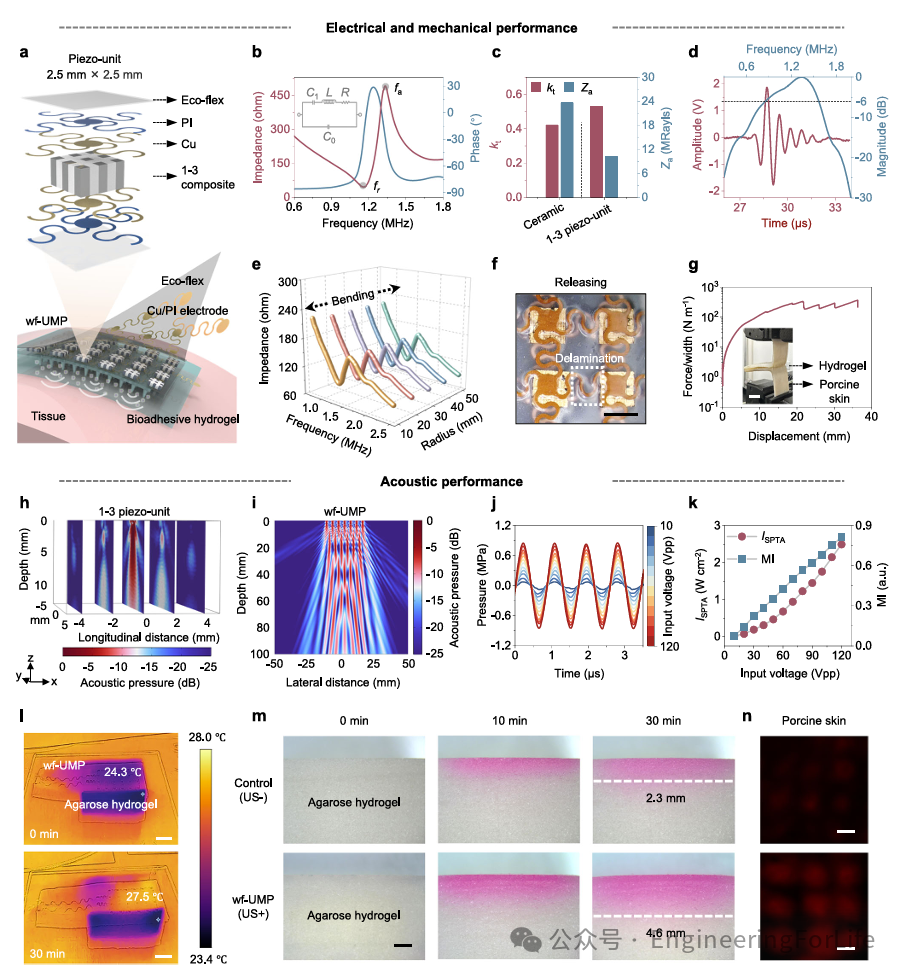
图2 wf- UMP的电气、机械和声学性能验证
3.mKNN PNPs的超声激活催化
观察到mKNN PNPs在微针中的分布相对均匀,仅有少量聚集位于尖端区域(图3a)。应用后,wf-UMP中的可溶解mKNN微针部分将在水环境或组织中迅速溶解,释放mKNN PNPs,使其能够被超声刺激激活并发挥催化功能(图3b)。优化后的mKNN PNPs呈不规则形状,尺寸小于100nm,所含元素分布均匀(图3c)。高分辨率透射电子显微镜观察到mKNN晶体中清晰且有序的晶格条纹贯穿始终(图3d)。通过X射线衍射图谱评估了mKNN PNPs的晶体结构,其与多相共存的mKNN陶瓷相似,因为较低的能量势垒将促进极化旋转,从而增强压电性(图3e, f)。通过X射线光电子能谱分析了mKNN PNPs的化学性质,结果表明氧空位可以进一步增强压电催化活性(图3g)。mKNN和KNN(未改性)的PNPs均显示出特征性的蝴蝶形状振幅曲线和矩形相位回线(图3h),然而mKNN PNPs具有更优越的内在压电响应和完整的畴切换。考虑到能量带结构在压电催化活性中的重要性,作者首先采用密度函数理论对mKNN的能量带结构进行理论研究。mKNN具有2.91 eV的间接电子带隙,其中价带最大值来自O2p轨道,而导电带最小值来自O 2
p
和Nb 3
d
轨道的耦合(图3i, j)。通过紫外-可见光谱测定的mKNN PNPs的能隙为3.91eV(图3k),超出了计算值。压电催化的机制如图3l所示,周期性超声刺激会在mKNN PNPs中诱导产生内置压电势场和能量带弯曲,这有助于电荷载流子(例如电子和空穴)的持续分离和传输,从而促进表面氧化还原反应,最终导致ROS的产生。接下来作者通过罗丹明B的降解实验评估了mKNN PNPs的压电催化活性。在超声刺激下,观察到吸收峰强度显著降低,降解率高达110×10
−3
/
min(图3m)。电子-空穴对的分离和迁移是决定压电催化效率的关键因素。因此,作者测量了mKNN PNPs在周期性US刺激下的瞬态压电电流(图3n),结果表明暴露于US刺激后,电流峰值显著,表明电荷有效分离和迁移。FEA结果揭示了mKNN PNPs在wf-UMP产生的声压下的表面压势分布,表明其有足够的能量进行载流子迁移(图3o)。最后,作者证实了ROS•OH和•O
2
-
在压催化过程中的存在(图3p)。
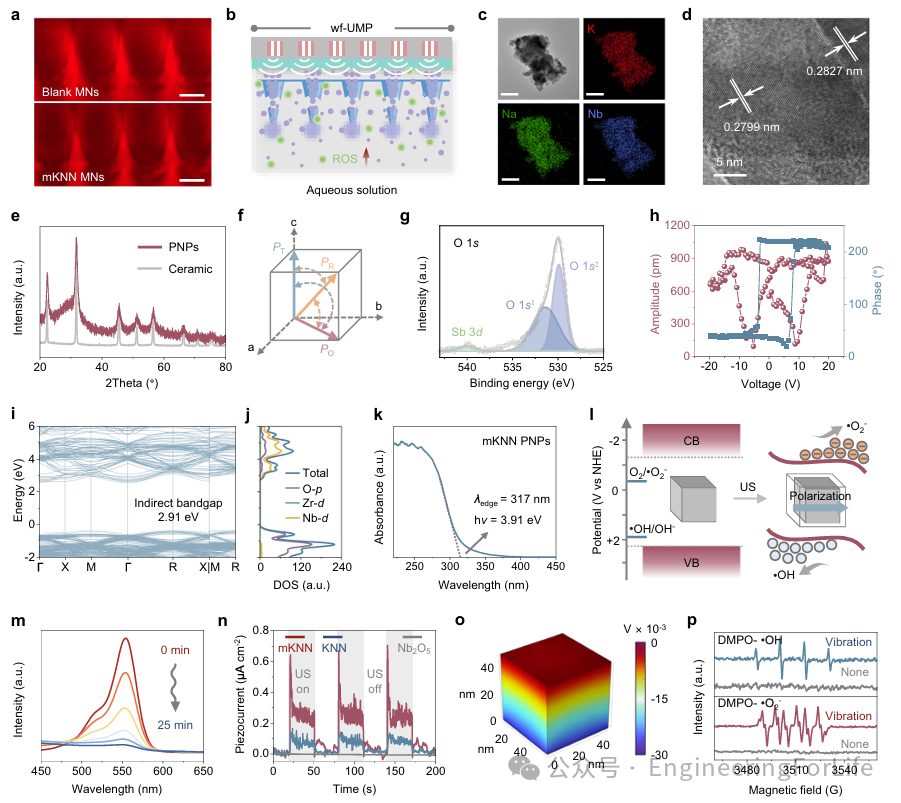
图3 mKNN PNPs的机理、结构表征和US活化的压电催化
4.mKNN PNPs的体外抗癌活性和wf-UMP的体内抗癌活性
为了阐明mKNN PNPs作为压电催化剂用于抗癌治疗的非毒性和生物相容性机制,研究了细胞内ROS的形成。结果表明,经mKNN+US处理的4T1细胞显示出细胞内ROS水平显著升高,荧光强度和平均荧光强度均较高(图4a, b)。因此,具有优越压电性能的mKNN PNPs主要通过增加ROS产生来增强肿瘤的PCT,同时将对周围健康细胞的影响降至最低。通过流式细胞术分析凋亡情况证实,与仅接受mKNN处理的4T1细胞相比,接受mKNN+US处理的4T1细胞凋亡水平显著更高(图4c)。过度的ROS产生与线粒体功能障碍有关,因此采用JC-1染色研究了线粒体膜电位(MMP)的变化。结果显示,mKNN+US组显示出最强的绿色荧光和较弱的红色荧光,表明mKNN+US显著加剧了4T1细胞的氧化应激并降低了MMP,这可能是诱导凋亡的原因(图4d)。此外,mKNN+US处理的4T1细胞的迁移数量显著减少(图4f)。因此,mKNN PNPs在US刺激下产生的细胞内ROS有效地对4T1细胞产生了细胞毒性作用,诱导细胞凋亡并抑制细胞迁移。接下来,使用4T1皮下肿瘤模型小鼠进行体内实验,研究wf-UMP抑制肿瘤生长的能力。图4g展示了wf-UMP针对早期肿瘤的治疗方案。结果显示在wf-UMP组中,肿瘤在两周内得到有效抑制,超声刺激和微针插入的影响微乎其微(4h)。具体而言,与其他组相比,wf-UMP在延缓和抑制肿瘤生长方面的效果更为显著,这进一步通过切除肿瘤的重量和体积减少得到验证(图4i, j)。对每组小鼠的生存监测结果表明,wf-UMP能够有效延长小鼠的存活时间(图4k)。值得注意的是,wf-UMP以可穿戴和微创的方式展示了有效的抗肿瘤治疗效果,其卓越的生物安全性通过小鼠体重的微小波动和主要器官的无显著毒性副作用得到证明(图4l)。肿瘤切片的H&E染色显示和免疫荧光染色显示证实了wf-UMP诱导肿瘤细胞凋亡的增强治疗效果(图4m-o)。CD31标记的肿瘤血管显示,wf-UMP组的红色区域最小,表明肿瘤血管生成受到抑制(图4p)。
综上所述,wf-UMP通过介导氧化应激放大,有效抑制肿瘤细胞的生长和增殖,为早期癌症提供了一种安全高效的PCT方法。
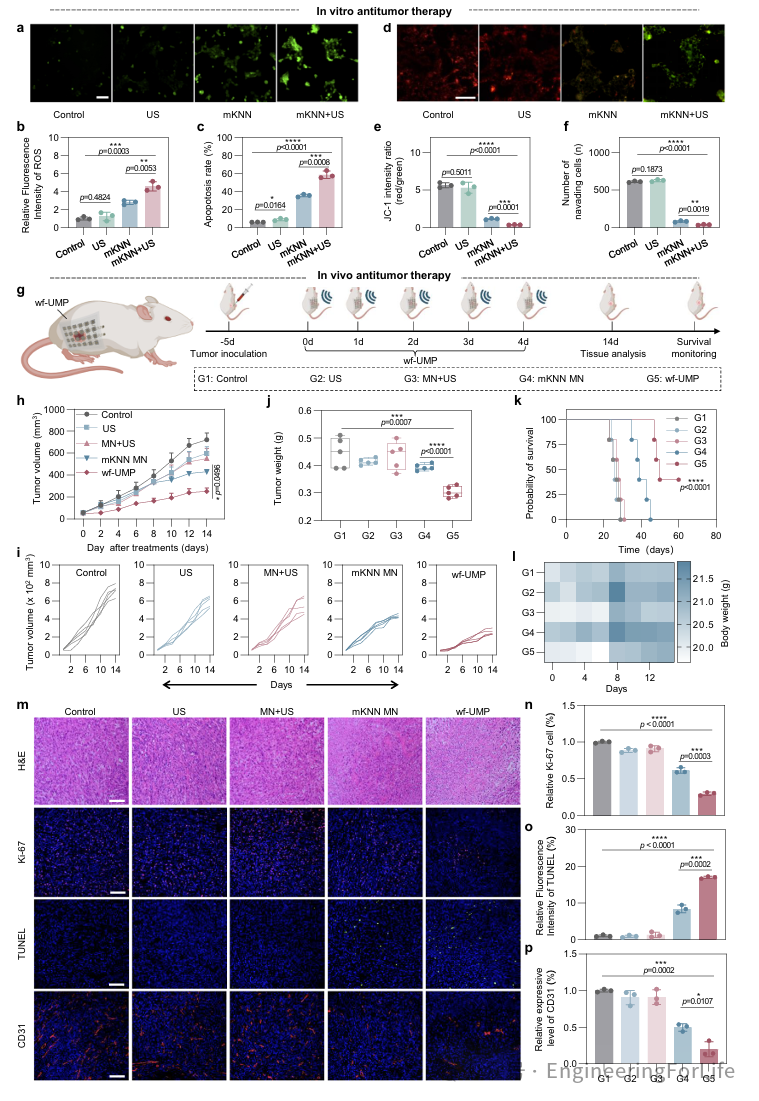
图4 mKNN PNPs的体外抗癌活性和wf-UMP的体内抗癌活性
5.wf- UMP的体内生物安全性和mKNN PNPs的代谢分布
为了进一步评估wf-UMP的生物安全性,进行了体内实验。每天将空白MN贴片、mKNN MN贴片和wf-UMP应用于小鼠,连续5天。在应用部位观察到轻微的红色炎症痕迹,但在第10天时已消退,后续每周应用过程中未检测到显著的皮肤损伤(图5a)。第10天和28天H&E染色显示,wf-UMP组与其他治疗组的表皮厚度无显著差异,证实治疗过程中未发生皮肤损伤(图5b, c)。进一步评估了主要器官(心、肝、脾、肺、肾)的系统生物安全性,结果显示各组均无毒性副作用(图5d)。第28天的血液学评估显示,白细胞、红细胞和血红蛋白水平在所有组中均正常(图5e, g)。此外,血液生化分析显示,wf-UMP组肝肾功能标志物无异常(图5h-j)。
这些结果共同证实了wf-UMP在体内癌症治疗中具有优异的生物安全性
。
通过测量铌(Nb)的浓度评估mKNN PNPs在治疗部位的代谢分布。应用wf-UMP后,在小鼠的皮下肿瘤中检测到Nb,其浓度随时间逐渐降低。然而,在整个治疗期间,mKNN PNPs保持在治疗部位,实现持续的抗肿瘤效果(图5k)。为了进一步研究wf-UMP应用后mKNN PNPs的分布,采用透射电镜观察其在小鼠皮下肿瘤中的定位,显示mKNN PNPs在肿瘤组织中积累并随机分布,且保持其形态(图5i)。
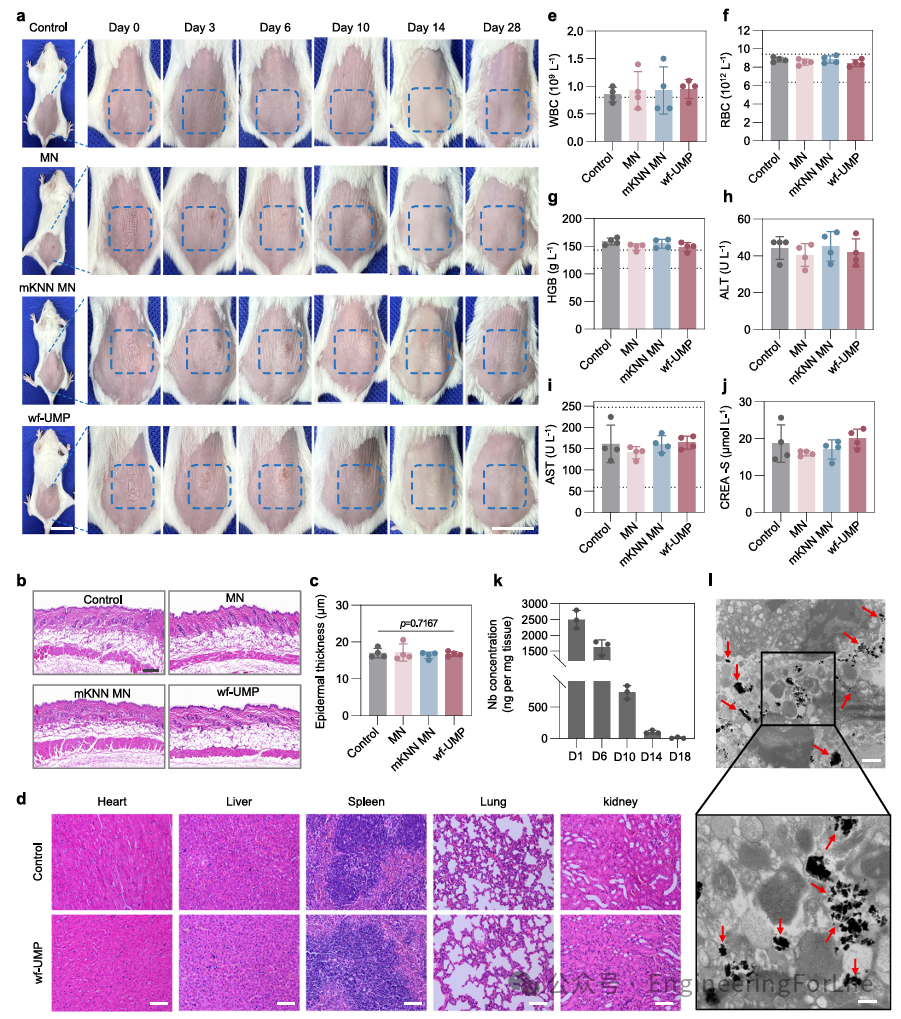
图5 wf-UMP的体内生物安全性和mKNN PNPs的代谢分布
6.wf-UMP对肿瘤进展的免疫调节作用
为了阐明wf-UMP及其抑制乳腺癌肿瘤生长的潜在分子机制,进行了RNA测序分析。在没有US激活的mKNN MN组中观察到不同的基因表达模式。在wf-UMP组与对照组之间,鉴定了467个差异表达基因(DEGs),其中248个基因表达下调,219个基因表达上调(图6a)。GO和弦图分析显示,wf-UMP调节的基因主要涉及免疫过程相关基因组(图6b)。KEGG分析发现,wf-UMP对自然杀伤细胞介导的细胞毒性、T细胞受体信号通路、细胞因子-细胞因子受体相互作用以及NF-κB信号通路等具有显著影响(图6c)。其中,细胞因子-细胞因子受体相互作用和T细胞受体信号通路在wf-UMP诱导的肿瘤消退中起关键作用(图6d, e)。适应性免疫以其持久性和特异性而闻名,是一种关键的免疫反应,能够靶向杀死肿瘤细胞。为了阐明wf-UMP调节肿瘤免疫微环境的机制,在wf-UMP治疗14天后收集了4T1肿瘤,并使用流式细胞术分析免疫表型变化。结果显示,wf-UMP诱导肿瘤中8.50%的CD8
+
细胞毒性T淋巴细胞浸润超过其他组(图6f, g)。此外,流式细胞术证实wf-UMP组肿瘤中CD4
+
T细胞表达升高(图6h)。与其他三组相比,接受wf-UMP治疗的肿瘤中髓源性抑制细胞(MDSCs)减少,自然杀伤T细胞显著增加(图6i-k)。已知肿瘤相关巨噬细胞M1具有促炎特性和对感染和癌细胞的强效应活性,而肿瘤相关巨噬细胞M2则促进肿瘤细胞生长和转移。在4T1肿瘤荷瘤小鼠中,wf-UMP组肿瘤中M1的比例和M1/M2比值显著高于对照组(图6l)。随后通过酶联免疫吸附试验检测多种细胞因子分泌水平,以进一步评估wf-UMP的抗肿瘤免疫反应。结果显示,与mKNN MN组相比,wf-UMP诱导的IFN-γ、IFN-β、IL-6和TNF-α分泌分别均有所提高(图6m-p)。
综上所述,通过重新激活免疫细胞和增强细胞因子释放,wf-UMP维持并刺激免疫细胞增殖,有助于抗肿瘤治疗。
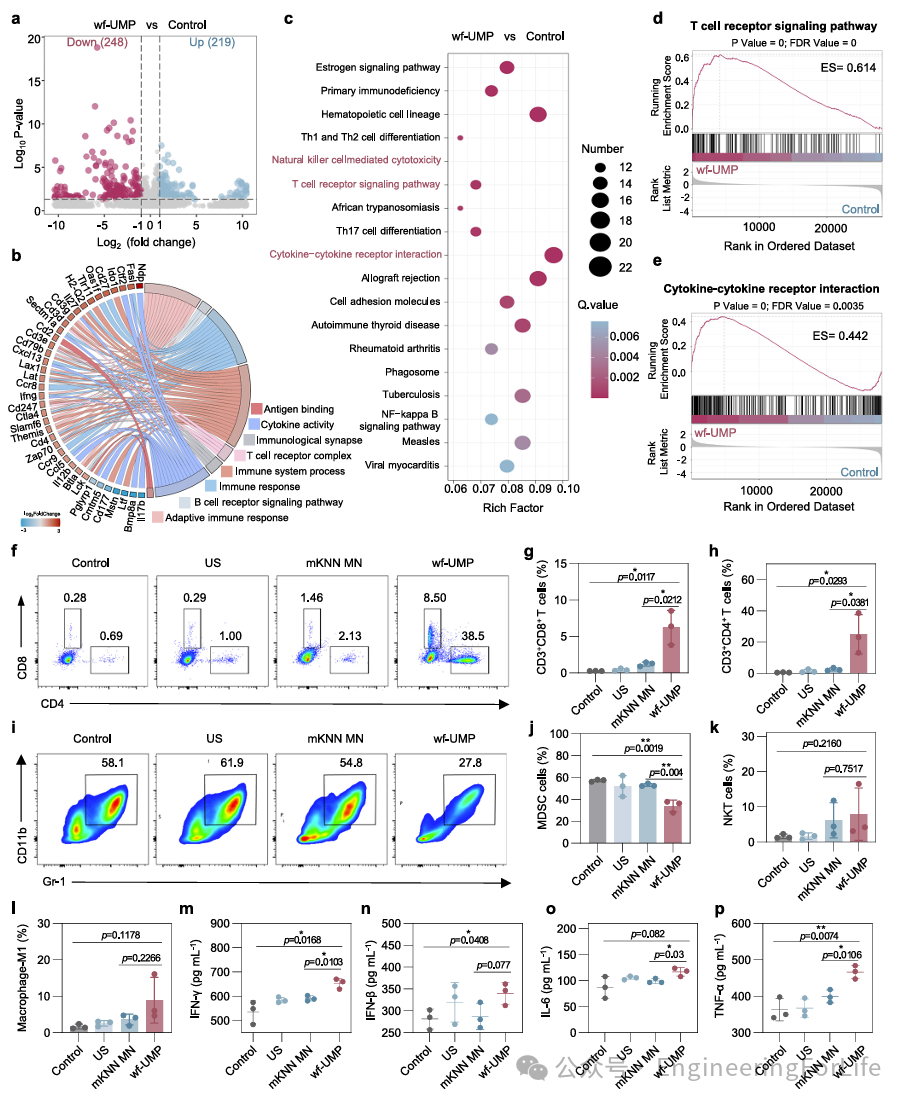
图6 wf-UMP对肿瘤进展的免疫调节作用
7.wf-UMP联合程序性死亡受体1(PD1)阻断的体外效应和治疗机制
基于wf-UMP在4T1乳腺癌皮下肿瘤模型小鼠中诱导的免疫学反应,进一步利用双肿瘤模型研究了wf-UMP与Anti-PD1联合使用在诱导系统性抗肿瘤免疫方面的协同作用(图7a)。结果显示,Anti-PD1对原发和远隔肿瘤的影响有限(图7b, c)。值得注意的是,虽然Anti-PD1+mKNN MN治疗有效抑制了原发肿瘤生长,但Anti-PD1+wf-UMP治疗在五只小鼠中的三只完全消除了原发肿瘤。此外,Anti-PD1+wf-UMP组在减少未治疗的对侧肿瘤方面表现出显著效果(图7c,d)。为了阐明wf-UMP联合PD1阻断的治疗机制,对原发和远隔肿瘤中的免疫细胞进行了流式细胞术分析。结果显示,Anti-PD1+wf-UMP组在原发肿瘤中表现出强烈的免疫激活,成熟树突状细胞(DCs)的比例显著高于其他治疗组(图7e, f)。作为专业抗原呈递细胞,DCs通过呈递肿瘤抗原在激活T细胞中起关键作用,其成熟度与抗原呈递能力相关。因此,Anti-PD1+wf-UMP组在原发肿瘤中CD3
+
T细胞、CD8
+
T细胞和CD4
+
T细胞的比例显著增加(图7g)。对于适应性免疫,Anti-PD1+wf-UMP组肿瘤内CD8
+
T细胞的百分比明显高于其他治疗组(图7h, i)。此外,CD69被认为是T细胞激活的早期标志。结果显示,Anti-PD1+wf-UMP治疗组远端肿瘤中CD8
+
CD69
+
T细胞的比例远高于其他治疗组(图7j)。同时,远隔肿瘤中M1、M1/M2比值和自然杀伤T细胞显著增加,而MDSCs和调节性T细胞(Tregs)显著减少(图7k-o)。CD8
+
T细胞在肿瘤微环境中的浸润对抗PD-1检查点抑制剂的疗效至关重要。结果显示,Anti-PD1+wf-UMP治疗组中CD8
+
T与PD-1
+
细胞的比例显著降低(图7p)。此外,Anti-PD1+wf-UMP治疗诱导了显著更高的细胞因子分泌(图7q-t)。为了促进免疫抑制,来自脾脏增大的单核细胞迁移到肿瘤微环境。流式细胞术分析了协同免疫疗法在促进外周免疫器官中细胞毒性T淋巴细胞扩增和增殖方面的能力,以阐明Anti-PD1和wf-UMP在增强抗肿瘤疗效方面的相互作用机制。结果显示Anti-PD1+wf-UMP组中肿瘤浸润T细胞(CD3
+
CD8
+
)显著增加,而MDSCs减少(图7u, v)。
这些发现表明,这种协同免疫疗法在激活免疫反应方面具有巨大潜力,有效促进细胞毒性T淋巴细胞的激活并下调免疫抑制细胞
。
此外,对原发和远隔肿瘤进行多色免疫荧光染色显示,Anti-PD1+wf-UMP治疗导致CD8
+
和CD4
+
染色增加,这对于诱导细胞毒性T细胞介导的免疫疗法至关重要。此外,F4/80
+
和CD86
+
染色显著增加,表明原发和远隔肿瘤中M1巨噬细胞增加(图7w)。
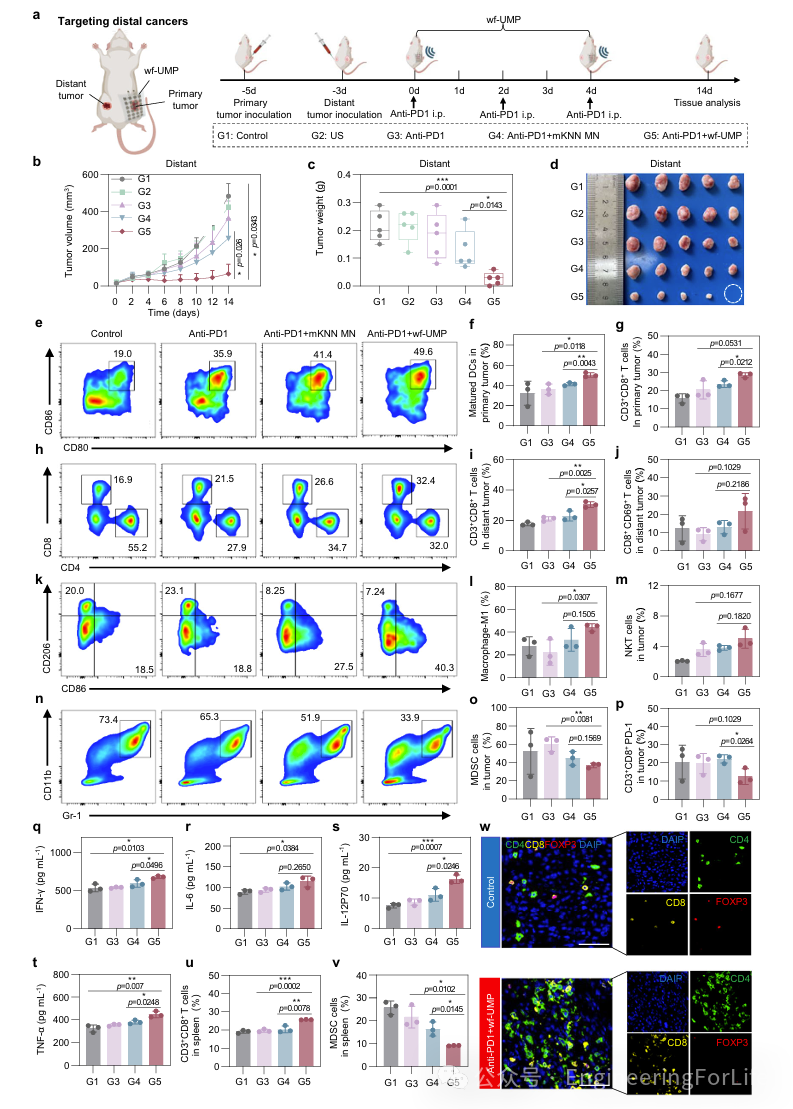
图7 wf-UMP联合PD1阻断的体外效应和治疗机制
8.长期免疫记忆功能
免疫记忆反应是肿瘤预防和复发的关键。为了评估Anti-PD1+wf-UMP治疗的免疫记忆效果,进行了肿瘤再挑战研究。在联合治疗结束后的第30天,将肿瘤重新接种到小鼠左侧,对照组为未接种过肿瘤的同龄小鼠(图8a)。结果显示,Anti-PD1+wf-UMP组有效抑制了再接种远隔肿瘤的生长,而对照组小鼠的肿瘤迅速进展,这也在肿瘤重量上得到了证实(图8b-f)。为了进一步研究Anti-PD1+wf-UMP治疗诱导的长期抗肿瘤免疫记忆,分析了脾脏中抗原特异性记忆T细胞的表达,包括效应记忆T细胞(Tem)和中枢记忆T细胞(Tcm)。结果显示Anti-PD1+wf-UMP治疗引发了持续的抗肿瘤反应,表现为CD8
+
和CD4
+
T细胞中从Tcm向Tem表型的显著转变(图8g-i)。
这些发现表明,Anti-PD1联合wf-UMP不仅诱导了特定的长期保护,还有效预防了肿瘤复发(图8j)。因此,这种联合免疫疗法在较长时间内抑制了全身肿瘤形成和复发。
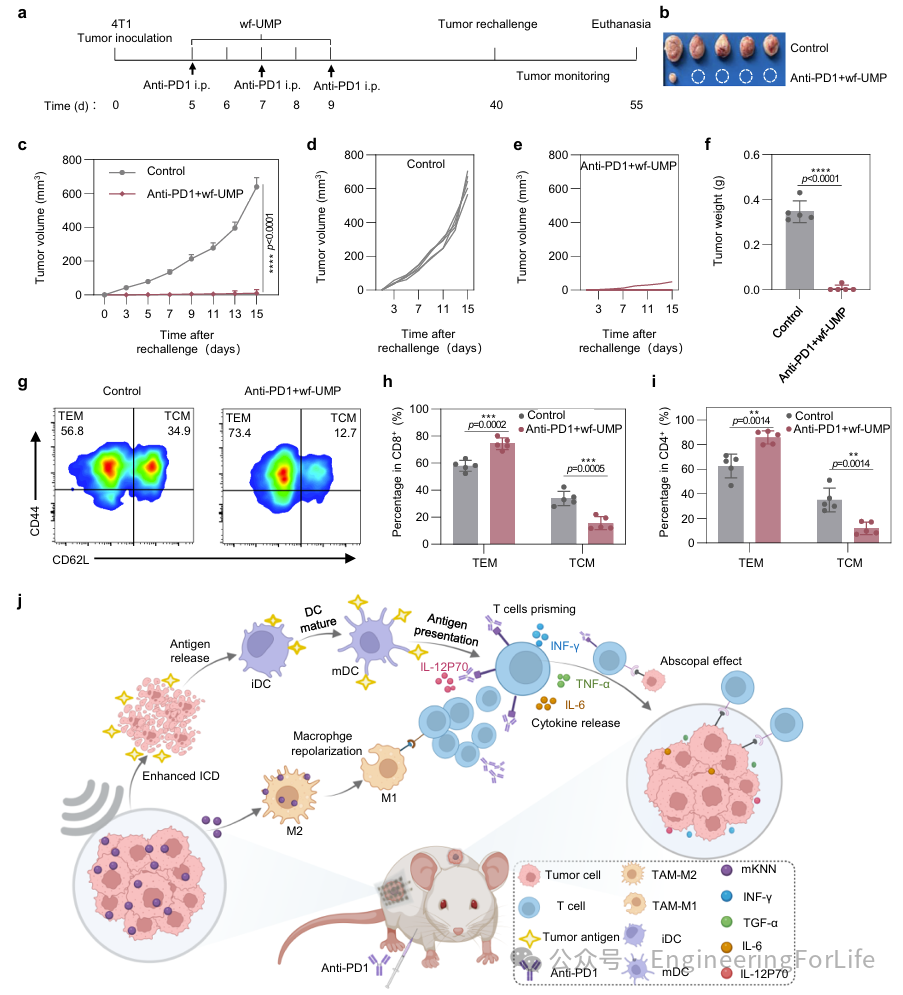
图8 长期免疫记忆功能
9.全文小结
综上所述,该研究提出了一种可穿戴柔性超声微针贴片wf-UMP,用于方便、高效和微创治疗癌症。特别是Anti-PD1联合wf-UMP呈现了一种有前景的PCT策略,通过激活DCs成熟和上调巨噬细胞M1表型极化,增强T细胞介导的抗肿瘤免疫,有效抑制肿瘤复发。
参考资料:
https://doi.org/10.1038/s41467-025-58075-z
来源:
EngineeringForLife
声明:仅代表作者个人观点,用于研究用途,作者水平有限,如有不科学之处,请在下方留言指正!






