35家企业被通报处罚,4家企业被勒令停产整改。多家企业因经营、使用过期、失效、淘汰的医疗器械被处罚,连锁公司分店上黑榜……飞检仍在如火如荼的进行中,检查严格程度非比寻常。
近日,江西省药品监督管理局发布公告通报医疗器械生产企业检查情况。
此次飞检中,相关部门于2019年7月22日至26日组织对江西格朗生物技术有限公司、江西华裕康生物技术有限公司、江西乐成生物医疗有限公司等3家医疗器械生产企业实施了飞行检查,8月13日至14日对南昌市佳辉医疗保健用品有限公司进行了监督检查。
其中,江西华裕康生物技术有限公司大门紧闭,处于停产状态,企业声称2018年10月30日起停止生产。南昌市佳辉医疗保健用品有限公司生产质量管理体系存在严重缺陷,不符合医疗器械生产质量管理规范相关规定。
江西省药品监督管理局强调,对于江西华裕康生物技术有限公司所出现的情况,企业应当完成全部缺陷项整改,拟恢复生产前,须向其书面报告,经核查符合要求后,方可恢复生产。对于南昌市佳辉医疗保健用品有限公司,江西省药品监督管理局勒令全面停产整改。
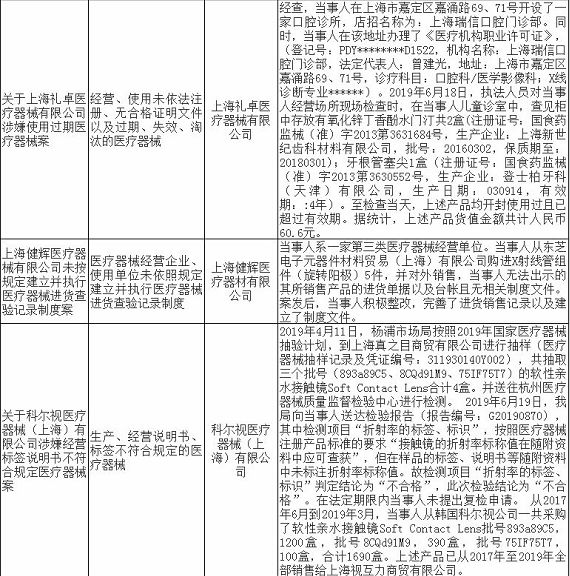
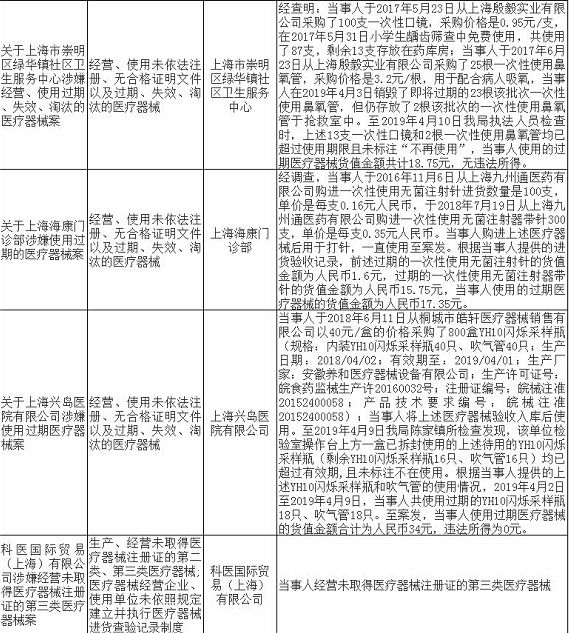
无独有偶,上海市近期有17家药企/医疗机构和18家械企共35家企业因存在违法违规行为被通报,被处罚。被处罚的35家企业中,不乏知名企业,如九州通医药有限公司,好药师大药房连锁有限公司等,好药师大药房连锁有限公司甚至有多家分店上黑榜。目前,涉事药企/医疗机构和械企均已被立案并受到惩戒,被处以警告、罚款、没收违法所得、责令停产整改等处罚。
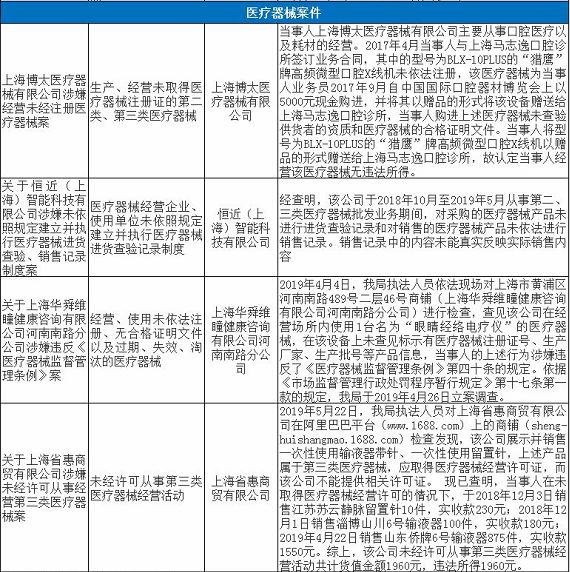
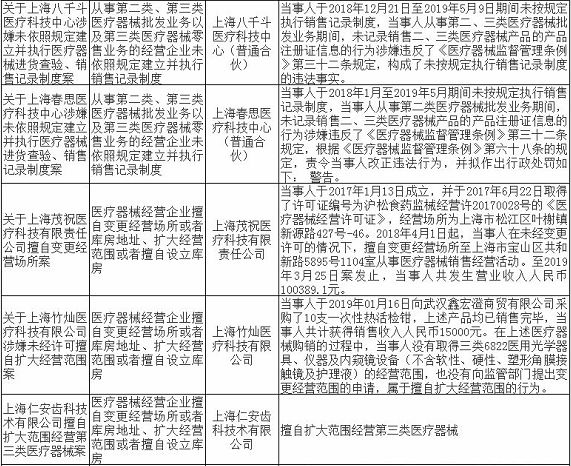
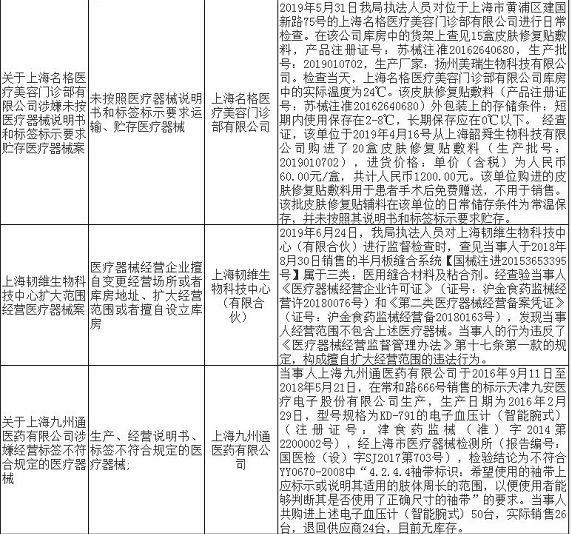
除了江西省和上海市之外,广州市近期也出现了两起停产整改事件。2019年8月13日广东省药品监督管理局发布了对英诺利科技(深圳)有限公司和安信纳米生物科技(珠海)有限公司进行的飞检结果公示,发现企业质量管理体系存在严重缺陷,不符合医疗器械生产质量管理规范相关规定,责令企业立即针对发现的问题停产整改。
近期,云南省曲靖市也开始了市内大范围的飞检活动。2019年7月11日,根据国家局《药品医疗器械飞行检查办法》等相关规定,按照《曲靖市市场监督管理局关于印发2019年曲靖市医疗器械飞行检查工作实施方案的通知》(曲市监办发〔2019〕22号)文件要求,曲靖市市场监督管理局对师宗县、会泽县共9家医疗器械经营、使用单位进行飞行检查。检查结果显示,企业仍存在非常多的问题。
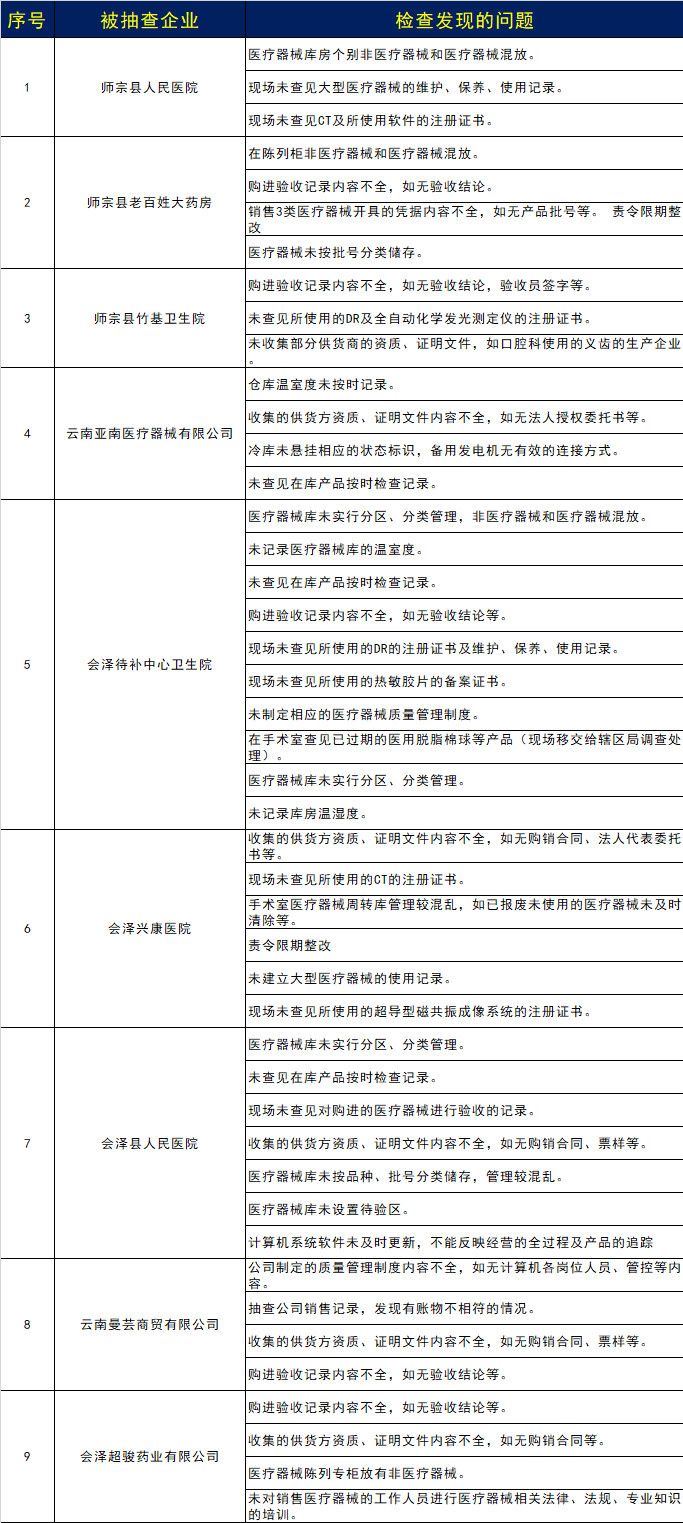
飞行检查以突击性、高效性的特点,查处了无数家不合规范的企业。那么多的企业被收回、撤销GSP证书,严重违规者甚至永远失去了经营资格,那么他们涉及到的问题主要有哪些呢?

小编对这些违规行为进行了汇总,发现主要问题可以分为以下这几大类:
1. 生产经营方面
企业生产、经营未获得许可证的医疗器械;购进验收记录内容不全,如无验收结论
2. 仓库存贮方面
企业擅自变更经营场所或库房地址、扩大经营规范或者擅自设立库房;医疗器械库未实行分区、分类管理
3. 文件、器械时效方面
企业经营、使用未依法注册、无合格证明文件以及过期、失效、淘汰的医疗器械……
以上这些问题也恰恰印证了各省市飞检中的重点所在。
早在2019年3月27日,国家药品监督管理局发布《国家药监局综合司关于进一步加强无菌和植入性医疗器械监督检查的通知》,决定从生产、流通和使用三个环节对无菌和植入性医疗器械开展监督检查。

此后,全国多省纷纷响应!
2019年上半年各省市就相继发布了《关于医疗器械监督检查的通知》,明确从生产环节、流通环节开展医疗器械大检查。并且从日常检查、抽查,到重点领域飞检全部实施。
不仅如此,检查范围不局限于无菌和植入性医疗器械,而是全医疗器械行业!
而在流通环节中检查区域的重中之重是医用耗材“两票制”执行情况以及医疗器械企业是否存在无证经营、经营未经注册(备案)医疗器械等违法行为。
为进一步完善医疗器械生产监管机制,创新监管手段,提升监管效能和水平,线下飞行检查活动已经不能满足国家药监局对医疗器械企业的监管需求,为此国家药监局开展了“医疗器械生产企业监管信息平台”建设,力求线上线下多方位对医疗器械企业进行监督管理。
该平台以整合医疗器械全生命周期、生产企业相关数据为基础,注重提升飞行、专项、有因等各类检查业务智能化,同时实现对检查人员全方位管理。
经过为期一年的建设,国家药监局在医疗器械监管业务领域首个智慧监管平台“医疗器械生产企业监管信息平台”于2019年5月5日投入试运行。
首批全国将有17个省试用该监管平台,下一步另外14个已有系统省份将开展数据对接试运行工作。
该系统经试运行修改完善后,计划于今年四季度在全国范围正式投入使用。
通过大数据对企业进行监管,信息会更加的精准,监管周期相较飞行检查变得更长,监管行为更加切实可行。
这也进一步说明国家药监局对于医疗器械生产经营企业的重视,全国各省会尽快落地实施,预测未来国家和地区会对医疗器械行业的生产经营规范要求更加严格具体。

由此可见,地区乃至全国对于飞行检查仍然非常重视,飞检力度不断加强,方式方法不断变化。相应地,企业在经营过程中更应重视《药品医疗器械飞行检查办法》,加大对自身的监管力度,仔细做好自查整改工作。只有合法合规经营,医疗器械企业才能在大浪淘沙的严苛环境中站稳脚跟。



















