面临不断变化的环境,越来越多的中国制药企业紧密关注全球监管政策和商业环境的变化。立足本土,开拓国际市场,通过制定清晰的国际化战略实现新的增长机会已经成为行业关注的热点话题之一。
CPhI China 2017召开之际,科睿唯安将推出国际化拓展方向系列文章、线上活动及CPhI现场报告,期待能为业内同仁带来思考和帮助!
全球仿制药、生物类似药和原料药生产商展望:趋势、机遇与挑战
原文作者:Mike Chace-Ortiz, CEng
全球制药市场持续变化,最主要的表现在于仿制药的市场份额和数量持续上升。当前,全球研发支出增长趋缓,监管日趋严格,使用者付费不断增加,产业整合再度升温,生产商应该如何应对这些问题?本文通过分析制药行业成功的增长模型及案例,探讨专业信息如何帮助企业快速而有效地向更高价值的产品和服务转化?以及正在经历变革的行业和企业,他们新的、不同以往的战略需要哪些信息来满足不断变化的需求?
目前,全球每年用于提供国民医疗保障的药费超过1万亿美元。预计到2018年,这笔花费将以平均每年5.5%速度递增,但是不同区域增速有明显不同。多数欧洲市场的增速小于2%,而很多亚洲、中东、拉美和非洲国家的增速将超过8%。
现在,全球仿制药市场规模约为4350亿美元,预计到2017年,市场份额将增长至36%。虽然仿制药已达到很高的市场渗透率,欧洲为50-60%,亚洲为45-50%,美国接近80%,但是预期仍有很大的增长空间。尽管如此,仿制药费用的增长预计将与全球医疗保障费用的增速保持一致,在北美、日本和欧洲成熟市场将呈个位数增长,在中国、巴西和印度等国家,增长率可达10-20%。
全球制药市场正在持续变化,其中最关键的一点就是,未来某个时间,仿制药行业将从这个变化中持续获益。2016年至2019年,将有超过1000亿美元的品牌药专利到期面临仿制药的竞争。
仿制药持续增长的原因是多方面的,既为生产企业创造了机会,也同时带来了风险。比如,政府、公共机构和私有医疗保险公司都将很大程度继续依赖仿制药以控制患者的医疗保险费用,这也为行业的长期发展创造了机会。但同时,这些机构最常做的是减少预算和资源,加上招标时采取的“价低者胜出”的做法给生产商带来很大压力,要求生产商不断降低价格的同时,还要保证质量、安全性、有效性或供应的可靠性;其最终的结果往往是产品供应和利润持续下滑。
与此同时,生产商还不得不与其他各种复杂的挑战做斗争。由于监管日趋严格,则提高了供应链追踪和溯源的要求,以及新的、不断增加的仿制药费用支付,这些都使各国市场为确保合规而增加成本。美国FDA仿制药审批过程中有4000多件ANDA积压,预计批准时间为40个月。预计至少在未来五年,全球领先的创新型公司研发费用将保持每年约750亿美元不变,这意味着未来8-10年内,将不会有大量新药获批上市,仿制药的机会将减少。另一方面,越来越多的CMC开发外包和或大或小的创新型公司原料药和制剂生产外包,也为定制合成与CRAMs(定制研发和生产服务)公司创造了新的机会。最后,在很多国家中,生物药占已上市药物超过40%,同时占临床开发阶段在研药物的37%。随着监管通路的日趋成熟以及各利益相关方对生物类似药的接受,不论生产商是否希望参与竞争,他们都必须对生物类似药有一个清晰的战略。
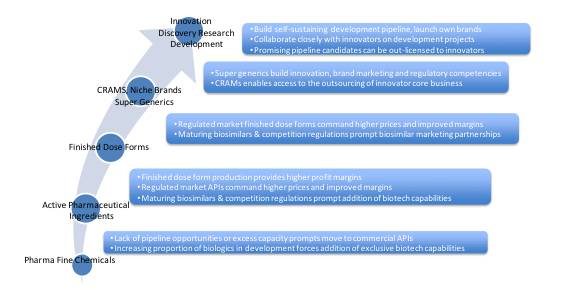
在解决以上问题和挑战之前,公司的商务战略团队围绕行业可行性模式的思考是有价值的。这些思考既可以作为评估一家公司当前定位和能力的衡量标准,也可以作为明确接下来去哪,需要哪些商业能力来达成预期并进行决策的工具,同时还需了解支持这些变化所需的信息。图1所示的行业增长模式可以用来帮助评估与决策。
印度Jubilant Life Sciences是一个很好的案例,展现了如何将自身有机增长与兼并购结合起来,从上世纪70年代的一家小型吡啶化工厂成长为现在年收入数十亿美元的全球化生命科学公司。这个转变需要将复杂的中间体和原料药,与专科药物和生物类似药整合在一起。在这个过程中,该公司花费了7.5亿美元用于在本国及欧洲、美国和加拿大开展收购交易。
让我们来看一下,为了加强地位或者进入任何其他领域以实现增长,CMO公司或者专业合成公司所需考虑的关键战略决策:





