作者 l 游方和尚
编辑
l Unica
看来被忽视的近期新闻之一……
2016年10月4日, 美通社, Viking Therapeutics, Inc. (维京制药, 纳斯达克股票代码:VKTX, 美国加利福尼亚州,圣地亚哥)是一家临床阶段的生物制药公司,专注于开发代谢和内分泌失调的新疗法,宣布该公司在临床II期研究中首次将VK2809用于原发性高胆固醇血症和非酒精性脂肪性肝病患者。VK2809是一种新型的,可口服的小分子甲状腺受体激动剂,具有对肝组织中高度表达的甲状腺激素受体β亚型 (THR-β) 的选择性。结果表明,VK2809在该患者群体中有相当的治疗潜力。该临床II期研究[NCT02927184, A Phase 2, Randomized, Double-Blind, Placebo-Controlled, Multicenter Study to Assess The Efficacy, Safety, and Tolerability of VK2809 Administered for 12 Weeks Followed by a 4-Week Off-Drug Phase in Patients With Primary Hypercholesterolemia and Non-Alcoholic Fatty Liver Disease]是一项随机,双盲,安慰剂对照的平行组研究,旨在约80例有升高的低密度脂蛋白胆固醇 (LDL-C) 和非酒精性脂肪肝的受试者中评估VK2809的安全性,疗效和耐受性。患者将随机接受每日一次口服VK2809,或安慰剂,治疗12周,之后有四周不使用药物的观察期。该研究的主要终点将评估VK2809治疗在12周后,与安慰剂相比,对LDL-C的影响。次要和探索性终点包括评估肝脏脂肪含量,甘油三酯和炎症标记物的变化。
在轻度高胆固醇血症患者的Ib期临床研究中,VK2809的治疗导致的低密度脂蛋白降低(安慰剂调整后),高剂量时降低程度超过40%。患者也得到了甘油三酯、致动脉粥样硬化蛋白脂蛋白a和载脂蛋白β的显着降低。与其肝脏和受体选择性的作用机制一致,VK2809也在肝脏脂肪变性的动物模型中显示出能够快速降低肝脏脂肪的效果。动物数据进一步显示,VK2809与他汀类药物组合具有降胆固醇的活性。因此,相对于高胆固醇血症和脂肪性肝病(如NASH) 患者现有可及的口服药方案,VK2809的这些特征提供了一个高度差异化的治疗方案。部分研究结果如下表1a和1b所示。
详见
http://www.vikingtherapeutics.com/pipeline/vk0214/
表
1a. VK2809
在动物模型中的疗效数据
(
部分
)
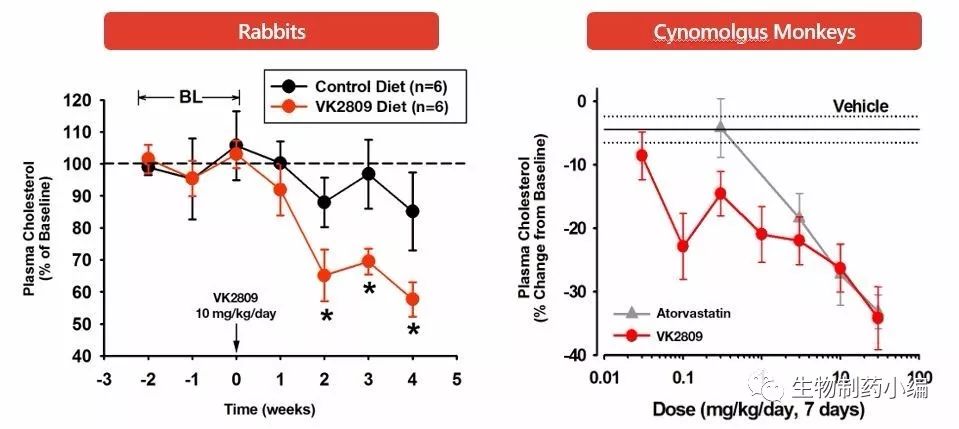
表1b. VK2809的临床一期研究数据(部分)
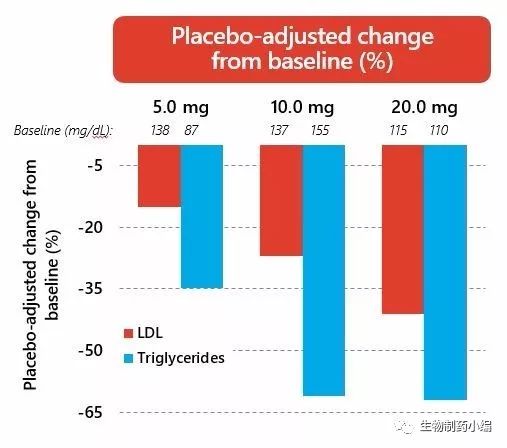
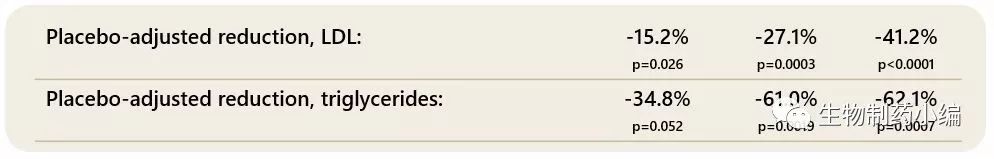
看来被忽视的近期新闻之二……
2016年10月20日,Madrigal Pharmaceuticals, Inc. (纳斯达克股票代码:MDGL, 美国宾夕法尼亚州,West Conshohocken) 宣布,在MGL-3196用于治疗非酒精性脂肪性肝炎(NASH)的临床二期研究[NCT02912260]中第一名受试者接受了治疗。
在2017年8月1日,Madrigal Pharmaceuticals公司宣布,在其评估MGL-3196治疗非酒精性脂肪性肝炎(NASH) 的临床二期概念验证的研究中,已完成了125名受试者的入组,超过其原定117名受试者的注册目标。
该公司称,MGL-3196是first-in-class的口服给药的小分子肝脏甲状腺激素受体β亚型 (THR-β) 的高选择性激动剂。临床前毒理学和临床I期数据表明,作为非酒精性脂肪性肝炎(NASH)和血脂异常的潜在治疗方法,MGL-3196具有非常吸引人的差异化的特征。通过激活其受体β亚型(THR-β),甲状腺激素在控制脂质代谢中起着核心作用,从血清胆固醇和甘油三酯水平到肝脏脂肪的病理积累影响了许多健康参数。上一代化合物的选择性缺乏限制了其临床应用,因此我们设计了本研究,以提供高度特异性THR-β激活在调节肝脏脂质代谢中治疗NASH病因的临床证明。它还将使我们能够通过成像确认评估肝脏脂肪早期减少的价值,以及其作为有意义和预测性治疗终点。
与非选择性激动剂相比,THR-
β
高选择性增强了MGL-3196的安全性。 MGL-3196对中枢甲状腺轴没有抑制作用;不像THR-
a
激动剂,MGL-3196对心率或骨骼也无影响;同时也没有观察到肝酶升高。这些安全性特征使MGL-3196成为该治疗领域最有发展希望的分子之一。
详见
http://www.madrigalpharma.com/wp-content/uploads/2017/06/Madrigal-Non-confidential-Presentation-June-2017.pdf
表2a. MGL-3196在动物模型中的疗效数据 (部分)
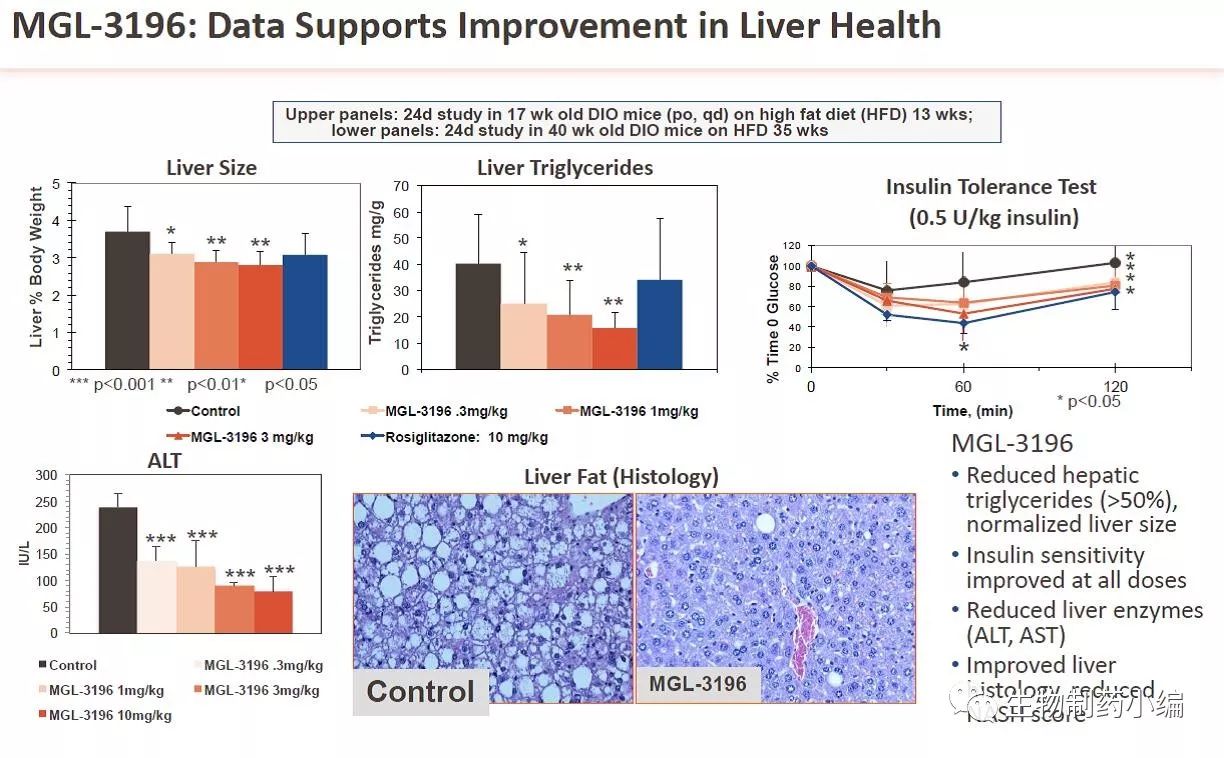
表2b. MGL-3109的临床一期研究数据 (部分)
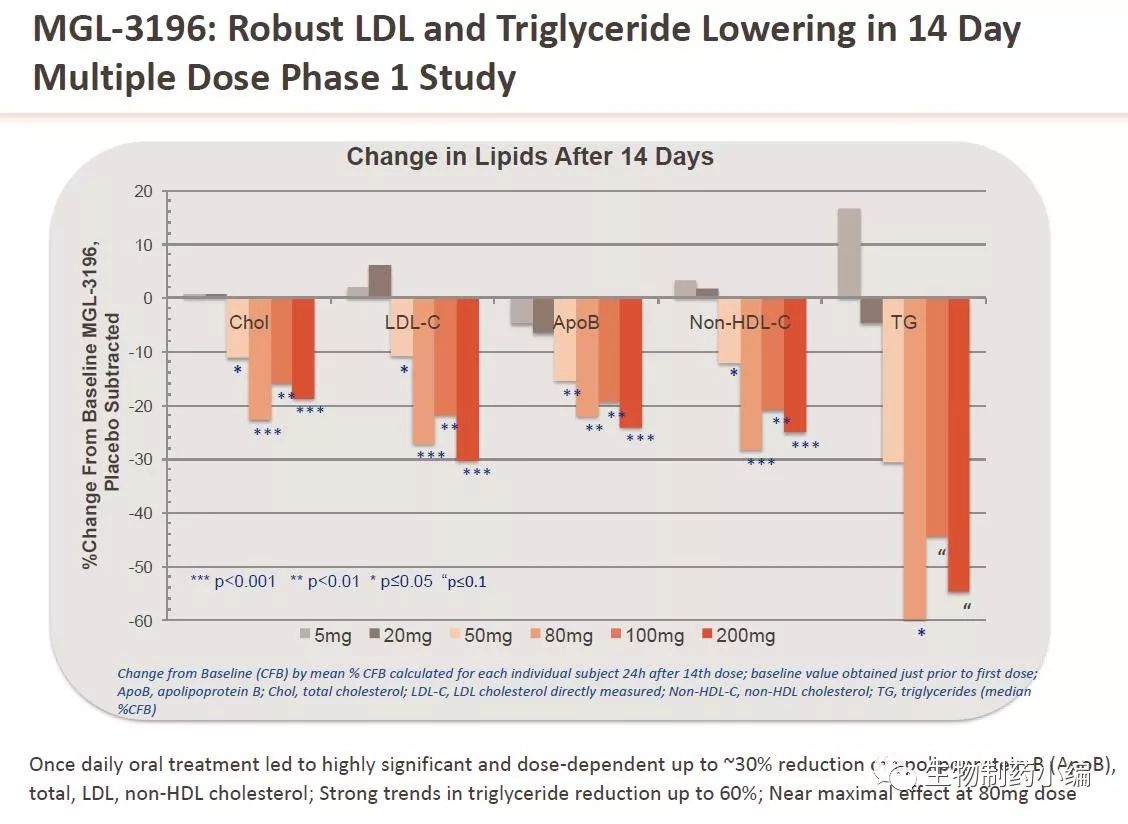
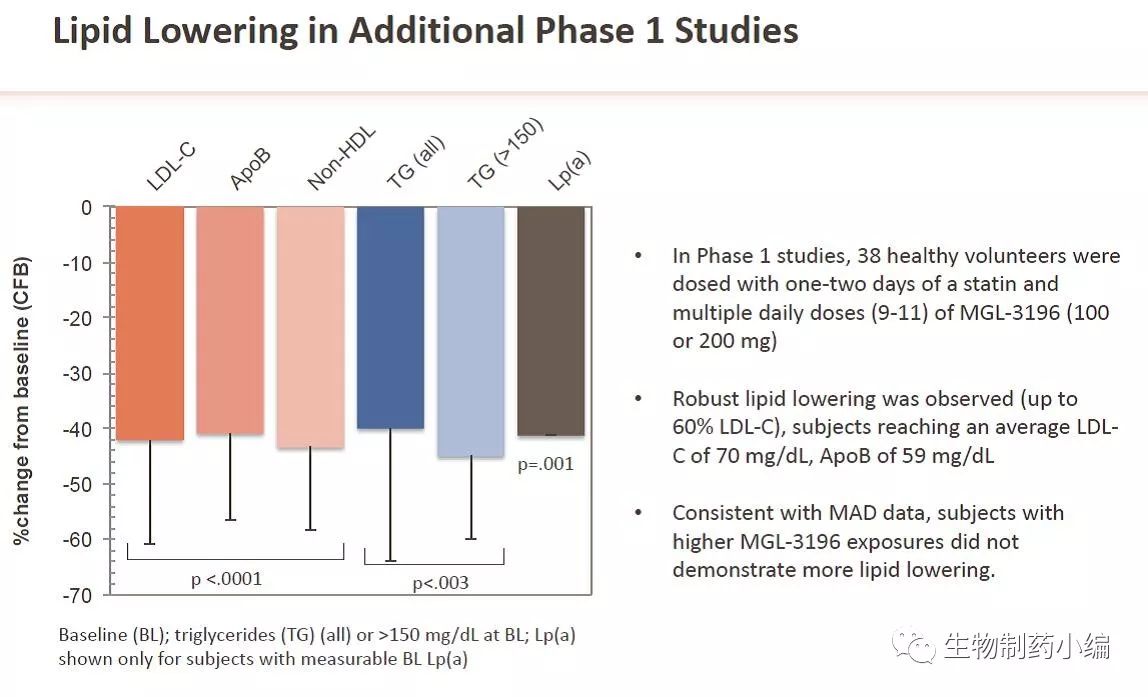
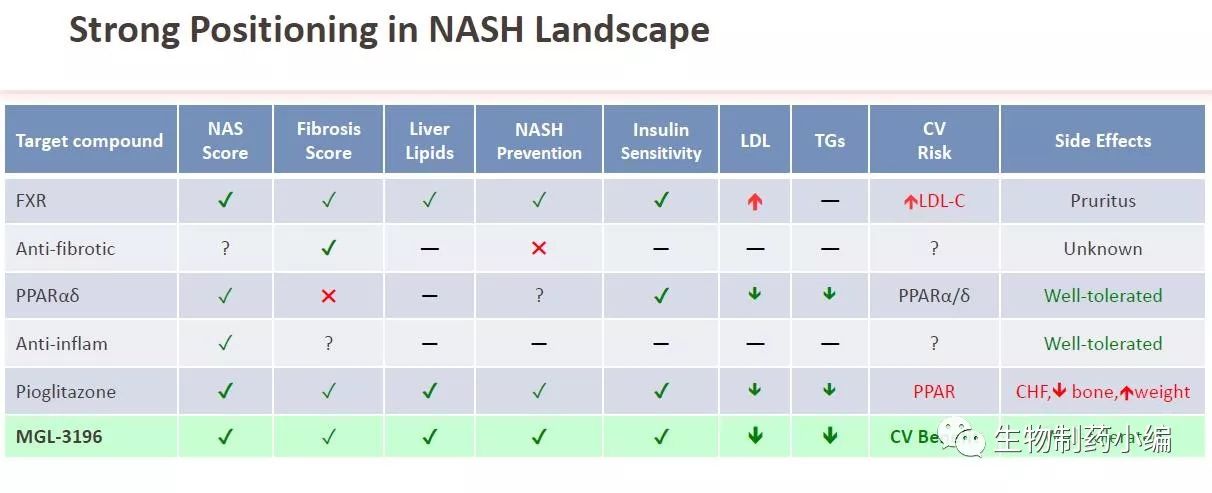
表2c. MGL-3196在治疗NASH上强有力的竞争地位
该公司最近发起了一项随机、双盲、安慰剂对照、多中心2期研究,将对117例18岁及以上患有活检证实的NASH的患者进行研究。研究的主要终点是在12周时减少肝脏脂肪,并用MRI-PDFF(磁共振成像 - 估计质子密度脂肪分数)进行评估,这是一种新型的基于非侵入性成像的生物标志物。这提供了有效性的早期指标,其结果将在试验结束时(36周)通过常规肝活检来确认,以获得NASH消失的组织学证据。最近公布的数据显示,通过MRI-PDFF测量的肝脏脂肪减少与肝活检的NASH评分具有很高的相关性。
甲状腺
甲状腺是位于颈部基部的蝴蝶状器官。它释放控制基础新陈代谢的激素, 即你的身体使用能量的方式。甲状腺激素调节重要的身体功能,包括:呼吸、心率、中枢和周围神经系统、体重、肌肉力量、月经周期、体温、胆固醇水平等等。
甲状腺长约2英寸,位于您的喉咙前方,甲状腺软骨有时称为亚当的苹果。甲状腺的两侧称为裂片,位于气管的两侧,通常通过被称为峡部的甲状腺组织连接。有些人没有峡部,而是有两个独立的甲状叶。
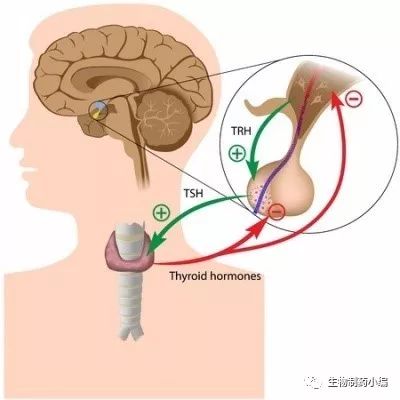
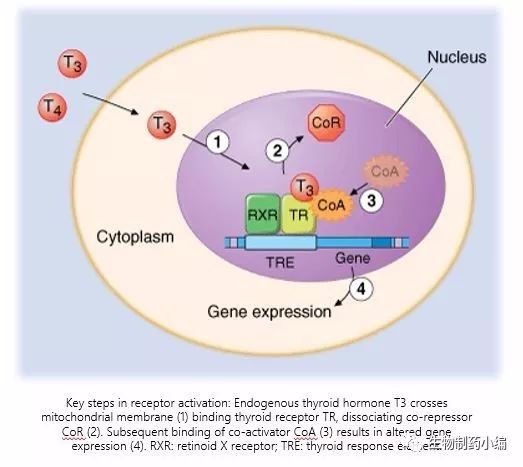
图1. 中枢甲状腺轴和甲状腺激素的作用机制
TRH
:促甲状腺激素释放激素;
TSH
:促甲状腺激素;
T3/T4:
甲状腺激素
甲状腺激素
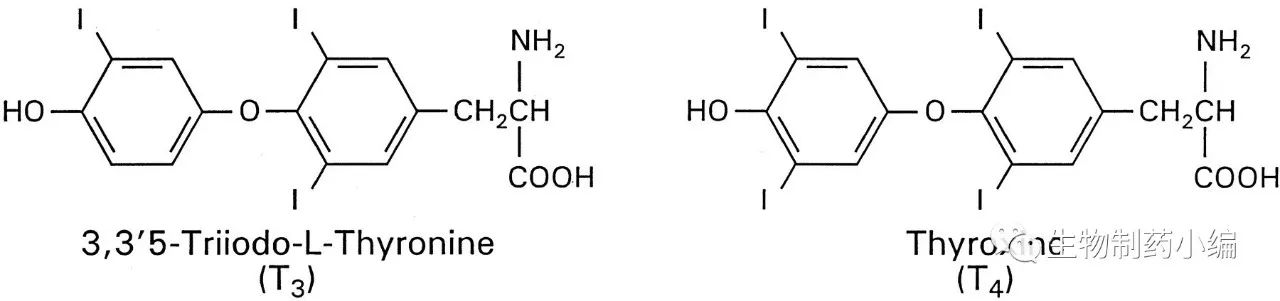
图
2.
甲状腺激素
T3
和
T4
的分子结构
甲状腺激素受体 (THR)简介
甲状腺激素受体包括雌激素受体,维生素D受体,过氧化物酶体增殖物激活受体 (PPARs),视黄酸受体 (RAR)和类视色素X受体 (RXR) ,是可以被T3诱导表达的核受体超级家族。
甲状腺激素受体由位于不同位点的两个基因THRA和THRB编码。位于染色体17上的THRA基因编码一个功能性T3结合TR
a
-1和两个显性阴性剪接变体TR
a
-2和TR
a
3。 TR
a
-1和TR
a
-2在脑中高度表达,而在肾脏、骨骼肌、肺、心脏和睾丸中的表达程度较低。THRB基因位于染色体3上,编码三个功能性与T3结合的TR-β同种型(β1,β2和β3)。TRβ-1在所有组织中广泛表达,但在脑、甲状腺、肝脏和肾脏中比较突出,而TRβ-2主要在脑下垂体前叶、脑下丘、视网膜,发育中的脑和内耳中以组织特异性方式表达。有趣的是,人类的TR
a
-1、TR
a
-2和TRβ-1在不同的组织中表达丰富,但在主要甲状腺激素靶器官肝脏中并没有特别高度的表达。
甲状腺激素信号转导途径
甲状腺激素信号转导途径如图3。甲状腺激素的生理作用几乎影响到每个器官系统。临床上,这些作用被观察为代谢率的变化,脂质代谢改变和心血管发育的特征效应。在生理条件下,T4是甲状腺分泌到血液中的主要激素。通过硒蛋白酶系统将T4转化为更活跃的形式,T3是在甲状腺之外的组织中进行和调节的。 I型和II型脱碘酶(D1和D2)的表达水平和活性在不同的组织中不同,导致可用于结合核受体的T3活性激素水平的组织特异性的差异。相反,III型脱碘酶(D3)将T4和T3分别转化为相对无活性的反向三碘甲状腺原氨酸(rT3)和3,3'-二碘甲状腺原氨酸(T2),导致激素活性的抑制。 T3和T4都通过甲状腺激素受体作用。然而,T4的甲状腺激素受体结合的亲和力明显低于T3。T3与位于启动子区甲状腺激素反应元件(TREs)上的甲状腺激素受体的结合在转录水平上诱导靶基因表达。
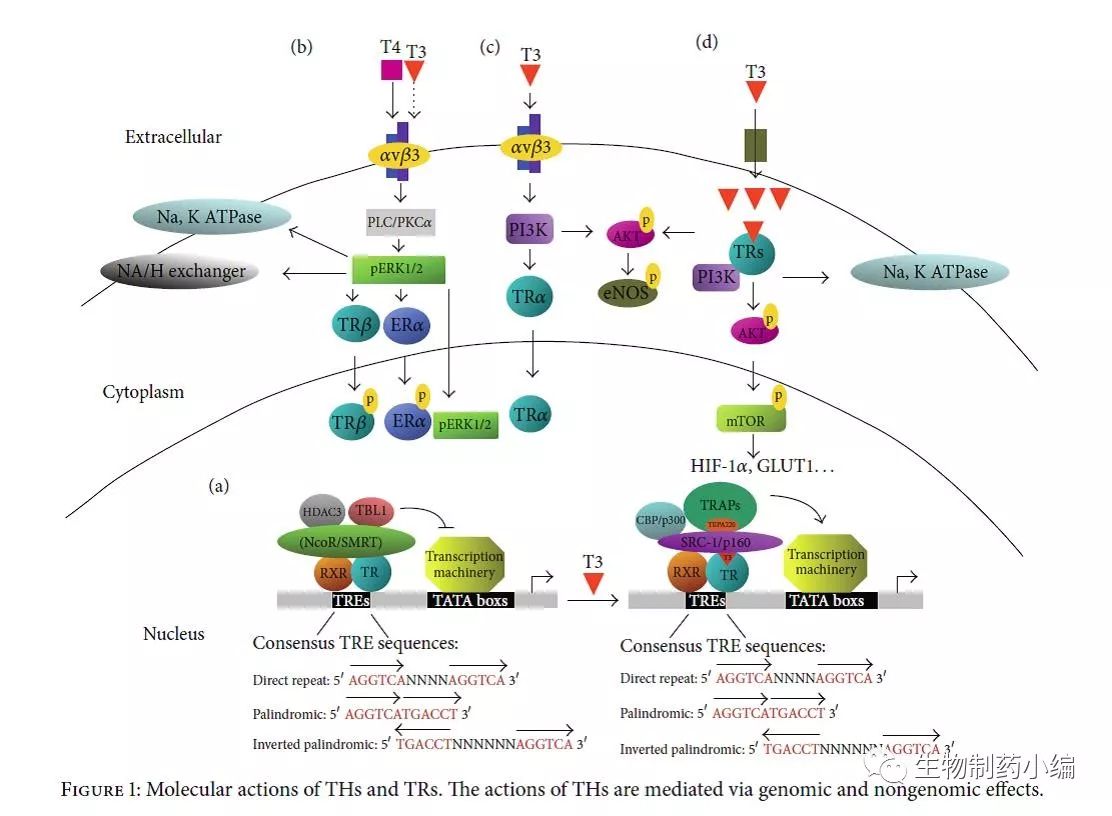
图3. 甲状腺激素和其受体的作用机制。甲状腺激素的作用是通过基因组和非基因组的作用来介导的。
甲状腺激素调节肝脏脂质和葡萄糖代谢
甲状腺激素具有降低胆固醇,改善血脂特征和治疗肥胖等有益作用。在最近一项基于人群的甲状腺功能受试者研究中,游离T4的水平与甘油三酯和胆固醇、血压、腹部肥胖和胰岛素抵抗的血液水平表显出负相关性。
甲状腺激素类似物能够通过降低低密度脂蛋白(LDL)-胆固醇,增加高密度脂蛋白(HDL)-胆固醇再摄取,刺激反向胆固醇转运和降低血浆甘油三酯等,改善脂质谱。
由于TRβ-1是肝脏中主要的甲状腺激素受体的同工型,如果TRβ-1的正常活性被其突变体抑制,可以推测其导致代谢异常。与野生型小鼠相比,TR-β(PV/ PV)小鼠肝脏重量显着增加(TR-βP(V/ PV):PV突变导致T3完全丧失与受体结合的活性和转录能力)。事实上,在TR-β(PV/ PV)小鼠的肝脏中发现异常脂质积聚和脂肪形成脂肪变性。有趣的是,在TR-β(PV/ PV)小鼠的脂肪肝中脂质生成酶和PPAR-γ的表达以及脂肪细胞特异性的下游PPARγ靶基因的表达也增加了(homeostasis)。另一方面,在TR-βPV/ PV小鼠的脂肪肝中肉碱棕榈酰转移酶1A (CPT1-a) 的表达以及β-氧化活性降低。增加的脂肪生成,脂肪形成和减少的β -氧化都有助于TR-β(PV/ PV)小鼠的肝脂肪变性。使用甲状腺功能低下的小鼠和甲状腺激素治疗,发现PPAR-γ的表达在肝脏中被甲状腺激素负调节。因为TRβ-1是肝脏中主要的TR同工型,当TRβPV在肝脏中起主要作用时,PPARγ表达不再被甲状腺激素升高抑制,从而导致肝脂肪变性。相比之下,TR-
a
1(PV/N) 小鼠在肝脏中具有非常不同的表型。与野生型小鼠相比,TR-
a
1(PV/ N)小鼠肝脏重量和肝脏脂质均明显降低。与此相一致,在TR-
a
1(PV/ N)小鼠的肝脏中发现脂肪生成酶和PPAR-g的表达降低。这些观察结果表明肝脏中脂质代谢的调节是依赖于甲状腺激素受体异构体的,但其机制尚不明确。
甲状腺激素显示调节过氧化物酶体增殖物激活受体PPAR-
a
,PPAR-
γ
和PPAR-
δ
,而PPAR靶向调节涉及脂质代谢和脂质液滴转换中重要的酶 (酰基辅酶A氧化酶,硬脂酰辅酶A和脂肪甘油三酯脂肪酶) 的基因。此外,甲状腺激素也调节载脂蛋白B。载脂蛋白B是非常低密度脂蛋白(VLDL) 的主要蛋白质成分。这些研究结果表明,除了刺激脂质氧化途径外,甲状腺激素抑制脂质液滴作为脂质储存的途径,并促进脂质液滴作为VLDL的脂质体的部分分泌。
在棕色脂肪组织中,活化甲状腺激素的II型脱碘酶对于适应性发热是必需的。然而,II型脱碘酶敲除的小鼠(D2KO)表现出对寒冷引起的生热反应的受损和肝脂肪变性。D2KO小鼠的肝脂肪变性是通过增加不饱和脂肪酸的摄取,受损的β-脂肪酸氧化和降低的VLDL分泌被诱导而成的。
成纤维细胞生长因子21 (FGF21) 是内分泌成纤维细胞生长因子(FGF) 亚家族的成员,具有改善胰岛素敏感性和葡萄糖清除率,降低血浆脂肪甘油三酯浓度,并抵抗喂养高脂肪的小鼠体重的增加。动物体外和体内实验都证实,T3和TR
β
-特异性激动剂的作用至少部分归因于肝脏FGF21的诱导和白脂肪组织中FGF21的可能抑制,这为甲状腺激素治疗NAFLD的功效提供了一个作用机制的基础。
临床的横断面研究表明:即使在接近高位但正常的促甲状腺激素水平范围内,亚临床甲状腺功能减退与NAFLD呈剂量依赖关系。此外,甲状腺功能减退与NAFLD之相关与其它已知的代谢危险因素无关,即甲状腺功能减退是导致NAFLD的一个独立的危险因素。血清T3水平似乎与肝硬化和慢性肝炎患者的血清胆红素,白蛋白和凝血酶原时间显著相关,而血清游离T4浓度与肝脂肪变性呈负相关。非酒精性脂肪肝患者的血清促甲状腺激素水平明显高于正常组。另外,甲状腺功能检查证实慢性肝病患者存在几种甲状腺功能异常。然而,在甲状腺功能正常者中,促甲状腺激素水平不是独立危险因素,促甲状腺激素水平的变化不影响NAFLD的发病率。
总结与前瞻
甲状腺激素信号传导是人体调节代谢平衡的最重要的机制之一,我们可从自然存在的甲状腺过多或缺乏的病患情况可以清楚地认识到这一点。甲状腺功能减退的症状包括体重增加,升高的胆固醇和血清脂质,体温过低和抑郁,如果发生在怀孕期间,可能包括认知缺陷。甲状腺功能亢进症状包括降低胆固醇,心动过速,心律失常,高热,体重减轻,肌肉分解代谢,骨矿化减少,中枢神经系统发育和情绪障碍的破坏。将甲状腺激素过量的有害影响与对降低胆固醇和血脂的潜在有益作用分开的方法可能会获得强大而有用的新型药物。
小编在本文中就肝脏甲状腺激素受体
β
亚型(THR-
β
) 激动剂在治疗NASH上的潜力做了一个初步介绍,希望所表达的想法和判断能起到抛砖引玉的作用。小编预测甲状腺激素受体
β
亚型 (THR-
β
) 激动剂在治疗NASH及代谢综合症上极具潜力,其疗效有可能超过已在临床II/ III 期的以调节脂肪和糖代谢为主要作用模式的在研新药(见本NASH系列的第一篇评论)。这类新药值得国内的新药研发公司紧紧跟踪,以赶超该领域的世界先进水平。
本文如有疏漏和误读现有数据的地方,请读者评论和指正。当然,目前的想法和判断也会随着新的数据和知识出现而被修正和不断完善。小编将在本系列未来的文章中进一步解读这类在研药物在NASH适应症方面的作用机制与临床进展以及其相对于其它NASH在研药物及其组合的比较优势。
特别声明
本文所有引用的原始信息和资料均来自已经发表学术期刊, 官方网络报道, 等公开渠道, 不涉及任何保密信息。参考文献的选择考虑到多样化但也不可能完备。欢迎读者提供有价值的文献及其评估。
扩展阅读
1.
Pamrevlumab
在特发性肺纤维化的临床
2
期研究中的积极结果及对治疗肝脏纤维化的意义
2017-09-06
游方和尚
生物制药小编
2.
Simtuzumab(GS-6624)
治疗
NASH
纤维化临床研究的失败及其可能原因初探
2017-08-17
游方和尚
生物制药小编
3.
非酒精性脂肪性肝病
/
肝炎
(NAFLD/NASH)
和在研新药简介
2017-08-02
游方和尚
生物制药小编
参考文献
1. Kelly MJ et al., “Discovery of 2-[3,5-dichloro-4-(5-isopropyl-6-oxo-1,6-dihydropyridazin-3-yloxy)phenyl]-3,5-dioxo-2,3,4,5-tetrahydro[1,2,4]triazine-6-carbonitrile (MGL-3196), a highly selective thyroidhormone receptorbeta agonist in clinical trials for the treatment of dyslipidemia”, J Med Chem.57(10):3912–23. 2014
2. Taub R et al., “Lipid loweringin healthy volunteers treated with multiple doses of MGL-3196, a liver-targeted thyroid hormone receptor-beta agonist”, Atherosclerosis.230 (2):373–80, 2013
3. Song Y et al, “Thyroidhormoneaction in metabolic regulation”, Protein Cell, 2(5): 358–368, 2011
4. Araki, O et al., “Distinct dysregulation of lipid metabolism by unliganded thyroid hormone receptorisoforms”, Mol Endocrinol 23, 308–315, 2009
5. Flamant F et al., “Thyroid hormone receptors: lessons from knockout and knock-in mutant mice”, TRENDS inEndocrinology and Metabolism Vol.14 (2):85-90, 2003
6. Mullur R et al., “THYROIDHORMONE REGULATION OF METABOLISM”, Physiol Rev 94: 355–382, 2014
7. Marino L et al., “Endocrine causes of nonalcoholic fatty liver disease”, World J Gastroenterol 21(39):11053-11076, 2015
8. Adams AC et al., “Thyroidhormone regulates hepatic expression of fibroblast growth factor 21 in a PPAR𝛼-dependent manner,” Journal of Biological Chemistry, 285 (19),14078–14082, 2010.
9. Ayers S et al., “Thyroidhormone analogues: their role in treatment of hyperlipidemia”, J EndocrinolDiabetes Obes 2(3): 1042-1053, 2014
10. Roos, A et al., “Thyroid function is associated with components of the metabolic syndrome in euthyroidsubjects”, J Clin Endocrinol Metab 92, 491–496, 2007
11. Elbers LPB et al., “Thyroid Hormone Mimetics: the Past, Current Status and Future Challenges”, CurrAtheroscler Rep 18: 14-20, 2016
12. Chung GE et al., “Non-alcoholicfatty liver disease across the spectrum of hypothyroidism,” Journal of Hepatology,vol. 57(1), 150–156, 2012.
欢迎加入小编团队成为小编一员
请加 小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]

















