今天小编给大家带来的是今年4月发表在nature communications 上的一篇文章,其题目为
Exosome-delivered EGFR regulates liver microenvironmentto promote gastric cancer liver metastasis
。
自从肿瘤
“种子与土壤”学说
提出以来,其转移亲器官性就成为了肿瘤的未解之谜。尽管EGFR在肿瘤的研究较多,但是我们还并不知道外泌体运输的EGFR能发挥怎样的功能,这正是作者研究的兴趣所在,作者通过实验研究得出了以下结论:胃癌细胞分泌的外泌体可以将EGFR运输到肝脏,使EGFR聚集在肝基质细胞的细胞膜上,然后EGFR通过抑制miR-26a,b的表达而去激活肝细胞生长因子(HGF)。而且,迁移肿瘤细胞上的c-MET受体可以结合旁分泌上调的HGF,为“种子”提供适宜的“土壤”,帮助转移肿瘤细胞的着路和增殖。因此,作者提出来自肝细胞且包含EGFR的外泌体可以为肝转移提供一个适宜的微环境帮助转移的形成。
图1:在胃癌(GC)病人中分析血浆外泌体EGFR和HGF-Cmet
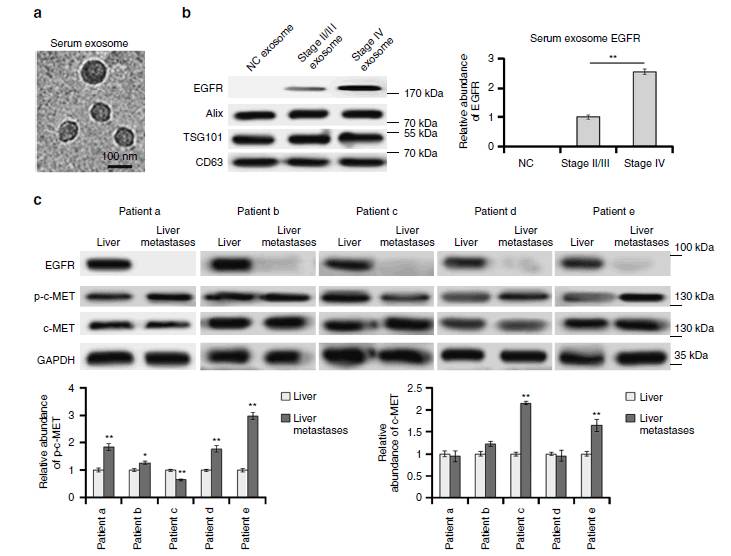
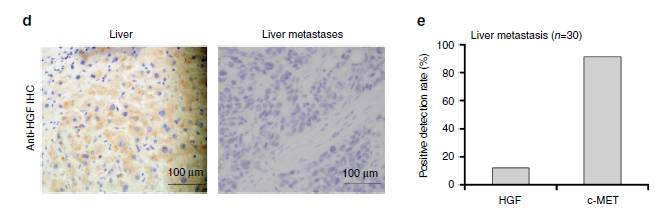
尽管已知EGFR在肿瘤组织中是上调的,但几乎无人研究外泌体来源的EGFR。作者首先通过高速离心法分离血浆中的外泌体来研究EGFR的含量,1a是在电镜下观察外泌体,其大小在100nm左右,1b示GC病人血浆中富含EGFR,正常人血浆中几乎无EGFR,而且GC临床四期病人血浆中EGFR明显高于二,三期水平。这两图说明EGFR也许对GC的发展很重要。 1c,d,e示HGF在肝及癌旁组织中高表达,而不是GC转移灶,而HGF受体,c-MET/磷酸化的c-MET在胃癌肝转移灶中高表达,对30个GC病人检测HGF和c-MET, c-MET的阳性率高达90%,这些数据说明转移的癌细胞主要与HGF结合,而HGF是通过旁分泌形式释放到肝微环境中的。
图2:SGC外泌体转运EGFR到肝脏
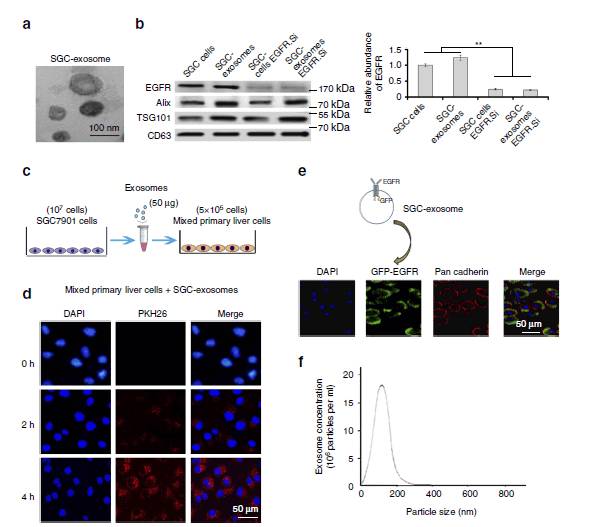
2a:
从SGC7901细胞中分离的外泌体使之与小鼠肝细胞共培养。
2b:
检测细胞中的EGFR水平,可在SGC细胞和SGC细胞外泌体中检测到EGFFR.
2c/d:
原始肝细胞与来自SGC细胞的50ug外泌体共培养,可看到外泌体迅速进入到细胞中。
2e:
从SGC中分离出带有GFP EGFR的外泌体,使其与原始肝细胞共培养,可以看到EGFR在肝细胞外膜表达而且与E-cadherin有共定位。
2f:
检测分离出的外泌体大小,为100nm左右。
这些结果表明SGC的外泌体可以运输膜蛋白EGFR到肝脏。
图3:描述原发性肝细胞的细胞类型特点
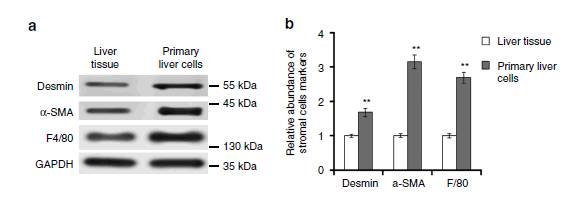
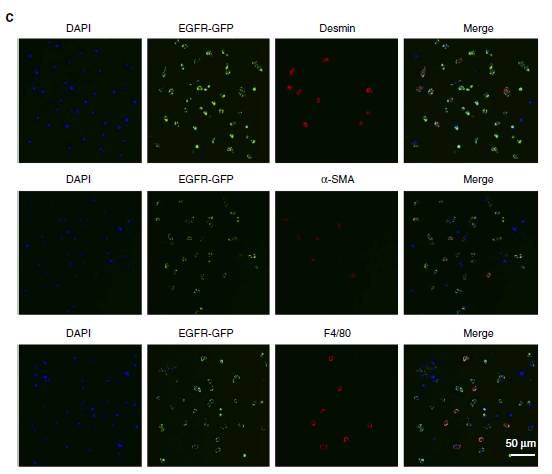
图3主要是运用带有marker的基质细胞及肝细胞描述原始肝细胞的特点,F4/8是
Kupper
的marker,α-SMA是
α-
平滑肌肌动蛋白的marker,desmin是肝星状细胞的marker。
图3说明SGC外泌体包含的EGFR可以被肝
Kupper
细胞和肝星状细胞摄取。
图4:SGC外泌体转运的EGFR通过抑制miR-26a/b表达来激活肝HGF
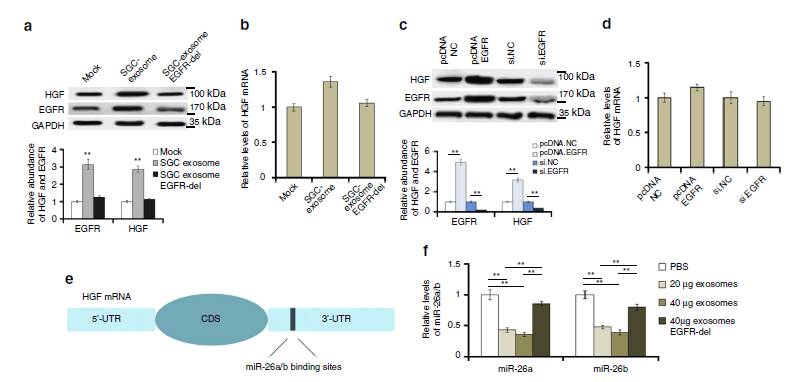
4a
;10
6
个
原发性肝细胞与40ug 来自
SGC的外泌体
共培养,发现SGC的外泌体能显著提高细胞HGF和EGFR的表达。
4c
:EGFR过表达能提高肝HGF含量
4b
;SGC过表达或者EGFR过表达并不能显著提高HGF mRNA水平。
所以可得出结论;外泌体EGFR通过抑制下游miRNA来激活HGF。
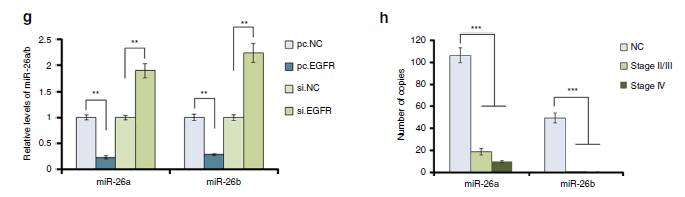
4e/h:
生物信息学方法预测了与HGF相关的miRNA中,发现
miR-26a/b
在GC中下调。
4f/g:
SGC
的外泌体和EGFR过表达在肝细胞中强烈抑制了
miR-26a/b
。
图5:
miR-26a/b
的直接靶点:HGF
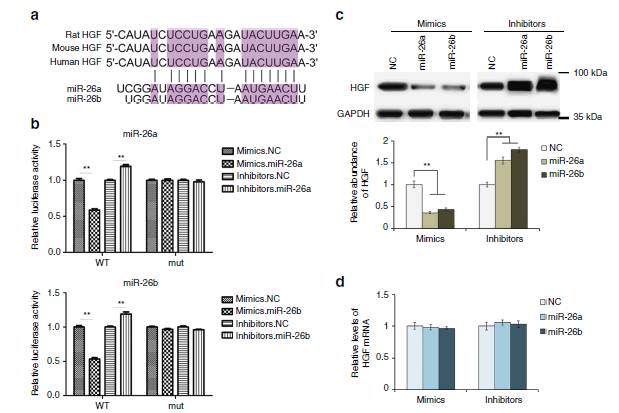
5a:
miR-26a/b
的绑定位点。
5b:
过表达miR-26a/b可降低HGF表达,抑制miR-26a/b可增强HGF表达。
5c:western blotting
分析证明了5b的结论。
5d: miR-26a/b
过表达或抑制不影响HGF mRNA 水平,因为miRNAs在转录后抑制基因表达的功能被树熟知。
图5说明miR-26a/b在原发性肝细胞中直接靶向HGF mRNA 的3‘UTR来调节HGF表达。
图6:旁分泌上调的HGF能促进SGC7901细胞的增殖和迁移。
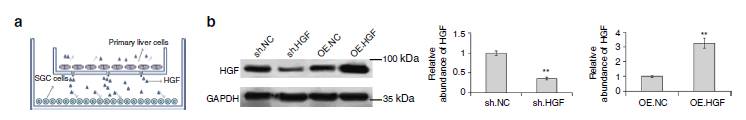
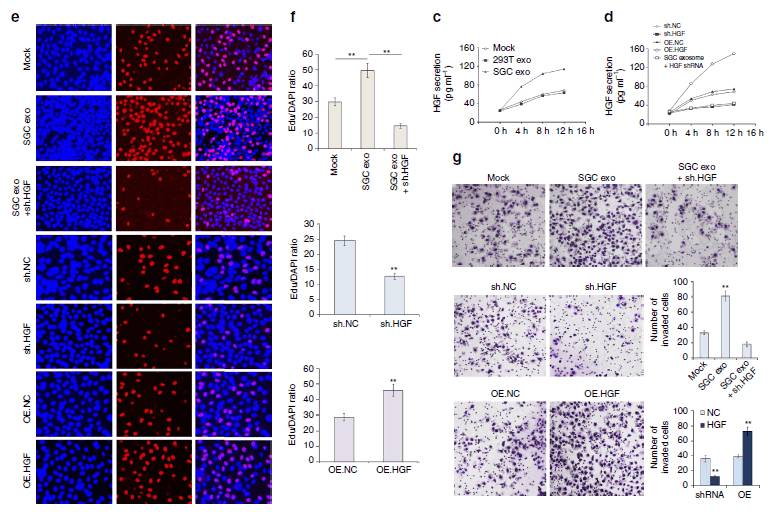
过表达或则
knock down
的方式在细胞中证明HGF可以促进胃癌细胞的增殖和迁移。
图7:体内实验证明
外泌体EGFR通过抑制
miR-26a/b
来激活肝HGF.
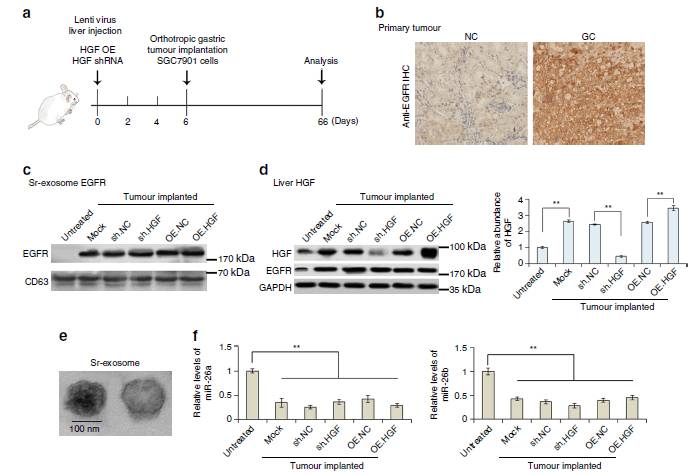
建立小鼠模型,小鼠的肝脏先经过过表达HGF过表达或者
knock down HGF
处理后再植入GC细胞,第66天处死小鼠。7a为实验设计,7b为NC和GC组的EGFR免疫组化,7c/e示EGFR在肿瘤植入小鼠sr-外泌体中高表达,7d示HGF高表达,7f示抑制
miR-26a/b
后外泌体EGFR表达升高。
这些数据通过肿瘤移植模型进一步证明了
外泌体EGFR通过抑制
miR-26a/b
来激活肝HGF。
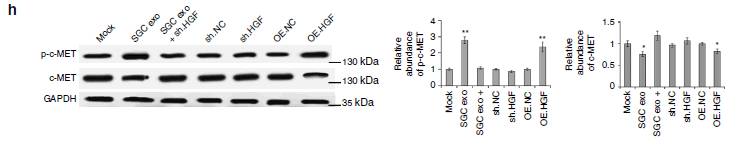
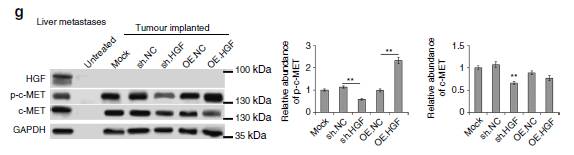
图8:上调的HGF在亲肝脏转移中的作用。
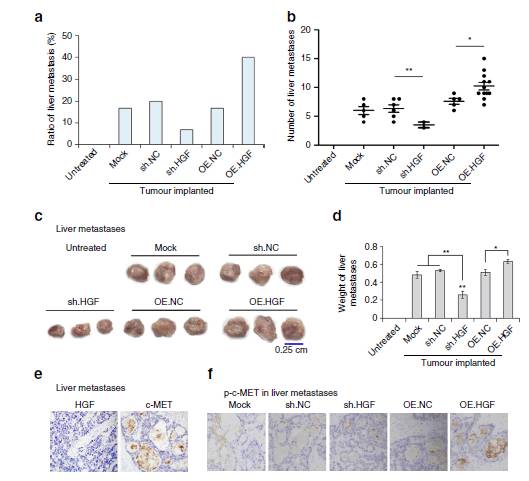
8a/b:HGF
促进胃癌肝转移,抑制HGF可抑制肝转移。
8c/d:
肝脏中的高表达HGF可以促进肝转移灶生长,增加转移灶的大小和重量。
8e/h:
在GC肝转移组织及癌旁组织中检测HGF和c-MET表达,发现HGF在肝组织中高表达而非转移组织。
8f/g:
肝组织高表达HGF促进了c-MET的激活。
所以,在小鼠模型中肝HGF与肝转移密切相关。
总之,这篇文章证明了肿瘤来源的外泌体通过重塑肝微环境在介导肝特异性转移中发挥了重要作用,作者的研究支持了
“
种子与土壤”学说,对肝亲器官转移机制添上了新色色彩。