
问题:
怎样才能让我的工作学习更有效率呢??
答案:
只需要点击图片上边蓝字
一药一世界
即可!
本指南是一个草案,对有意去FDA申请此类ANDA的有一定的指导作用。
背景
处方阿片类药物产品是现代疼痛管理的一个重要组成部分。然而,这些产品的滥用和误用产生了日益严重的公共卫生问题。开发防止滥用性阿片类药物制剂是迈向创造更安全阿片类镇痛药目标的一个潜在重要步骤。FDA将这些产品的开发视作一项高度优先的公共卫生问题。
2015年4月1日,FDA 在《联邦记事》中通知了“防止滥用的阿片类药物的评估及标签”的最终指南的发布。在该指南中,“防止滥用”被定义为可以有意义地阻止滥用,即使未能完全避免滥用的特性。术语“滥用”被定义为蓄意的、非治疗用途地使用(即使只有一次)药品或物质以达到精神或生理上的效应。
滥用不同于误用,误用指的是有意使用药品用于治疗用途,但使用方式不正确,明确排除了滥用的定义。由于阿片类药物最终必须由患者使用,因此总是存在滥用的可能性。
很重要的一点是,为确保需要使用安全有效的止痛药的患者可以在广泛途径获得这类药物,市场上可提供在标签中写明防止滥用的参比原研药的仿制药。但是,另外也很重要的一点是,该类仿制药的可获得性并未加重与处方阿片类药物滥用相关的公众健康问题。
如果原研药的标签中写明了防止滥用,防止滥用的措施低于原研药的仿制药的上市可能会导致阿片类药物滥用者优先寻求和滥用该类更易滥用的仿制药。
阿片类药物的防止滥用的措施的评估及标签指南中描述了 7 类防止滥用的措施
物理/化学屏障,传递系统,新分子实体(NME)和前体药物,联用药物,和新颖技术。本指南的重点是开发和评估防止固体口服阿片类药物仿制药(其配方结合使用物理或化学屏障、激动剂/拮抗剂、厌恶剂、或联合使用两种或更多种这些措施)滥用的一般原则,并不提供关于结合了其它技术(即传递系统、NME/前体药物、或新颖方法)的阿片类药物仿制药的检测建议,但FDA 可能会在以后的产品特定指南中提供检测建议。另外,FDA将继续评估科学状态,并且,随着新颖技术的开发,将通过在适当的情况下发布其它指南来解决这些问题。
固体口服阿片类药物仿制药的防止滥用的措施
为了寻求FDA 批准 ANDA,FDA 必须在其它方面确认该仿制药与原研药具有相同的活性成分、剂型、给药途径、规格,以及在有限的例外情况下,标签为原研药,与其原研药是生物等效的,药物的生产、加工和包装所使用的方法、或是所使用的设备和控制足以确保和保持仿制药的性状、规格、质量和纯度,并且其非活性成分和组分在按处方使用、建议或推荐的条件下是安全的。
达到以下标准的生物等效药物是“治疗上等效的”,并且可以相互替代:(1)被批准为是安全有效的;(2)药物相同,指的是(a)含有活性成分含量相同,并且给药途径和剂型相同;(b)规格、质量、纯度和性状达到法规要求或其它适用标准;(3)有充分的标签;(4)其生产符合当前版本的良好生产规范。
如果原研药的标签描述了预期可以防止误用或滥用的特性,潜在的ANDA 申请者应该在体外研究中(在某些情况下,在相关的药代动力学或其它研究中)进行对比评估,以证明在所有可能的滥用途径下,该仿制药防止滥用的措施并不低于原研药。这将确保在所有可能的滥用途径下该仿制药防止滥用的措施并不低于原研药,并且使从滥用转变为其它可能更危险的途径的风险降到最低。
FDA意图在评估固体口服阿片类药物仿制药的防止滥用的措施时考虑综合证据。
在潜在ANDA 申请者开发固体口服阿片类药物仿制药时,应审查原研药的标签,尤其是在“9.2 滥用”中的“药物滥用和依赖性”小节中列出的信息,以确定
FDA是否已批准描述该药品的防止滥用的措施的标签,包括与原研药申请者曾执行的体外、药代动力学或临床滥用可能性研究相关的任何信息。除了原研药标签之外,潜在申请者还应考虑关于原研药的防止滥用的公开文献,以及潜在申请者为评估原研药的理化特性以告知所提议的仿制药的适当检测而执行的任何检测的结果。关于与评估原研药的防止滥用相关的问题,潜在申请者可以通过向仿制药办公室提交受控的函件来寻求意见。
评估固体口服阿片类药物仿制药的防止滥用的措施的一般原则
在本指南中,提议的固体口服阿片类药物仿制药被称为“T 产品”,相应的原研药称为“R产品”。如果 R 产品的标签没有描述任何防止滥用的特性,则本指南中的检测建议不适用。只要 R产品的标签中描述中防止滥用的特性,应根据以下一般原则,进行T产品与R产品之间的防止滥用的措施的对比评估:
——基于层次的检验方法。
FDA 建议潜在 ANDA申请者遵循基于层次的方法,它可以有效地对比 T 产品及其 R 产品,并限制评估T 产品的防止滥用的措施所需的检验数量。这一基于层次的方法便于进行分层检验,在体外研究中可以从对产品的简单、缓和操作(层1)上升到更具破坏性的机械、化学操作,直至R 产品的防止滥用的措施被破坏或受损,或显示 T 产品的防止滥用的措施不低于R 产品。
——评估防止滥用的措施。
T 产品的防止滥用的措施评估应基于其相对于 R 产品的性能。提议的仿制药的配方设计无需与 R 产品相同。为了充分地对比 R 产品与 T 产品,潜在ANDA 申请者应采用在本指南描述的基于层次的方法,鉴定 R 产品在所有滥用途径方面的防止滥用的措施。如果潜在申请者发现 R 产品在某个滥用途径方面没有任何防止滥用的措施,应总结所进行的研究和结果以支持申请者的评估,即原研药在该滥用途径方面缺乏防止滥用的措施,并阐明为何无需在该途径的体外研究或其它研究中对比检测T 产品。对 T 产品的防止滥用的措施评估应基于潜在申请者对 R 产品的防止滥用的措施、可能的滥用途径、以及对通过这些途径滥用的评估有意义的特定措施的最大理解。例如,与通过注射实现滥用相关的防止滥用的措施是可以从产品配方中提取并在附录2 中说明的条件下从注射器中排出阿片类物质的百分比。
——控制措施的使用。
阿片类药物的操作是多个因素在起作用,这些因素包括但不限于篡改技术、时间、以及可用的篡改资源。目前已被批准的药物的防止滥用的特性并不是绝对的,可能最终被破坏或受损。因此,很重要的一点是鉴定适当的差异化研究条件来对比R 产品和 T 产品。关于某些对比研究(如可提取性研究),鉴定这些差异化研究条件需要增加对照产品(在本指南中称为 C产品)并将其与 R 产品进行对比,以鉴定 R 产品的防止滥用的措施。潜在ANDA 申请者应为其提议的T 产品选择适当的C 产品。该 C产品应该与阿片类药物 R 产品的活性药物成分(API)相同,但无防止滥用的措施。
——差异化研究条件的鉴定。
差异化研究条件的参数应处于本指南中不同滥用途径(附录 2-5)的范围。为了确定防止 T 产品通过注射途径(举例)实现的滥用,潜在ANDA 申请者应首先鉴定从R 产品中提取出阿片类物质的百分比在统计学上低于从 C 产品中提取出阿片类物质的百分比的体外差异化研究条件,即在什么条件下 R产品在统计学上优于 C 产品。然后,潜在申请者应对比在相同的差异化研究条件下,从 T 产品中和从 R 产品中提取出阿片类物质的百分比。
——R 产品与 T 产品的对比。
一旦确定了体外差异化研究条件,潜在 ANDA
申请者应该为章节 VIII 中建议的及附录 2-5 中显示的每种滥用途径进行推荐的统计学对比。
在本章节中列出的一般原则适用于本指南范围内的所有固体口服阿片类药物仿制药。如果有其它原则可能适用于用于防止滥用的产品特异性技术,FDA将继续考虑是否为体外检测、药代动力学或其它研究提供更详细、更具产品特异性的建议。
滥用的途径
固体口服阿片类止痛剂可以按完整剂型吞服,或在咀嚼、切割、压碎、磨碎、磨粉、或从完整剂型或机械操作后的形式中提取阿片类物质后服用。此外,阿片类产品可以以注射、压碎后鼻吸入或压碎后抽吸的方式使用。
FDA 认为,评估固体口服阿片类药物的防止滥用的措施时应考虑所有可能的滥用途径,建议如下:
注射(肠胃外途径)-
评估完整剂型和机械操作后的产品的可提取性和可注射剂性,如附录 2 所述。
吞服(口服途径)-
评估完整剂型和机械或化学操作后的产品的可提取性、溶出度以及产品吸收的速度和程度(如果适用),如附录 3 所述。
鼻吸入(经鼻途径)-
评估机械操作后经鼻吸入的产品的利用度和可能性,如附录4 所述。
抽吸(吸入途径)-
评估完整剂型以及机构或化学操作后的产品升华的能力,如附录5 所述。
体外对比研究
如章节IV 中所讨论的,FDA 建议潜在 ANDA申请者按照基于层次的方法,它可以有效地对比 T 产品与 R 产品之间的防止滥用的措施。体外研究应该从简单、缓和的操作开始,逐步上升到复杂、更具破坏性的操作。附录 1 提供了用于评估固体口服阿片类产品的防止滥用的措施的机械操作建议。
除了机械操作之外,在体外对比研究中可能会采用不同水平的溶剂进行化学操作,以提取阿片类物质。附录3 按溶剂的不同水平描述了在体外对比检测中推荐使用的用于提取阿片类物质用于口服滥用的溶剂。本指南推荐使用以下水平的溶剂用于体外对比研究中的化学操作:
水平 1 的溶剂:水
水平 2 的溶剂:可通过商业途径获得的食品级醋,0.2%小苏打溶液,40%
乙醇,和碳酸水。
水平 3 的溶剂:食用油,异丙醇,丙酮,0.1 N 盐酸,和 0.1N 氢氧化钠。
除了上述溶剂之外,潜在申请者可能会使用其它溶剂,鼓励寻求FDA 对适用于产品特定开发的额外检测的意见。
图1提供了评估从完整口服剂型提取出阿片类物质的能力(见附录3中的进一步讨论)的基于层次的方法的举例,以决策树的形式展示。
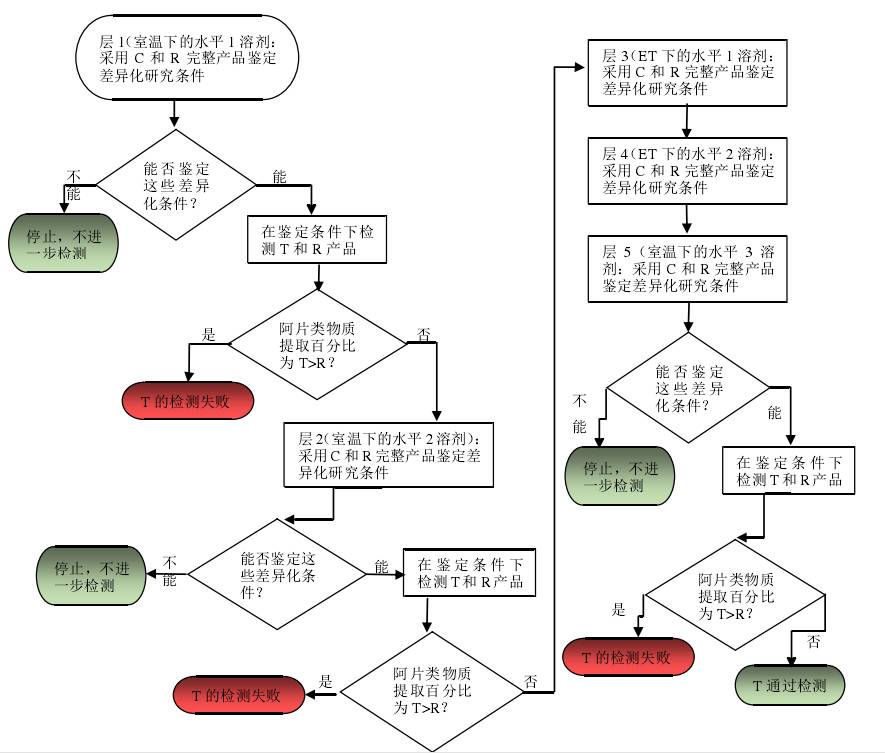
图 1:完整产品(口服途径)的可提取性评估的决策树。
ET:评估温度
其它考虑事项
A. 多个规格
寻求固体口服阿片类药物仿制药多个规格的批准的潜在ANDA 申请者应该评估每个规格的 T 产品将其与 R 产品进行对比。或者,潜在申请者可以提供支持数据来证明不同规格的 R 产品与T 产品之间的组分比例,作为无需开展对比所有规格的T 产品与R 产品的研究的依据。如果提供了这样的依据,在体外评估研究中应采用覆盖了有助于防止滥用的阿片类物质/辅料的极端比例的括号设计法。
B. 药代动力学研究
如果并无可靠的体外检测方法,应进行评估 T 产品的防止滥用的措施并将其与
R 产品进行对比的药代动力学研究。如果可用的体外检测方法过度敏感或者不能充分地评估和对比 T 产品与 R 产品的防止滥用的措施,潜在 ANDA 申请者还可以提议进行PK 研究。
例如,在评估口服的提议产品的滥用可能性时,如果在尝试附录 3 中推荐的溶出度研究之后,潜在申请者认为该检测过度敏感,不能表征该仿制药的防止滥用的措施,可以在 PK研究中进一步评估该产品。在这种情况下,潜在申请者在执行研究之前,可以寻求FDA关于 PK 研究设计的意见。
一般来说,PK 研究应该在健康志愿者中进行,加入纳曲酮以阻断阿片类药物的药效学作用。推荐测量的阿片类药物及其活性代谢物的 PK 参数包括峰浓度(C
max)、达峰时间(Tmax)、和曲线下面积(AUC0-t和 AUC0-∞)。如果适用,还应测定部分 AUC(p-AUC)。对于激动剂/拮抗剂产品,还应测定激动剂和拮抗剂及其活性代谢物(如果有)的 PK 参数。在对比R 产品和T 产品的 PK
参数时,潜在 ANDA 申请者应确保在通过拟定途径给药之前,对这两个产品所进行的机械或化学操作是相同水平的。潜在ANDA 申请者应提交 PK 研究方案给FDA 审查。
C. 其它研究
一般来说,体外和 PK 的对比研究可以提供充分的证据证明 T 产品的防止滥用的措施不低于 R 产品。一般不建议进行其它研究,除非在某些情况下,如对比作为厌恶剂使用的某辅料的防止滥用的可能性,例如,在T 产品中包括的厌恶剂与R 产品中的厌恶剂不同,在用量上也不同(见附录 4 中关于可爱度降低的讨论)。例如,在对比作为厌恶剂使用的某辅料的防止滥用的可能性时,FDA
可能会建议申请者进行将 R 产品和 T 产品之间的药物喜好作为一个对比终点的药效学研究,以便 FDA 评估配方等效性。鼓励潜在 ANDA申请者在开展该研究之前寻示 FDA 对研究设计的意见。
数据分析
应通过对比R 与 C、T 与 C、以及 T 与 R,采用推论性分析来评估 T 产品每种滥用途径的防止滥用措施。在本指南中建议的针对每种滥用途径的分析中,基于层次的方法并采用零假设的等级设置作为后续零假设的看门者,差异化研究条件从缓和的逐渐上升到更具破坏性的。采用等级推论法是为了维持总体试验率 α=0.05。逐步运算法和统计分析只有在是否需要进一步检验 T 产品以评估其防止滥用的措施时才起决定作用。
层次通过差异化研究条件来定义,从层 1中最缓和的研究条件开始。层 1
作为后续层次的序贯看门者。层 1 中的所有零假设必须被推翻后才能检验下一个层次的零假设,下一个层次是指更复杂的差异化研究条件。在层 1 中,所有零假设按 I 类错误水平α=0.05 来评估,不会按假设的数量来调整;这遵循关闭检验原则。零假设中所有可能的交集必须是待行检的零假设层次中的元素。如果在 I 类错误水平 α=0.05 被拒绝,则任何零假设被拒绝,这一零假设的可能交集在这一 α 水平上也被拒绝。















