CD8+T细胞与PD-1免疫治疗
已经是免疫研究领域的“老演员”了,相信大家一定不陌生。
今天为大家解读这篇由复旦大学附属中山医院肝癌研究所肝脏外科/移植科团队与南通大学附属医院合作发表在一区杂志
《Clinical and Translational Medicine》
(
IF=7.9
)上的文章,学习一下怎么在给“老演员”排新戏份,引领评审专家们“入戏”,从而拿下国自然界奥斯卡。
如果大家计划开展
免疫治疗
领域课题,又有课题设计方面的困扰
,
可以扫码联系我们:

文章标题:
Anlotinib potentiates anti-PD1 immunotherapy via transferrin receptor-dependent CD8
+
T-cell infiltration in hepatocellular carcinoma

本研究通过使用
器官型肿瘤球体
(PDOT)
和
肝细胞癌(HCC)小鼠模型
研究了安罗替尼和抗PD-1疗法的联合作用。为深入研究疗效变化的机制,研究人员对来自HCC小鼠模型的原位肿瘤进行
质谱流式细胞术
(CyTOF) 分析
,最后使用HCC患者的组织样本和临床数据进行进一步证实,最终得出研究结论:安罗替尼通过
PI3K/AKT/HIF-α通路
抑制TFRC表达,上调CXCL14基因,将CD8+ T细胞募集到TME,从而提高抗PD-1治疗的疗效;TFRC是评估晚期HCC患者预后、预测抗PD-1治疗疗效的潜在生物标志物。

图1 文章机制图
接下来咱们依次剖析一下从主要研究内容中拓展出的问题,学习一下干湿结合研究的“公式”,从而将其应用到实验设计与标书撰写中。
问题1:
为什么要关注肝癌的免疫治疗,本研究的临床意义是什么?
免疫检查点阻断(ICB)疗法是多种癌症包括肝细胞癌(HCC)在内的有效治疗方法,但HCC患者对PD-1/PD-L1抗体治疗的总体反应率仍然不是特别高,且由于原发性或获得性ICB耐药性,很少有患者实现完全治愈。因此,探索新的联合治疗方法至关重要。
问题2:
为什么关注抗PD-1疗法与酪氨酸激酶抑制剂(TKI)联合使用效果?本研究如何证实疗效的提升?
最新研究表明,酪氨酸激酶抑制剂 (TKI) 和抗PD1抗体同时使用可以增强肿瘤抑制的协同作用。安罗替尼是多靶点酪氨酸激酶抑制剂,通过抑制受体进而破坏肿瘤血管生成,促进血管正常化并增强免疫细胞的浸润,从而改变肿瘤微环境 (TME)。
在本研究中,研究人员们通过以下
三个方面
对疗效提升进行了实验证实:
1、安罗替尼增强PD-1阻断的抗肿瘤活性:
研究人员通过
免疫荧光显微镜和流式细胞术
进行实验验证,结果显示安罗替尼与抗PD-1抗体之间的协同作用显著增强了肿瘤抑制,超过了单独疗法的效果;使用
联合药物指数(CDI)方法
评估表明药物间存在协同作用;进一步在
HCC小鼠模型
中检验联合治疗的疗效,联合治疗方案显示出更有效的肿瘤生长抑制作用。
TUNEL染色实验
表明,单药治疗组的凋亡细胞显著增加,联合治疗组的TUNEL阳性细胞百分比最高。

图2 安罗替尼在体内和体外增强 PD-1 阻断的抗肿瘤活性
2、PD-1 阻断与安罗替尼联合治疗促进CD8+ T 细胞浸润增加:
研究人员采用
CyTOF
检查不同治疗组的肿瘤标本,将免疫细胞分为49个簇,进一步采用无监督聚类方法将这些簇分为10个免疫细胞群,结果显示联合治疗组的T细胞计数显著增加。随后,研究人员采用
免疫组织化学方法验证各组T细胞的浸润情况,联合治疗组的T细胞浸润水平显著升高,
表示安罗替尼和抗PD-1抗体联合治疗以依赖T细胞浸润的方式抑制肿瘤细胞增殖。
 图3 安罗替尼在调节肿瘤免疫中起着至关重要的作用
图3 安罗替尼在调节肿瘤免疫中起着至关重要的作用
3、安罗替尼诱导免疫信号并促进促炎细胞因子的产生:
研究人员对HCC小鼠模型进行转录组分析,结果显示联合治疗导致基因表达谱发生显著变化。进行GO/KEGG/基因集富集分析 (GSEA)
显示免疫和炎症反应相关通路显著聚集,进一步采用两种不同的
免疫信息学算法(mMCP-counter 和 ssGSEA)评估不同组间TME的变化,研究人员发现安罗替尼治疗后
与CD8+T细胞浸润相关的基因显著增加
;多色免疫荧光及流式细胞术分析证实
安罗替尼治疗后CD8+ T细胞PD-1表达显著增强。

图4 安罗替尼触发免疫反应信号并诱导促炎细胞因子和趋化因子的产生
1、
研究人员利用
蛋白质-蛋白质相互作用网络
,最终确定三个枢纽基因:TFRC、CD22 和FLT3。
2、
qRT-PCR
及
Western blot 实验
证实,安罗替尼给药后TFRC蛋白表达显著下调,安罗替尼可能通过VEGFR2/AKT/HIF-1α轴抑制TFRC。
3、
研究人员通过使用基于TCGA数据库的
ssGSEA 算法
估计免疫细胞群的相对丰度,发现低
TFRC 表达与细胞毒性 CD8+ T 细胞向肿瘤组织的浸润增加呈正相关。
4、
将细胞在不同条件下
与CD8+ T细胞共培养
结果显示,安罗替尼治疗与TFRC 敲低促进CD8+ T细胞募集,表明
TFRC 表达在调节 CD8+ T 细胞浸润的功效中起着至关重要的作用。
5、
在HCC小鼠肿瘤样本中,趋化因子CXCL14表达差异最显著,进行
transwell
测定,结果显示CD8+T细胞迁移呈剂量依赖性增加。
6、
对TFRC敲低的小鼠肿瘤进行
免疫组织化学分析
显示:安罗替尼抑制TFRC表达并诱导HCC细胞分泌CXCL14,促进CD8+ T细胞浸润到TME。

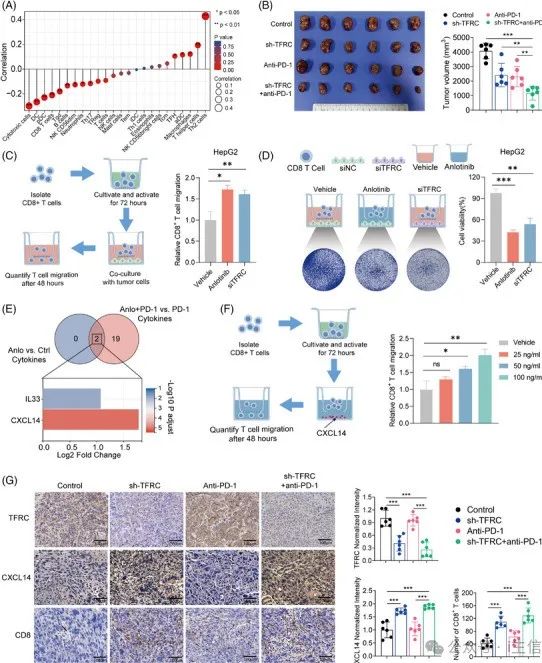 图5-6 安罗替尼靶向VEGFR2/AKT/HIF-1α轴调节免疫反应
图5-6 安罗替尼靶向VEGFR2/AKT/HIF-1α轴调节免疫反应
免疫组织化学染色结果显示TFRC低表达的患者CXCL14 高表达,并且有更多的CD8+ T细胞浸润。进一步结合TCGA 数据库与GEO数据库分析发现,TFRC表达较低的HCC患者的预后(总体生存率)明显优于TFRC表达较高的患者,即
低TFRC表达与HCC更好的预后和对抗 PD-1 治疗更好的反应相关。
 图7 TFRC与HCC患者的总体生存率和对抗PD-1免疫疗法的反应相关
图7 TFRC与HCC患者的总体生存率和对抗PD-1免疫疗法的反应相关
本研究表明安罗替尼和抗PD-1免疫疗法结合是晚期 HCC 患者的治疗新策略,这为未来的临床试验提供了理论基础和临床前数据。从机制上讲,安罗替尼通过抑制
VEGFR2-AKT-HIF
轴抑制TFRC的表达,进而增强CXCL14的分泌并募集肿瘤浸润CD8+ T细胞,从而增强抗PD-1治疗的抗肿瘤功效。
本研究
创新点:
使用
PDOT模型
来评估免疫治疗药物的疗效,该模型
模拟了肿瘤免疫微环境
,这一新模型可以
提高免疫肿瘤学研究的精准度
,促进更有效疗法的开发。
研究也存在
局限性
:
1、临床前模型中证明了安罗替尼与抗 PD-1 治疗相结合的疗效,但还需要通过
广泛的前瞻性随机对照
试验进一步验证;
2、抗PD-1抗体与其他TKI的协同效应需要进一步研究;
3、应评估联合疗法的
潜在毒性和脱靶效应
;
4、需进一步研究TFRC调节CXCL14的具体机制,阐明CXCL14表达背后的调节机制。
总体来讲,本研究和我们之前解读的文章一样,都是经典分子的创新研究。只要大家学会“干湿结合”创新公式,以后再也不用担心本子被评审专家吐槽没新意了!





