1967年,中国人民解放军制定了一项植物筛选研究计划,以期发现抗疟药物。将中国传统中草药与化学技术相结合,屠呦呦最终提取纯化出青蒿素单品。作为该项目的一部分,这一发现挽救了数百万人的生命,屠呦呦也因此获2015年诺贝尔奖。五十多年过去了,一个现代化的中国生物制药产业终于又开始起航了。
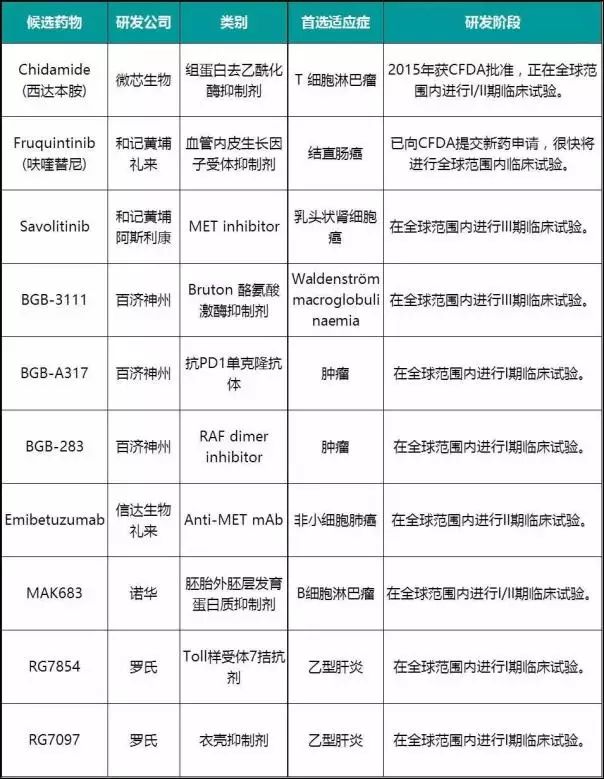
起初,中国生物制药公司推出的候选药物大都属于“best-in-class”。今年,和记黄埔医药科技已向CFDA提交“中国造”VEGFR抑制剂——Fruquintinib(呋喹替尼)的上市申请。目前,一些分布在中国的跨国药企研发中心开始推出“first-in-class”候选药物,并进行全球临床试验,比如,在中国的研发中心,礼来的治疗糖尿病的候选药物,诺华的抗肿瘤候选药物以及罗氏的抗乙肝候选药物。各公司推出的一些候选药物如表1所示。
表1 部分在中国研发的代表性候选药物
虽然,当初跨国药企把研发业务布局在中国主要是为了节省研发经费,但现在它们更看重中国这一迅速崛起的医药市场。据估计,2016年中国药物市场规模达1170亿美元,仅次于美国,成为全球第二大市场。在外企们看来,将研发布局在中国,可以更好地分享这一市场的红利。
尽管涌现出一批新型候选药物,然而,与美国对全球药物创新的贡献度高达50%相比,目前中国只有4%。但是,这一占比正在快速蹿升,这主要得益于政府、药企以及风险投资机构对新药研发的资金支持。据统计,中国政府和药企对研发的投入从2007年的20亿美元上升至2012年的85亿美元,增长了将近4.3倍。2012年,中国的医药类风险投资基金(Venture capital ,VC)只有不到1亿美金,但2016年超过了10亿美金,增长了将近10倍。如图1所示。虽然,2012年美国医药研发投入高达1190亿美元,但较2007年下降了9%。
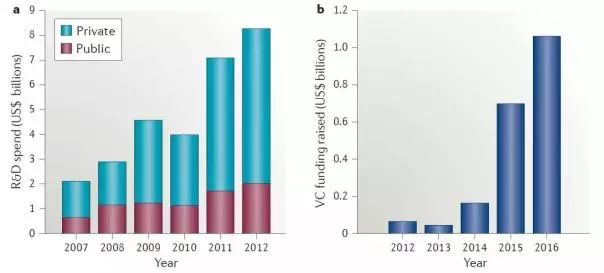
图1 a显示出2007-2012年间中国政府和民间资本对医药研发的投入;b显示出2012-2016,中国医药类VC资本的成长。
医药监管制度的改革也在塑造着中国医药研发的“生态”。近年来,CFDA动作频频,比如,对虚假临床数据“痛下杀手”,进行大规模的一致性评价,对新药设立优先审评通道等等,更多的改革举措正在酝酿中。
观察家们对中国生物医药行业的未来普遍持乐观态度。“从现在起,10年后,全球最大的药企中的一个应该会在中国,我对此深信不疑。”百济神州CEO John Oyler 如是说道。
第一批闯入中国新药研发“生态圈”的是合同研发组织(CROs),它们为那些力图削减研发经费的跨国公司提供外包服务。比如,早期的药明康德和康龙化成。
和记黄埔医药科技成立于2000年,起初目标是把中医药推向世界市场,并没有研发新药的打算。直到Christian Hogg(和记黄埔CEO)在履职5年后,才将研发现代新药纳入公司的业务版图中来。然后,毕业于哈佛大学,师从诺贝尔奖得主E. J. Corey,并且在辉瑞工作了15年的苏慰国成为和记黄埔的首席科学家,他确信能够以较低的花费组建一支高效的研发队伍,聚焦于成熟靶点,开发新一代更具潜力的新药(best-in-class)。Fruquintinib就是这样一款产品。
第一代VEGFR抑制剂,比如拜耳与安进联合开发的sorafenib(索拉非尼);第二代VEGFR抑制剂,比如辉瑞的sunitinib(舒尼替尼);它们都是多种激酶抑制剂。广泛的阻断效应会带严重的药物毒性,第一、二代VEGFR抑制剂药物耐受性差,治疗面临空窗期。鉴于此,和记黄埔致力于寻找高选择性的VEGFR抑制剂,Fruquintinib作为第三代VEGFR抑制剂,在一项由416名结直肠癌患者参加的III期临床试验中达到预设终点。在今年6月份举办的ASCO大会上,和记黄埔就这个项目做了演讲。
Fruquintinib,这个和记黄埔与礼来联合开发的药物,将成为首批完全在国内研发的候选药物之一。在中国,进行临床研究不仅花费较低,庞大的患者群体也有助于志愿者的快速招募。15年来,和记黄埔平台共投入4亿美元,组成了330名科学家队伍,将8个候选药物推向了临床。




