目前,基于CRISPR-Cas系统的众多分子工具能够简易高效地对大多数物种的基因组实现精确的插入,删除,缺失,替换等类似于文档编辑的功能,并已被广泛地应用于研究人类遗传疾病,癌症治疗,改良农作物品种等生物医学领域。
然而,由于基因组不同位置有着不尽相同的上下文环境,导致这些工具在一些位点的编辑活性不佳,无法实现预期目的,因此往往需要进一步的分子工程化改造来提升工具性能。CRISPR-Cas12a系统以其自主加工向导RNA
(gRNA)
序列,识别基因组中富含A/T DNA碱基的区域, 产生粘性DNA切割末端等诸多不同于Cas9系统的新特性,受到领域内的青睐。其同源蛋白AsCas12a和LbCas12a已被用于包括人在内的哺乳动物细胞基因组编辑,但是要求在靶向位点上游有较为复杂的紧邻序列
(PAM)
, 这限制了其靶向更多位点的能力;在其他已报道的Cas12a同源蛋白中,FnCas12a对PAM的要求更少,具备很大潜力来扩大Cas12a系统的识别范围,但是在人细胞基因组中,FnCas12a在很多位点都没有可检测的编辑活性
【1】
。
因此,如何能够在保证Cas12a编辑活性的同时又扩大其可靶向位点的范围,成为研究Cas12a系统的热点问题。
2020年12月21日,河北科技大学基因编辑研究中心
武永强
课题组和美国莱斯大学化学工程系博士研究生
袁启宸
(共同通讯)
合作在
The CRISPR Journal
杂志上发表了题为
Improving FnCas12a genome editing by exonuclease fusion
的研究文章。
通过对FnCas12a切割模式的分析,结合人类细胞内源DNA修复通路中非同源末端连接机制
(NHEJ)
,提出将单链DNA外切酶与FnCas12a进行融合,以引导NHEJ机制对FnCas12a产生的DNA断裂末端倾向性地进行易错修复而非精准修复,从而提升了所靶向位点的随机插入和删除
(Indel)
的效率,为应用CRISPR-FnCas12a在人类细胞中进行有效基因敲除 (knock-out)提供了新思路
(图一)
,
并有望进一步用于开发治疗人类遗传疾病的策略,例如镰刀型细胞贫血症
(SCD)
, 遗传性I型酪氨酸血症
(HT-1)
,杜氏肌营养不良症
(DMD)
等一系列可通过基因敲除达到治疗效果的疾病
【2】
。

在此前已报道的研究中,提高CRISPR-Cas12a基因敲除效率的策略通常集中于两类:一是通过对Cas12a的蛋白质工程化改造来增强Cas12a的核酸酶活性, 二是通过优化gRNA序列来提高其二级结构的稳定性,以避免gRNA被内源蛋白降解而影响Cas12a的靶向功能。然而,基因敲除的决定性步骤——NHEJ通路很少被合理地利用到。当DNA双链断裂
(DSB)
产生后,NHEJ通路会尽快将断裂的两端重新连接在一起,而其修复结果很大程度与DSB断口的形状直接相关,在平末端情况下,NHEJ倾向于在连接过程中随机引入Indel,最终得到出错的序列,从而达到基因敲除的目的;而在两个粘性末端完全互补配对的情况下,NHEJ通常会准确地修复断口,而不会产生Indel
【3】
。因此,研究人员认为通过将FnCas12a的DNA切割末端由互补配对的粘性末端变成平末端,可以引导NEHJ通路更加偏向易错修复,从而提高FnCas12a的基因敲除效率
(图一)
。
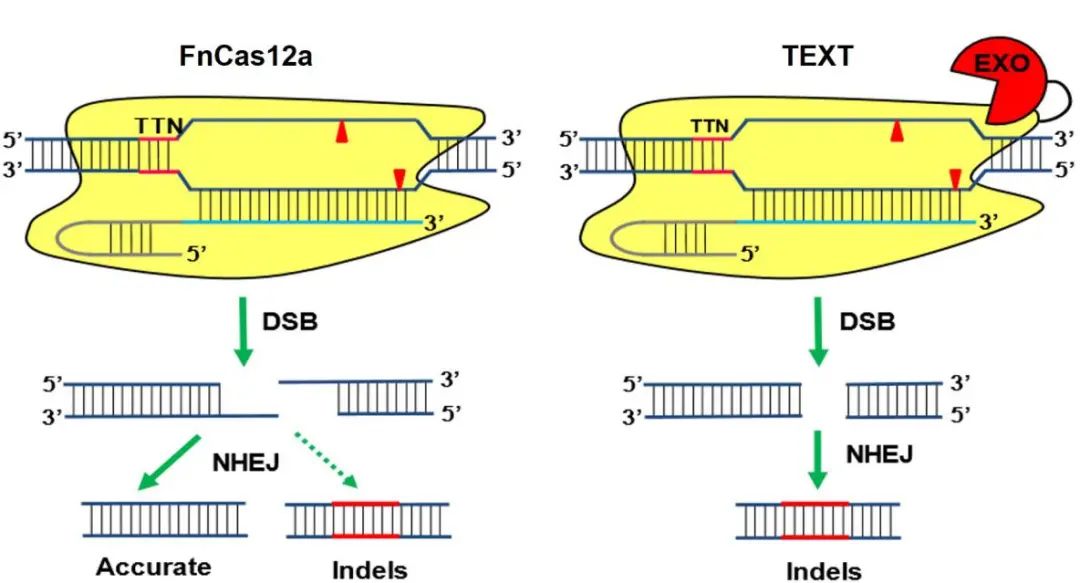
图一 | TEXT系统利用易错NHEJ通路提升FnCas12a的knock-out效率。
为了验证这个假设,研究人员选取了多种单链DNA核酸酶与FnCas12a融合,发现多种候选酶都对基因编辑效率有提高效果,其中来源于T5噬菌体的DNA外切酶融合到FnCas12a的N端提升效率最高,并将其命名为TEXT
(Tethering EXonuclease T5 with FnCas12a)
系统,此系统可以将细胞NHEJ修复引导到易出错的通路,使Indel效率明显高于单独使用FnCas12a的效率, 在FnCas12a 无检测活性的位点,TEXT也显著性地提升了Indel效率。TEXT 与FnCas12a、 LbCas12a和AsCas12a相比,在所有测试位点中编辑效率都是最高,并且在所测脱靶位点没有表现出显著的脱靶效应
(图二)
。文章最后也指出,目前尚不清楚T5外切酶是否会对细胞中自然发生的DNA损伤反应
(例如细胞内源产生的DNA双链断口)
具有一定的脱靶效应,因此在未来有待通过开发新的深度测序方法来监测外切酶在全基因组范围的脱靶效应,相应地,系统的蛋白质工程或者时间空间高度可控的基因编辑方法都可用于进一步提升TEXT的安全性能。
值得注意的是,中科院
邱金龙
研究组今年稍早发表的文章中也利用相似的策略,将T5外切酶与Cas9或LbCas12a进行融合,在对水稻的基因编辑中也得到了Indel有所提升的结论
【4】
。两项研究的不同点在于,在人细胞中所测试的Cas12a同源蛋白中,只有FnCas12a与T5外切酶的融合表现出明显的Indel提升,而AsCas12a或LbCas12a与T5外切酶的融合均没有显著增加Indel效率。为了解释所发现的不同点,研究人员根据Jennifer Doudna研究组在今年六月份发表的文章推测
【5】
,由于AsCas12a和LbCas12a不仅会产生粘性末端,还会降解沿非靶向ssDNA链的几个碱基,因此本身具备类似于TEXT系统的功能,其编辑效率在人细胞中有可能趋近于饱和状态,限制了外切酶的效果。
图二 | TEXT系统与FnCas12a, AsCas12a 和LbCas12a在不同位点的编辑活性比较
总的来说,
TEXT系统提升了FnCas12a在人基因组中基因敲除 (knock-out) 的效率, 扩大了FnCas12a可以靶向的范围,在NTTV类型PAM的人类基因组所测位点上,TEXT系统显示出比FnCas12a、LbCas12a和AsCas12a更高的基因编辑效率。
原文链接:
https://www.liebertpub.com/doi/10.1089/crispr.2020.0073
1.B. Zetsche et al., Cpf1 Is a Single RNA-Guided Endonuclease of a Class 2 CRISPR-Cas System.
Cell
163, 759-771 (2015).
2.D. Wang, F. Zhang, G. Gao, CRISPR-Based therapeutic genome editing: Strategies and in vivo delivery by AAV vectors.
Cell
181, 136-150 (2020).
3.J. Budman, G. Chu, Processing of DNA for nonhomologous end‐joining by cell‐free extract.
The EMBO journa
l 24, 849-860 (2005).
4.Q. Zhang et al., Fusing T5 exonuclease with Cas9 and Cas12a increases the frequency and size of deletion at target sites.
Science China Life Sciences
, (2020).
5.J. C. Cofsky et al., CRISPR-Cas12a exploits R-loop asymmetry to form double-strand breaks.
Elife
9, e55143 (2020).




