作者:何健民 来源:蒲公英
延伸阅读
基于“互联网+” 打造端到端、全程可控的药品追溯系统(一)
2.2 国内药品追溯系统建设现状
2.2.1 中国药品电子监管码的“十年”
2006年,为加强药品电子监管工作,提高公众用药安全水平,实现药品全品种全过程监管,原国家食品药品监督管理局开始实施药品电子监管工作。
自2007年11月1日起,麻醉药品、第一类精神药品制剂、小包装原料药被全部纳入电子监管。2008年11月1日起,第二类精神药品、中药注射剂、血液制品、疫苗被全部纳入电子监管。2012年2月底前,国家基本药品全品种全部被纳入电子监管。
2015年1月4日,CFDA发布《关于药品生产经营企业全面实施药品电子监管有关事宜的公告》公告,要求在2015年12月31日前将境内药品制剂生产企业、进口药品制药厂商全部纳入中国药品电子监管网。同时,所有药品批发、零售企业必须全部入网。至此,中国所有药品全部被纳入电子监管范围。
2015年12月30日,国务院办公厅发布《关于加快推进重要产品追溯体系建设的意见》。明确了“生产经营企业要严格遵守有关法律法规规定,建立健全追溯管理制度,切实履行主体责任”。
2016年1月25日,湖南养天和大药房企业集团有限公司状告CFDA。
2016年2月20日,CFDA正式发布《关于暂停执行2015年1号公告药品电子监管有关规定的公告(2016年第40号)》,暂停执行药品电子监管网。在随后的《药品经营质量管理规范》修改版文件中,关于药品电子监管的所有内容,或者被删除,或者被修改。
2016年9月22日,CFDA发布《关于推动食品药品生产经营者完善追溯体系的意见》,明确“食品药品生产经营者应当承担起食品药品追溯体系建设的主体责任,实现对其生产经营的产品来源可查、去向可追。在发生质量安全问题时,能够及时召回相关产品、查寻原因”,“鼓励生产经营者运用信息技术建立食品药品追溯体系”。
2017年1月20日,中信二十一世纪(中国)科技有限公司发布《关于中国药品电子监管网不再更新的通知》,自2017年3月1日起,其将不再继续更新中国药品电子监管网系统。
目前国内部分省市电子监管码扫描和上传执行情况见下表:
Table 1国内部分省市药品电子监管码扫码及上传执行情况表
序号 | 省区 | 执行情况 | 备注 |
1 | 上海 | 产品入库必须扫描药监管码并上传 | 上海九州通、国控、上海医药分销 |
2 | 云南 | 无相关要求,现阶段不扫码 |
|
3 | 湖北 | 无相关要求,现阶段不扫码 |
|
4 | 福建 | 无相关要求,现阶段不扫码 |
|
5 | 湖南 | 无相关要求,现阶段不扫码 |
|
6 | 江西 | 无相关要求,现阶段不扫码 |
|
7 | 广东 | 现阶段不扫码 | 省药监局下发通知要求暂停 |
8 | 河南 | 无相关要求 | 个别商业在扫码上传 |
9 | 浙江 | 基药入库扫码,商业已经暂停 | 麻黄碱、精神类药品正常扫码 |
10 | 北京 | 无相关要求,现阶段暂停 |
|
2.2.2 中国药品电子监管码的编码原则和应用标准
2.2.2.1中国药品电子监管码编码原则
中国药品电子监管码(以下简称药监码)是由20位数字加密编码,采用Code128C一维条码和数字字符形式体现,支持自动识别设备及人眼识读。药监码分为一级药监码(药品最小销售包装)、二级药监码(药品中包装)、三级药监码(药品外层包装,如此类推),分别用来标识最小销售包装药品、中间独立包装药品和外箱独立包装药品。
药监码前7位(产品资源码)包含企业信息、药品名称、剂型、批准文号、包装规格等信息,方便数据存贮,可应用于物流、零售结算环节的使用。药品电子监管码8到16位是单件产品序列号,最后4位是校验位,校验位由特殊加密算法生成,编码原则如图6所示。
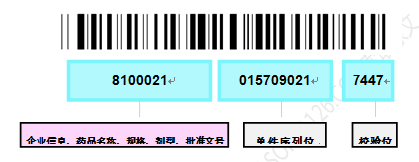
Figure 8中国药品电子监管码编码原则
2.2.2.2中国药品电子监管码在追溯过程中的应用标准
(1) 生产环节数据采集
药品在生产环节,通过药监码需采集如下数据:
必选:药品通用名、剂型、制剂规格、包装规格、包装单位、生产企业名称、批准文号、药品有效期、生产批号、生产日期、有效期至、生产数量、药品采购商名称、出库单号、出库类型、出库日期等。
可选:外包装照片、质量检验报告单、上游药品发货商名称(退货必选)、入库单号(退货必选)、入库类型(退货必选)、入库日期(退货必选)、运输及仓储要求、退货原因(退货入出库必选)、销毁原因(销毁出库必选)、销售价格、承运方(特殊药品必选)、运输证明号(特殊药品必选)、预计运输时间(特殊药品必选)、商品条码、药品本位码等。
(2) 批发环节数据采集
药品在批发环节,需进行药监码核注核销,并需采集如下数据:
必选:上游药品发货商名称、入库单号、入库类型、入库日期、下游药品供应商名称、出库单号、出库类型、出库日期等。
可选:仓储温度、退货原因(退货入出库必选)、销毁原因(销毁出库必选)、采购价格、销售价格、承运方(特殊药品必选)、运输证明号(特殊药品必选)、预计运输时间(特殊药品必选)等。
(3) 零售环节数据采集
药品在零售环节,需进行药监码核注核销,并需采集如下数据:
必选:上游药品发货商名称、入库单号、入库类型、入库日期、出库类型、出库日期等。
可选:仓储温度、出库单号(退货出库必选)、退货原因(退货出库必选)、销毁原因(销毁出库必选)、采购价格、销售价格、购药人身份证号、医保卡号等。
2.3 中国药品电子监管码和国际标准的比较
2.3.1 中国药品外包装相关编码
中国药品外包装包含以下相关编码:中国药品电子监管码、商品编码、产品批号、生产日期、有效期(至),药监码的编码规则上文已阐述,在此不再赘述。外包装相关编码情况如下:
(1)产品批号:是用于识别某一批产品的一组数字或数字加字母。但要特别注意这组数字与该产品的生产日期没有直接联系,如某产品批号可标示为20120215、0101504002、6TA049等形式,从批号上不能确定生产日期。
(2)生产日期:不得迟于产品成型或灌装(封)前经最后混合的操作开始日期,不得以产品包装日期作为生产日期,表现形式可以为2017/03/01、2017.03.01、17.03.01。
(3)有效期(至):是指药品在规定的储存条件下,保证质量的最长使用期限,超过这个期限,则不能继续销售、使用,否则按劣药查处。药品有效期的计算是从生产日期开始的,如某种药品生产日期是:20170213,有效期是三年,那么有效期的合法标示就是20200212或2020年1月。
(4)商品编码:采用EAN/UCC-13的代码结构,详细介绍如下:
(1)当前缀码为690、691时,EAN/UCC-13的代码结构:
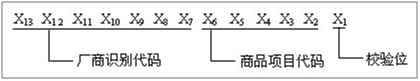
Figure9EAN/UCC-13代码结构-1
(2)当前缀码为692、693时,EAN/UCC-13的代码结构:
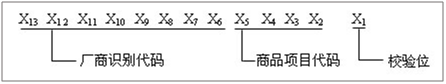
Figure10 EAN/UCC-13代码结构-2
A、厂商识别代码由中国物品编码中心统一向申请厂商分配。厂商识别代码左起三位是国际物品编码协会分配给中国物品编码中心的前缀码。
B、商品项目代码由厂商根据有关规定自行分配。
C、校验位用来校验其他代码编码的正误。
国内药品外包装示例如图9所示。

Figure11中国药品外包装示例图
2.3.2 国外药品外包装相关编码
以美国为例,药品外包装编码主要包含:GS1 GTIN、Expiry date、 LOT/Batch number、Serial Number,既GS1产品识别码、失效期、 批号、序列号,国外药品外包装示例如图12所示。
(1)GS1 GTIN:GTIN是全球贸易项目代码(Global Trade Item Number),这种编码叫EAN/UCC-14代码结构,对应ITF-14条码。它的编码规则是单品的EAN/UCC-13代码加包装指示符。
(2)Expiry date:对应国内的“有效期(至)”,指药品使用期限。
(3)LOT/Batch number:对应国内“产品批号”。
(4)Serial Number:产品序列号。
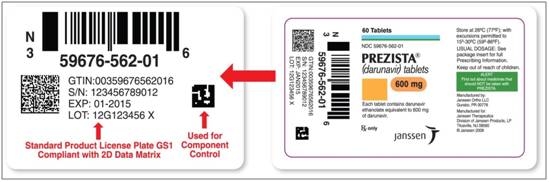
Figure12国外药品外包装示例图
2.3.3 中国药品电子监管码和国际标准的比较
详细对比项目及对比情况见表2。
Table 2中国药品电子监管码和国际标准对比表
对比项 | GS1 128条码 | 中国药品电子监管码 |
使用国家 | 全球使用 | 仅中国使用(2017年3月1日起中国药品电子监管网不再更新) |
覆盖行业范围 | 全行业覆盖(药品、医疗器械及其他) | 仅仅是针对药品 |
码的编制和分配 | 由GS1协调将编码分配到企业,由企业自行为产品编制和分配,由第三方中立标准化机构管理; | 原来由国家食品药品监督总局(中国药品电子监管网)向每个生产企业产品编制和分配编码,现在可由第三方平台提供此服务 |
编码标准 | 采用国际统一的编码标准和结构 | 没有相应的国际标准和行业标准 |
编码实现方式 | 支持一维码、二维码、RFID射频标签 | 一维码 |
编码的唯一性 | 全球唯一码,通过利用序列号的应用标识符,可同样实现一盒一码 | 中国唯一码,实现一盒一码 |
管理成本 | 管理成本低 | 管理成本高,离不开后台服务 |
开放性 | 开放的系统,任何人都可以通过扫描条码,在数据库读取相关信息 | 封闭的数据管理系统,必须基于后台数据库提供信息 |
可识别性 | 直观、包含信息量大的识别符 | 不直观,信息的获取必须通过内部数据链接获得 |
物流平台兼容性 | 与公共物流平台兼容 | 物流平台的使用必须依赖于封闭的数据库,无法和公共物流平台兼容 |
3、药品生产企业如何建立产品追溯系统
产品追溯系统不是由一个单独的软件构成,它是由多个业务系统通过协同工作、数据共享、流向挖掘组合而成,其核心是通过扫描产品追溯码,实现端到端:原料采购、产品制造、物流运输、商业客户、产品销售的全程可控、可追溯,最终实现“来源可查、去向可追、责任可究”。
首先,我们看一下在产品追溯的过程中会涉及到那些关键节点:药品生产企业、物流承运商、商业客户、销售终端,产品在这些关键节点的流转过程中,需要实现物流信息和流向信息的同时追溯,才能实现闭环的产品追溯管理,产品追溯系统的原理详见图13所示。
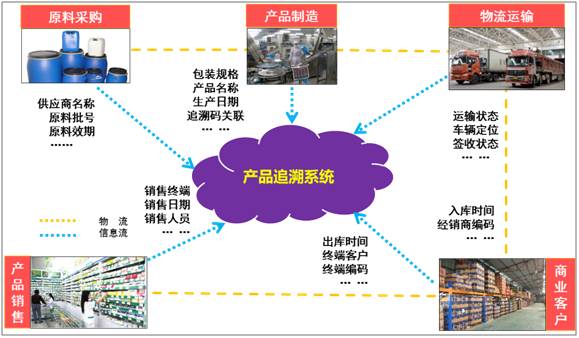
Figure13产品追溯系统原理图
追溯的实现原理及每一个关键节点完成的主要工作如下:
药品生产企业:
(1)生产所需原、辅、包等材料,通过ERP系统记录其供应商名称、批号、有效期、质检情况等信息;
(2)由ERP系统通过BOM清单及MRP运算结果,匹配生产计划所需原、辅、包物料,实现原、辅、包等材料同产品批号、产品规格的关联;
(3)产品在完成最小包装单元后,通过赋码线扫描包装外的“产品追溯码”,实现“产品追溯码”和生产批号的关联,实现“一盒一码”;
(4)扫描的最小包装单元累计数量达到设定大箱装箱量时,通过扫描大箱外的“包装追溯码”,实现最小包转单元上的“产品追溯码”同大箱的“包装追溯码”多对一的关联,实现“一箱一码”;
(5)仓库接到发货指令,在集货区按照商业客户(收货地点)划片堆放所购产品,通过手持终端扫描发货单条码、包装追溯码及粘贴箱唛,实现①商业客户和发货单号的关联;②发货单号和包装追溯码的关联;③发货单号和承运商运单号的关联;④承运商车辆GPS和发货单号的关联;⑤记录发货日期、承运商信息、车辆信息、车辆GPS信息、发货单明细等信息同步至产品追溯系统。
物流承运商:
(1)运输车辆每隔5分钟提供车辆GPS信息,通过车辆GPS和发货单号的关联信息,绘制产品运输实时路径,进行动态产品追溯;
(2)依据历史大数据分析,预测达到日期,推送到商业客户微信端;
(3)运输车辆超期预警,及时获取路况照片,避免冻损等意外情况发生;
(4)商业客户签收单在线照相回传,第一时间反馈药品生产企业,实现商业客户签收的即时送达。
商业客户:
(1)从物流接收产品入库时,用手持终端扫描“包装追溯码”,扫描信息同步上传至产品追溯系统,实现工业到商业的流向追溯;
(2)向终端配送时,用手持终端扫描“包装追溯码”或“产品追溯码”,并匹配终端名称,实现商业到终端的流向追溯;扫描信息同步上传至产品追溯系统;
销售终端:
(1)从商业客户接收产品入库时,用手持终端(或手机端APP)扫描“产品追溯码”,记录终端入库日期、终端名称、产品规格,扫描信息同步上传至产品追溯系统;
(2)产品出售时,用手持终端(或手机端APP)扫描“产品追溯码”,记录终端销售日期,并上传至产品追溯系统。
至此,产品从生产端到销售端的追溯原理设计完成。总的来说,就是依托于“产品追溯码”、“包装追溯码”,同时结合必要的物联网设备在关键节点进行扫码关联,最终完成了产品从生产→物流运输→商业出入库→终端销售全生命周期的追溯管理。
3.2追溯系统应用架构设计
正如前文所述,产品的追溯系统在数据的收集、流向的采集过程中,涉及药品生产企业、物流承运商、商业客户、销售终端这四个主要节点,每个节点在产品追溯系统中承担的角色各不相同,但提供的数据需要进行充分的关联,因此需要涉及不同的业务系统分配给每个关键节点使用,下面从系统应用架构设计的角度,讨论一下产品追溯系统的子系统构成。












