
本周关注

9月8日,第三方医学检验行业的开创者及龙头企业,广州金域医学检验集团股份有限公司(股票代码:603882)正式在上海证券交易所挂牌。在当前国家正深化医疗卫生体制改革的大背景下,金域医学的上市将原来就处于黄金爆发期的第三方医学检验行业再次推向了风口。
当前,国家正深化医疗卫生体制改革,全面启动医联体建设事业,推动区域内医疗资源有效共享,不断提升基层服务能力,加快建立分级诊疗模式。据研究机构测算,国内第三方医学检验市场占医学检验市场的份额已从2013年的3%上升到2015年的5%。增长快速的同时,占比仍较低,这也意味着潜在市场空间巨大。前瞻产业研究院行业报告数据显示,基于国家政策以及医疗改革制度的进展,预计2014-2020年第三方医学检验市场规模还将保持35%-40%的较快增长,占医学检验市场的份额在7%-9%之间。
不久前,国家卫计委批准了5类独立设置医疗机构的消息,包括医学检验实验室、病理诊断中心、医学影像诊断中心、血液透析中心、安宁疗护中心,似乎为中国的病理现状注入了“强心剂”。
我国独立医学检验实验室的市场份额占整体医学检验市场规模不足5%;相较之下,日本、欧洲、美国的这一比例则高达 67%、50%和35%。据美国LabCrop年报数据显示,2016年,美国临床实验室检测行业的收入约为80亿美元。
这里所说的独立医学检验实验室又被称为第三方医学检验机构,和传统的医院检验科不同的是,该实验室属于单独设置的医疗机构,为独立法人单位,独立承担相应的法律责任,和医院没有关联。
从概念上来区分,对于病理诊断而言,关于“实验诊断学(laboratory diagnoses)”的临床科室在中国叫检验科(Dept. of clinical laboratory medicine),美国则是在病理科(Dept. of pathology)里有一个临床检验的分支。因此美国医院的病理科相当于中国的检验科和病理科合在一起。
国内将医学检验业务分为医学诊断和病理检验两大类,由于单独的病理检验实验室市场较窄,许多企业都是以涵盖医学检验业务的独立医学检验实验室形式为主,病理是提供医学检验服务的一部分。
中国的平均癌症五年生存率为30.9%,美国的平均癌症五年生存率为66.9%,而美国的顶级癌症医院大部分癌症五年生存率可达80%以上。究其原因是国外把病理诊断当作是非常最重要一环。
从美国的案例看,含有病理检测、诊断的机构看,大致分为三类:
一是独立的第三方医学检验实验室,也包括小部分业务单一的独立病理中心,主要提供各类疾病的病理检测和诊断业务,有通过认证的实验室场地与器械;
二是各类大学内设的病理实验室,在开设病理学的大学或医学院内,一般都设有单独的病理实验室供学生进行科研及实践,同时提供对外检测服务,包括哈佛医学院、UCLA等知名大学都有独立的病理实验室;
三是医疗中心或医院独立出去的病理科及病理诊断中心,在肿瘤治疗中心及大型医院内,将专门的病理科或单独的病理中心服务独立于医院之外,是一种趋势。这类机构与第一类独立病理中心的区别在于这类病理中心属于附属机构,由医院或医疗中心统一运营,如安德森癌症诊疗中心和梅奥诊所都配备有病理诊断中心。
这一点和国内涉及病理诊断与检测机构类似。在中国涉及病理诊断与检测可也可以分为三类:第三方医学检验实验室、医疗机构、大学病理实验室。其中全国最大的区域病理会诊中心是集中在医疗机构内。
例如,2011年卫生部医管司在北京主持召开了“肿瘤病理远程会诊试点工作启动会”。会上宣布北京协和医院病理科、四川大学华西医院病理科和浙江大学附属第二医院病理科成为全国的三个区域性病理会诊中心,并受了牌。同时,还确定了19个省级远程病理会诊中心和61家远程病理会诊试点医院,华西医院病理科也是四川省的远程病理会诊中心。
国家临检中心的专家表示,医院背负沉重的设备经费负担,意味着昂贵的医疗资源浪费,患者的支出也难以降低。“独立医学实验室的出现,对改善这种情况有一定帮助。”卫生部临床检验中心主任申子瑜在不同场合均表示。
我国的第三方医学检验行业发展距成熟市场仍有一定差距,主要原因系公立医院占我国的医疗服务市场的主导地位,公立医院非营利性的业务性质和体制因素使其运营较为封闭,其医学检验及病理诊断业务一般均由院内检验科、病理科完成。公立医院的检验科、病理科由此成为我国医学检验市场的主体。
第三方医学检验在我国的发展可追溯至20 世纪80 年代中期,彼时有机构涉足检验业务的社会化服务。以后又陆续有一些不同形式的检验业务服务中心、部分医院的对外开放实验室等,但均未成规模。至21 世纪初,我国第三方医学检验行业开始了高速发展。
当前,国家正深化医疗卫生体制改革,全面启动医联体建设事业,推动区域内医疗资源有效共享,不断提升基层服务能力,加快建立分级诊疗模式。这些改革举措都促使第三方医学检验行业成为了资本追逐的风口。第三方医学检验行业的发展将迎来黄金时期。
目前国内发展较好的第三方医疗检测公司有:金域医学检验有限公司、艾迪康医学检验中心、迪安诊断技术股份有限公司、中山大学达安基因股份有限公司,公司规模、检测项目、服务等均迅速发展,占据了第三方医学检验市场的前四把交椅,四家共占有市场容量的70%。
9月1日,2017中国医学检验实验室高峰论坛在上海成功举行,会上医学检验领域专家汇聚一堂,共同探讨医学检验市场的现状、未来趋势、技术发展、临床应用、投资上市等问题。
据统计,我国第三方医学检验行业市场规模从2010年不足10亿元增长到2015年的约100亿元,占整个医学检验市场份额从1%提高至5%。与会嘉宾认为,按照现在的增长速度,三到四年内,国内第三方医学检验市场将至少会翻一番,整个医学检验市场份额占比将提高到10%,而影响增长速度的关键是国家政策,若医改力度比较大,这个时间还会缩短。
艾迪康医学检验中心实验室副总经理潘超则认为现在政策发展还需要一定的过程,比如现在国家允许第三方医学检验所在符合标准的情况下设立采血室,但是目前第三方医学检验所的样本来源主要还是依赖医院提供。原因在于医保,只有通过医院进行采血,国家医保才会报销。
影响美国和中国的病理中心的发展相同因素都离不开政策的驱动。不仅如此,就独立病理中心而言,医疗保险也对美国的影响深远。
A、美国政策驱动病理中心连锁化
从1960年到1995年,美国的年医疗总支出占美国当年GDP的比例从5.1%提高到了13.6%。为了减轻医疗支出的负担,从20世纪80年代初,美国进入医保控费阶段,美国政府和商业医疗保险机构侧重于控制成本,利用包括通过改变医疗保健服务的报销(例如,从服务费转为资本补贴),改变医疗保险政策(如医疗福利设计)等手段,试图控制医疗支出。
受医疗保险政策的影响,医院控制成本的压力增加,也促使他们将更多的检验项目外包给运营成本更低的独立实验室。到了20世纪80年代中,医院占临床检验市场60%左右的份额,私人诊所占20%左右的份额,而独立实验室占20%左右的份额。
加上20世纪80年代,美国《临床检验改进修正法案》(CLIA)出台,将医学检验规范法制化,使得大型高质量的独立医学实验室迅速取代了小型实验室。相比医院检验科,独立医学检验机构因为规模效应,具有高效、高质、低成本的优势。
在付费方面,诊断领域的控制方式包括按病种付费及总额付费,这两种付费方式使医院注重医疗成本,将成本高的检验项目外包给独立实验室,同时门诊检验也更多外送到独立实验室,医院检验数量减少12%。
私人诊所检验项目少,成本高,医保对诊所实验室检验采取不报销或者报销额低于其成本,促使大量私人诊所关闭其检验实验室,将标本外送给独立实验室。此外,检验实验室标准提高增加了实验室运行成本,也淘汰了部分诊所实验室。
独立实验室近一半业务来自于门诊外包的常规检验,到90年代中期,美国的独立实验室市场呈现LabCrop和Quest两大寡头竞争的局面。
B、中国病理政策颁布时间的回顾
而在中国,随着国家卫计委陆续发布了关于鼓励社会办医、落实病理诊断中心基本标准和管理规范通知等多部鼓励病理发展的政策。具体如下:
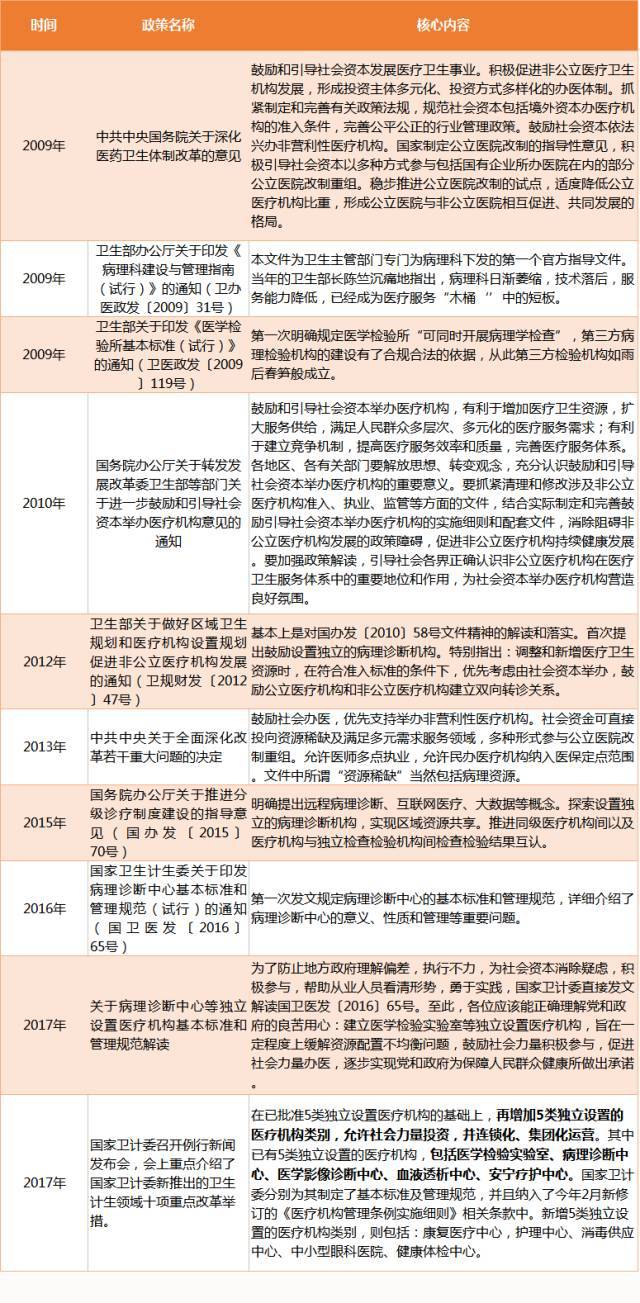
从列表中可以看到,中国的病理领域的政策,追溯到2009年。其原因是当年卫生部部长陈竺沉痛地指出,病理科日渐萎缩,技术落后,服务能力降低,已经成为医疗服务“木桶”中的短板。
2017年8月10日,国家卫计委召开例行新闻发布会,会上指出,将在已批准 5 类独立设置医疗机构的基础上,再增加 5 类独立设置的医疗机构类别,允许社会力量投资,并连锁化、集团化运营。其中已有 5 类独立设置的医疗机构,包括医学检验实验室、病理诊断中心、医学影像诊断中心、血液透析中心、安宁疗护中心。
A、国外病理行业标准,以美国为例
1、实验室认证标准
美国病理学家协会COLLEGE OF AMERICAN PATHOLOGISTS(简称CAP),是美国一个非赢利的临床实验室认可机构,它依据美国临床检验标准化委员会(CLSI)的业务标准和操作指南,以及1988年的美国临床实验室改进规范(CLIA’88),对临床实验室各个学科的所有方面均制定了详细的检查单,通过严格要求来确保实验室符合质量标准,从而改进实验室的实际工作。
与ISO15189(医学实验室认证)、ISO17025(实验室管理标准)不同,CAP认证,是美国病理家协会举办的一种国际认证。自1962年起在美国普遍采用执行,通过CAP认证的检验室代表其检验室品质达到世界顶尖水准,并获得国际间各相关机构认同。目前,中国已有十几家实验室达到该标准并取得了CAP认可,并在主要一二级城市中快速增长。
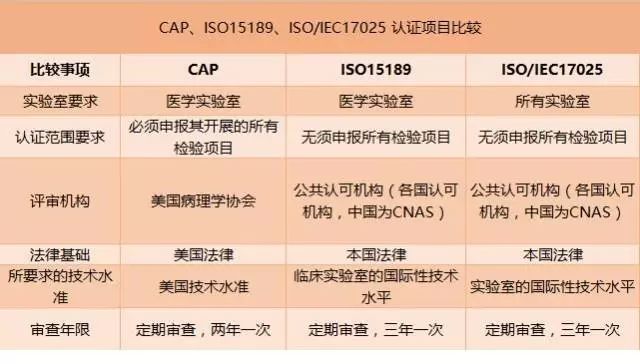
CAP评审标准:美国病理部门病理部门普遍参照CAP所制定的规范建设,CAP评审标准是依据CAP自己制定的检查要点,该检查要点可以通过CAP网站购买或申请认证后免费获得。
CAP认证流程包括三个阶段:
CAP认证之前:准备工作;
CAP认证过程:向CAP提交认证申请,启动CAP认证程序,完成现场检查;
CAP认证之后:年度内审、CAP现场复审、室间质评。
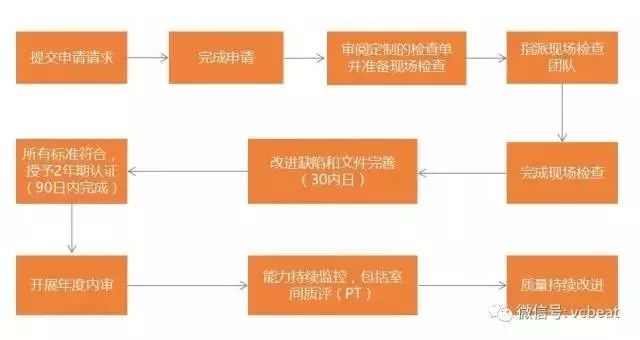
CAP认证流程
CAP现有18种评审检查要点,包括:解剖病理、化学和毒理学、细胞遗传学、细胞病理学等,申请CAP认证的实验室上报所开展的试验项目和所属专业小组后,CAP会为每个实验室量身定做好与其服务范围相符合的评审检查要点。
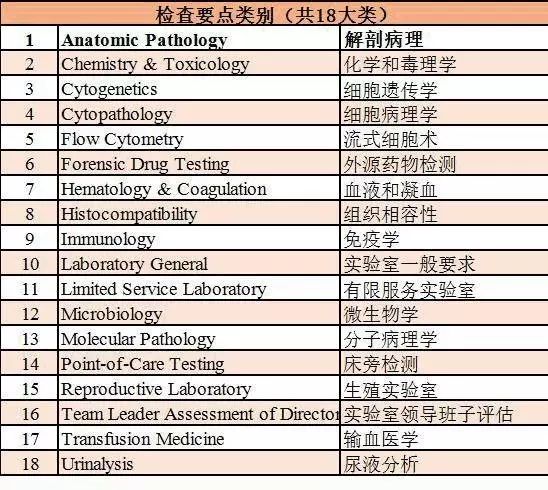
CAP的18种评审检查要点
申请CAP认证的实验室资质要求是有一位具有相应资质的实验室总监(实验室负责人),根据所开展的检验类型的不同, 实验室总监资质要求可能也不同。越复杂的检验项目要求实验室总监经验越丰富。实验室总监必须具有 MD、DO、PhD 学位,或按照CAP 确立的人员要求,拥有集教育和经验于一体的综合能力。
申请CAP认证之前需至少提前半年参与CAP的PT项目,开展针对患者标本的医学检验业务。
为符合CAP的实验室认证要求,实验室还必须建立以下关键文件体系:

2、病理医生培养制度
世界各国病理医生都有严格的准入制度,只有经过严格的病理专业培训和考试才能获得作为病理医生的资格。这个准入制度都是由各国的专业协会来掌控和把关的,并要求病理医生不断取得继续教育的学分,从而保证病理医生的诊断质量和知识水平不断更新。
以美国为例,病理医生在美国属于临床医师,要成为病理医生,必须获得美国执业医师执照。病理医生和其他临床医师一样,需要经过漫长、严格的过程。
1.获得学士学位;
2.参加并通过全国医学院入学考试(MCAT);
3.4年医学院学习,获得医学博士学位;
4.参加并通过美国医师执照考试;
5. 申请美国的住院医师培训计划;
6.3年的全科医师训练;
7.5~8年的病理专科训练;
8.结业后即可应聘病理主治医师(attending physician),从而获得签发病理诊断报告的资格。
B、中国病理诊断中心基本标准(试行)8大汇总
病理诊断中心是通过显微镜进行病理形态学观察,运用免疫组化、分子生物学、特殊染色及电子显微镜等技术,结合病人的临床资料,对人体器官、组织、细胞、体液及分泌物等标本做出病理诊断报告的独立设置法人单位,能够独立承担相应法律责任。不包括医疗机构内设的病理科。
1、定义
诊疗科目是病理科,应包括组织病理学室、细胞病理学室、免疫组织化学室、分子病理学室等相关专业学科。有病案、信息、仪器耗材、实验室质量控制等专门部门或专职人员,可设置远程病理诊断部门。
2、人员
(一)至少有5名中级及以上临床病理类专业技术职称的全职执业医师。病理诊断中心负责人应为具有副高及以上病理学专业技术职称,并从事病理诊断工作15年以上的执业医师。
(二)至少有10名以上病理技术人员,承担病理组织学、细胞学、免疫组化及分子检测的技术工作。至少有1名具有中级及以上专业技术职称,负责病理技术工作。
(三)实验室质量与安全管理人员应当具有中级以上专业技术资格,并经过专门的培训。
3、房屋和设施
(一)业务用房面积不少于总面积的75%,房屋应当具备双路供电或应急发电设施,重要设备和网络应当有不间断电源。
(二)建筑面积不少于600平方米,其中分子病理实验室等功能区应按照相关标准设置,并与其危险化学品、生物安全防护级别相适应。
(三)实验室及其他区域面积和设施能够满足正常工作的需要。
(四)设置医疗废物暂存处,配备污物和废液处理设备或交给有专业资质的公司、单位回收处理并签有协议。
4、分区布局
(一)病理业务功能区。布局和流程应当满足工作需要,符合医院感染控制要求,区分清洁区和污染区。具备相应的工作区,包括接诊及标本接收区、标本准备区、大体检查及取材区、组织脱水处理区、切片制作区、细胞学处理区、特殊染色和免疫组化工作区、分子病理工作区、试剂和粍材保存区、标本保存区、医疗废物处理区和医务人员办公区,读片讨论区、图书室等基本功能区域。开展远程病理诊断的,还应当设置远程诊断间。
(二)辅助功能区。医疗费用结算,以及仪器耗材和消毒供应室等。
(三)管理区。病理档案、信息、实验室质量控制与安全管理部门。
5、设备
(一)基本设备。
离心机、加样器、消毒设备、生物安全柜、标本柜、切片柜、蜡块柜、大体摄影装置、数字切片扫描系统、光学显微镜等常规设备配置数量要与业务量相适应;
至少有一台5人以上共览显微镜;
配置相应数量的分子病理诊断和技术设备,如聚合酶链式反应(PCR)室及相应设备、核酸提取设备、分子杂交仪、低温离心机、荧光显微镜等;
专业病理设备包括密闭式全自动脱水机、蜡块包埋机、HE全自动染色机、摊片机、石蜡切片机、自动液基/薄层细胞制片设备、冰冻切片机(可选)、全自动免疫组化染色机等,专业病理设备需有“国食药监械”级别的医疗器械注册号。
(二)信息化设备。具备信息报送和传输功能的网络计算机等设备,以及标本管理和报告管理、数字切片管理、质控、浏览及远程会诊等信息系统。
6、规章制度
建立病理诊断中心质量管理体系,制定各项规章制度、人员岗位职责,实施由国家制定或认可的诊疗技术规范和操作规程。
规章制度至少包括设施与设备管理制度、仪器及试剂管理制度、标本管理制度、检查前、中、后三个阶段的质量管理制度、患者(标本)登记和医疗文档管理制度、卫生统计与疫情报告制度、信息管理与患者隐私保护制度、技术分级管理制度、医务人员职业安全防护管理制度、医疗废物/危险化学品和生物安全管理制度以及消防安全管理制度,并制定与病理诊断项目相适应的标准化操作规程。
7、其他
(一)建立病理诊断中心的单位或者个人必须符合《医疗机构管理条例》(中华人民共和国国务院令第149号)及其实施细则的相关规定。
(二)病理诊断中心属于单独设置的医疗机构,由设区的市级及以上卫生计生行政部门设置审批。病理诊断中心应由省级卫生计生行政部门组织专家审核验收,验收通过后按管辖权进行执业登记后方可开展病理诊断服务。
(三)病理诊断中心为独立法人单位,独立承担相应法律责任。
(四)病理诊断中心应当建立完善的室内质控、室间质评和会诊制度,积极参与省级病理质控中心的各项活动,接受其定期考核。配合卫生计生行政部门及其委托的省级病理质量控制中心或者其他组织所开展的质量检查和技术指导。
(五)承担其他医疗机构病理诊断任务的,应与相应医疗机构签署医疗服务合作协议,保障病理诊断服务的质量和时效。
(六)委托其他医疗机构承担试剂、检验、辅助检查和消毒供应物品的病理诊断中心,应与相应医疗机构签署医疗服务合作协议,保障相应医疗服务的质量和及时性。
通过对比得悉,虽然中国和美国关于病理行业的政策、标准有不少差异,但是从美国的独立病理中心的发展路径中,我们依旧可以看到中国第三方医学检验的潜力,以及可期的未来,这片“蓝海”产业值得期待。
来源:动脉网
1. 9月5日,美国 FDA 分别给予三款用于罕见疾病治疗药物孤儿药资格的认定,这三家公司及对应药物分别为:美国 Deciphera Pharmaceuticals 用于多形性胶质母细胞瘤和间变性星形细胞瘤治疗的 DCC-2618;美国Atara Biotherapeutics 的用于巨细胞病毒血症及免疫系统受损伤患者治疗的 ATA230;荷兰 ProQR Therapeutics 用于 USH2A 基因 13 外显子突变的乌谢尔综合征治疗的 QRX-421。
2. 9月6日,据美国科技博客techcrunch报道,消息人士透露,消费级基因检测公司23andMe计划融资2亿美元,红杉资本领投,富达投资有意参投。该公司希望获得更多资金,壮大其基因研究机构,开发更多新产品。
3. 9月6日,有“诺贝尔风向标”之称的拉斯克奖(Lasker Award)揭晓了2017年的获奖人榜单,Michael N. Hall博士因在TOR蛋白通路上的贡献获得了基础医学研究奖,Douglas R. Lowy博士与John T. Schiller博士则由于在HPV(人类乳头瘤病毒)疫苗上的贡献获得了临床医学研究奖。
4. 9月5日,据FierceBiotech报道,在UCART123的两项1期临床试验中,一名患者因治疗引起的严重毒性反应导致死亡,FDA因此对两项试验叫停。目前,通用型CAR-T疗法UCART123的研发还处于不确定状态,Cellectis公司正与FDA商讨,拟重新设计方案。该事件对Cellectis公司的股票也造成了严重的影响,星期二开盘,Cellectis的股票价格下降至22.79美元,下跌了30%。
1. 9月1日,EdiGene博雅辑因(北京)科技有限公司正式取得CRISPR专利授权。这也是首个取得该专利使用权的中国公司。取得CRISPR的使用授权,可以从知识产权层面保护客户和合作者的利益,使他们未来基于已授权公司产品的研发和商业应用更安全和自由。
2. 2017年9月1日,武汉菲沙基因信息有限公司获得PacBio官方认证。据悉,菲沙基因是国内首家获得PacBio官方认证的测序服务提供商。目前全球仅有17家机构获得PacBio官方认证。国外获此认证的机构包括新加坡基因组研究所、英国利物普大学基因组研究中心、德国GATC生物技术有限公司、美国华盛顿州立大学等。
3. 9月4日,国家食品药品监督管理总局举行新闻发布会,正式发布新修订的《医疗器械分类目录》。自2018年8月1日起实施。医疗器械分类管理是国际通行的管理模式,科学合理的医疗器械分类是医疗器械注册、生产、经营、使用全过程监管的重要基础。
4. 9月5日,科技部发布消息,我国也是亚洲拥有完全自主知识产权的第一台第三代基因测序仪GenoCare研发成功并投入生产。这是全球首款临床单分子测序系统,可实现临床的快速检测。未来,仅需要几滴血或唾液进入仪器,便可直接获得分析结果,所有医院都可以直接使用。
5. 9月6日,华大基因北方中心启用暨国际海洋基因组学联盟成立仪式在青岛西海岸新区中德生态园顺利举行。联盟的成立与顺利运营,将使国内外海洋领域专家学者有新的沟通交流平台,有更多机会积极促成国际项目合作,实现科研和产业成果的突破,加快推进新技术的应用与转化,其结果必将极大的提高我国科研产出,提升我国海洋基因组学研究在国际上的地位。
6. 9月7日消息,药明康德集团企业药明明码宣布获2.4亿美元B轮融资。本轮融资由红杉中国领投,其他投资者包括淡马锡、云锋基金和3W Partners等机构。淡马锡、云锋基金和3W Partners等也参与了药明明码今年五月的融资。当时的投资机构还包括安进公司的风险投资基金Amgen Ventures以及其他长期投资者和合作伙伴。华兴资本担任本轮融资的独家财务顾问。
7. 9月8日,第三方医学检验行业的开创者及龙头企业,广州金域医学检验集团股份有限公司正式在上海证券交易所挂牌。上市后,金域医学将继续聚焦医检主业,深耕医疗行业。金域医学表示,将在服务网络方面,公司未来将加速四级实验室网络建设,继续开发空白区域市场网络,同时择机向海外市场进军;在检测项目研发方面,将以平台建设为中心、临床疾病诊断为导向,大力拓宽检验检测项目种类。
8. 9月8日上午,由国际罕见病与孤儿药大会(ICORD)、罕见病发展中心(CORD)、北京协和医院(PUMCH)共同举办的“第十二届国际罕见病与孤儿药大会暨第六届中国罕见病高峰论坛”在北京隆重开幕。大会现场,来自政府、科研机构、医学行业、医药企业、基金会等不同领域的110多位专家、学者,以及病友组织代表、患者及家属、社会爱心人士、媒体共计超过六百人出席本次大会。
· END ·
















