
“华兴资本医疗与生命科技行业周报”定期发布,专注从资本角度,解读一周数据,提供最新行业观察。
医疗与生命科技是华兴资本多年来关注并深耕的领域,目前已为超过100个融资及并购项目担任财务顾问。
医疗与生命科技行业创新不断涌现,已经发展成为最活跃的行业之一,华兴资本始终支持、陪伴这一领域创业企业成长,致力为行业带来理性专业的声音。
关注华兴资本微信公众号(ID:iChinaRenaissance),后台点击“兴观点”-“行业观察”-“生命科技”,获取更多医疗与生命科技行业相关信息。

近日礼进生物宣布完成数亿元C轮融资。本轮融资由IDG资本领投,上海自贸区基金、苏州隆门创投、成为创伴等机构跟投,华兴资本担任独家财务顾问。
礼进生物是一家生物制药公司,专注于开发创新的肿瘤免疫疗法。礼进生物利用其xLinkAb™ 研发的具有双靶向结合功能且保留天然IgG结构的激动性抗体,对肿瘤微环境
具有选择性,同时兼备传统单抗的成熟CMC工艺和可控生产成本。公司最先进的项目包括LVGN7409 和LVGN6051。

2月25日,由微医集团分拆出的数字医疗平台微医控股在近期完成超4亿美元的Pre-IPO融资,公司估值近70亿美元。该公司计划最快于下月向港交所递交IPO申请。
微医是国际领先的智能医疗平台,致力于通过科学方法、创新技术构建高效的新型医疗服务体系,为亿万家庭和机构提供线上线下结合、全科专科融合的新型医疗健康服务,目前
业务涵盖微医云、微医疗、微医药、微医险四大领域,微医与全国30个省份的2,700多家医院信息系统实现连接。

2月23日,三叶草生物宣布完成2.3亿美元C轮融资并获得超额募集。本轮融资由高瓴创投和淡马锡共同领投,海松资本和奥博资本参投,原股东康禧全球投资基金继续加持。本轮融资后,三叶草生物在过去12个月的总融资额超过4亿美元。
三叶草生物制药是由一组世界顶级海外归来的科学家创立。热衷于为数以百万计无法获得现代生物药品的中国病患者研发革新性的生物靶向制药。三叶草生物团队获得了2009年国务院侨办颁发的 “重点华侨华人创业团队”称号,并入选2012年
成都市首批顶尖团队。公司创新性靶向生物制药研发共获得3项国家十二五“重大新药创制”重大专项及“抗体药物关键技术”863计划的立项支持和认可。

近日软银投资的生物制药公司Roivant Sciences宣布以4.5亿美元的价格收购Silicon Therapeutics,并支付额外的潜在监管和商业里程碑相关的费用。
Silicon Therapeutics成立于2016年,是一家以物理驱动药物研发的公司,公司在美国波士顿和中国苏州两地都建立了核心研发机构,目前有两种研发药物已经进入了临床阶段。其多学科团队通过开创一种与化学和生物学研发紧密结合的物理驱动的药物设计方法,推进生物技术的范式转变。其研发平台专为开发新颖的小分子疗法而设计,以解决经过生物学和遗传学验证但以前难以治疗的蛋白质靶标。

2月25日,默沙东宣布和Pandion Therapeutics达成最终协议,以每股60美元的价格收购Pandion的所有流通股,折合后股权对价合计18.5亿美元
。
Pandion致力于开发解决自身免疫性疾病患者未满足需求的创新疗法,包括IL-2融合蛋白PT101以及PD-1激动剂。Pandion的技术平台产生的双特异性抗体携带的靶向
部分能够有特异性地在局部与产生炎性疾病的特定组织相结合,而抗体携带的效应部分能够调节免疫活动,从而恢复免疫平衡。

2月24日证监会按法定程序同意科美诊断科创板首次公开发行股票注册。此次IPO拟公开发行股票不超过41,000,000股,拟募资6.35亿元。公司计划将募集资金用于新建体外诊断试剂生产基地项目、体外诊断试剂及配套产品研发项目、LiCA试剂与配套仪器研发项目和LiCA试剂与关键生物原料研发项目。
科美诊断是中国领先的体外诊断仪器及配套试剂、技术服务提供商,专注于为临床诊断提供系统解决方案,也是一家专注于临床医学实验室诊断产品研发,生产,销售和服务的专业化高科技企业。公司产品为基于光激化学发光法的 LiCA
系列诊断试剂和基于酶促化学发光法的CC系列诊断试剂及仪器。

2月25日,上海证券交易所科创板上市委员会召开2021年16次上市委员会审议会议。威高骨科上会接受审核,正式启动科创板上市流程。本次计划发行股票在4,141.42万股以内,投资项目主要包括研发中心项目建设、骨科植入产品扩产项目以及营销网络建设项目。
威高骨科医疗器械产品种类齐全,主要经营业务涉及骨科医疗器械研发、生产和销售,主要包括创伤类产品、关节类产品、脊柱类产品以及骨科手术器械等产品。公司拥有境内专利206项,其中发明专利42项,外观设计专利4项,实用新型专利160项。产品已经在我国1,500多家医院临床应用,成为我国骨科产品线上完善的骨科企业之一,满足了我国多样化的临床需求,是骨科器械赛道佼佼者。

1.多款新冠疫苗已在中国获批,有灭活疫苗、腺病毒疫苗等
2.一次接种就能降低感染风险70%,首个英国真实世界研究显示新冠疫苗防护效力

多款新冠疫苗已在中国获批,有灭活疫苗、腺病毒疫苗等
2月25日,中国药监局宣布附条件批准武汉生物的新型冠状病毒灭活疫苗和康希诺生物的重组新型冠状病毒疫苗注册申请。武汉生物的疫苗自去年7月16日起在多个国家开展了III期临床试验,数据显示该疫苗接种后安全性良好,两针免疫程序接种后接种者均产生高滴度抗体,中和抗体阳转率为99.06%,疫苗的保护效力为72.51%。
康希诺生物获批的疫苗名为克威莎,是首个获批的国产腺病毒载体新冠病毒疫苗,由康希诺与中国军事科学院军事医学研究院生物工程研究所联合团队合作研发,已在巴基斯坦、墨西哥、俄罗斯、智利及阿根廷开展了III期临床研究。结果显示,在单针接种疫苗14天后,总体保护效力为68.83%,28天后为65.28%;对重症的总体保护效力分别为14天后95.47%,28天后90.07%。
信息来源:医药观澜
一次接种就能降低感染风险70%,首个英国真实世界研究显示新冠疫苗防护效力
英国公共卫生部宣布真实世界数据显示,由辉瑞和BioNTech联合开发的新冠疫苗BNT162b2在一次接种之后,能够降低新冠病毒感染风险70%,在接种第二剂疫苗之后,感染风险降低85%,这意味着这款疫苗也可能帮助防止病毒的传播。研究数据显示,在接种第一剂疫苗21天之后,感染风险降低70%,在接种第二剂疫苗7天之后,感染风险降低85%。这一研究结果也表明BNT162b2对这一突变病毒株B.1.1.7仍然具有良好的防护能力。
信息来源:药明康德
2.FDA加速批准DMD疗法上市
3.康方生物Cadonilimab获美国FDA孤儿药资格认定
4.CDE拟突破性疗法认定:Apollomics/浦润奥c-Met抑制剂治疗NSCLC
5.肺动脉高压治疗新选择,帕母医疗原创PADN导管获美国FDA突破性医疗器械资质
6.华为涉及医疗器械领域专利被授权:可用智能体重秤测量心电图

治疗致命儿童代谢缺陷,FDA批准首款疗法
2月27日,美国FDA批准BridgeBio Pharma子公司Origin Biosciences开发的Nulibry上市,用于降低因A型钼辅因子缺乏导致的死亡风险。这是FDA批准的首款应对该疾病的创新疗法。据研究结果显示,接受Nulibry治疗的患者3年生存率为84%,而未接受治疗的患者为55%。
信息来源:药明康德
FDA加速批准DMD疗法上市
2月26日,Sarepta Therapeutics公司宣布,美国FDA已经批准其开发的反义寡核苷酸疗法Amondys 45上市,用于治疗特定类型的杜氏肌营养不良症(DMD)患者。他们携带的基因突变适合使用外显子45跳跃的策略进行治疗,大约有8%的DMD患者适用这种治疗策略。这是近3年以来,FDA加速批准的第三款基于外显子跳跃的DMD反义寡核苷酸疗法。
信息来源:
药明康德
康方生物Cadonilimab获美国FDA孤儿药资格认定
2月23日,康方生物公告称其双抗Cadonilimab(PD-1/CTLA-4双特异性抗体)获得美国FDA孤儿药资格认定,用于治疗宫颈癌。Cadonilimab是康方生物基于其专有的TETRABODY 技术,自主研发的、潜在下一代 first-in-classPD-1/CTLA-4 双特异性肿瘤免疫治疗骨干药物,是全球首个进入临床试验的PD-1/CTLA-4双特异抗体,也是康方生物的核心产品,主要适应症包括肝癌、宫颈癌、肺癌、胃癌、食管鳞癌及鼻咽癌等。
信息来源:
佰傲谷BioValley
CDE拟突破性疗法认定:Apollomics/浦润奥c-Met抑制剂治疗NSCLC
2月22日,北京浦润奥c-Met抑制剂伯瑞替尼被CDE拟纳入突破性疗法,用于治疗c-Met外显子14突变的非小细胞肺癌。伯瑞替尼是靶向c-Met的新型小分子激酶抑制剂,在多种临床前c-Met失调的人类胃癌、肝癌、胰腺癌和肺癌细胞移植动物模型和人源肿瘤移植小鼠模型中已显示出强大的抑制肿瘤作用。在I期临床试验中,Met耐受性良好,且初步显示在携带14号外显子跳跃突变的NSCLC受试者以及携带MET融合和/或14号外显子跳跃突变的继发性多形胶质母细胞瘤患者中有临床疗效,显示可穿透血脑屏障。
肺动脉高压治疗新选择,帕母医疗原创PADN导管获美国FDA突破性医疗器械资质
近日无锡帕母医疗自主研发的用于治疗肺动脉高压的多极同步肺动脉射频消融导管PADN获得美国FDA突破性医疗器械资质,并创下中国本土企业申请最短记录。这一认定不仅代表FDA对帕母医疗提交的PADN原创技术的高度肯定,也将极大加速该产品在美国启动上市前临床研究的研发和审查过程。该器械一旦获批,即可直接纳入美国医保,达成大规模临床应用。该资质认证在国内肺动脉高压治疗领域尚属首例。获得认证后,帕母医疗的团队将逐步启动FDA上市前全球临床实验,并搭建覆盖美洲、欧洲以及亚洲等主要人口区域的专业销售网络和渠道。
华为涉及医疗器械领域专利被授权:可用智能体重秤测量心电图
2月19日,华为技术有限公司关于“用于心电测量的装置和方法”专利信息被授权公开。本发明实施例涉及医疗器械技术领域用于心电测量的装置和方法。这项专利于2016年7月29日开始申请。专利描述了使用多个电势传感器捕捉电信号,然后通过信号放大器、模数转换器、滤波器等进行信号处理,从而获得有效心电信号的方法。

1.3月即将上市,首款递交上市申请的 BCMA CAR-T疗法发布关键II期研究数据
2.实现基因疗法重复给药,免疫耐受平台助力的AAV步入临床试验
3.艾伯维JAK抑制剂达到3期临床终点

3月即将上市,首款递交上市申请的 BCMA CAR-T疗法发布关键II期研究数据
百时美施贵宝和蓝鸟生物近日在新英格兰医学杂志上发布了其BCMA CAR-T疗法ide-cel的关键II期KarMMa研究结果。该研究意在评估ide-cel的疗效和安全性。数据显示该款药物达到了其总体生存的主要终点ORR和完全缓解率的关键次要终点CRR,并成功诱导了大多数重度治疗的复发难治性多发性骨髓瘤患者的反应,26%接受治疗的患者达到MRD阴性状态。Ide-cel是首款递交上市申请的靶向BCMA的CAR-T疗法,目前距离其PDUFA目标日期仅剩1个月。
信息来源:
医麦客
实现基因疗法重复给药,免疫耐受平台助力的AAV步入临床试验
Selecta Biosciences, Inc. 和AsklepiosBioPharmaceutical, Inc. 近日宣布,启动SEL-399的1期剂量递增试验。SEL-399结合了AskBio公司不含DNA的AAV8空载体衣壳与Selecta 公司免疫耐受平台ImmTOR™。该试验旨在确定ImmTOR减少基因治疗中特异性AAV8中和抗体形成的最佳剂量,评估ImmTOR在基因治疗中的安全性和初步疗效。Selecta和AskBio预计将在2021年第四季度报告该临床试验的初步结果。
信息来源:
医麦客
艾伯维JAK抑制剂达到3期临床终点
2月23日,艾伯维宣布其选择性JAK抑制剂upadacitinib在治疗中重度溃疡性结肠炎成人患者的第二项III期临床试验的诱导部分达到了临床缓解的主要终点。在这项研究中,接受upadacitinib治疗的患者中有33%在第8周达到临床缓解,显著优于安慰剂组的4%。Upadacitinib由艾伯维科学家发现和开发,是一种每日口服一次,选择性和可逆性JAK抑制剂。除达到临床缓解的主要终点以外,upadacitinib还达到这一临床试验的所有关键性次要终点,upadacitinib治疗的患者中74%在第8周获得临床应答,44%获得了内镜改善。安慰剂组的数据分别为25%和8%。
信息来源:药明康德

1.微岩医学与润达医疗建立战略合作,共建“中国病原微生物天网实验室”

微岩医学与润达医疗建立战略合作,共建“中国病原微生物天网实验室”
微岩医学与润达医疗达成战略合作,共同建设“中国病原微生物天网实验室”。双方将依托各自在检验医学领域的资源和技术优势,聚焦于病原微生物检测,共同推进感染/传染性疾病精准诊疗的平台建设。未来,双方将与全国300家以上三甲医院合作,共建“中国病原微生物天网实验室”,构建中国区域人群的病原微生物宏基因组学数据、临床数据、耐药基因数据以及智能化分析平台。

1.美敦力发布2021Q3财报,披露中国耗材集采影响

美敦力发布2021Q3财报,披露中国耗材集采影响
2月23日,美敦力发布了2021Q3财报。公司在2021前三季度营收达到219亿美元,虽然仍受到新冠疫情的影响,但整体业绩开始回暖。如其他顶级医疗企业无重磅并购出现,美敦力将继续在2021财年顶级医疗Top10中霸占榜首位置。美敦力在财报中特别声明了中国的耗材集采对其的影响:药物洗脱支架(DES)下滑超10%,中国在2020年10月进行的国家集采对于DES在中国的销售额的影响仍在持续。在首批冠脉支架国家集采中,美敦力中标的一款产品为药物洗脱冠脉支架系统Resolute Integrity。该产品的价格从18207元降到648元,降幅高达96%。在集采走向常态化的背景下,医用耗材行业生态将面临重构。尤其对于美敦力这家以高值耗材为主营收的企业来说,中国策略如何调整,尤为关键。
信息来源:
MedTrend医趋势
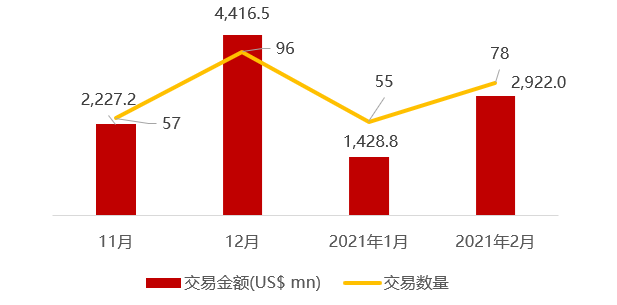
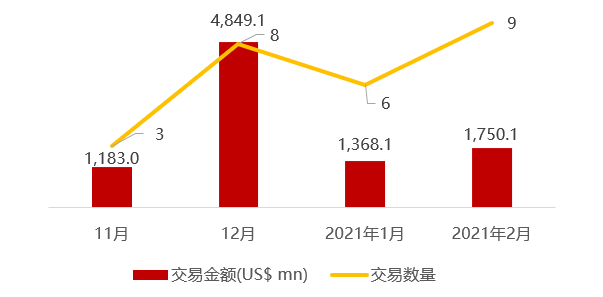
近期交易概况
(2021年02月22日-02月26日)


上市公司市值及估值倍数一览
(2021年02月26日)市值单位:百万美元

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >














