上一期我们聊了欧洲医药专利介绍、对实验数据的规定以及EPO对加快审查的规定,这一期我们重点聊一聊EPO在多晶型药物中的审查实践。
什么是多晶型药物
多晶型现象是指某一种化合物在固体状态下有可能存在的多种不同的分子排列而产生不同的固体晶体相的现象。 根据定义可知,
多晶型药物的物理化学参数可能不同,但是化学组成是相同的。
同时,溶剂化物(solvates)和水合物(hydrates)可被视为未溶解的晶型的多晶型,也被称为伪多晶型(pseudopolymorphs)。

参见:Kirsten A. Graeser et al. 2008
EPO在多晶型药物中的审查实践
审查原则
多晶型药物作为一种特殊的化学产品,在审查和后续过程中的评判和普通的化学产品类似,EPO在审查中通常会从
(1)清楚,(2)公开充分,(3)新颖性,(4)创造性,(5)单一性,(6)修改不超过原始公开范围
这六个方面重点审查。
而另一方面,由于多晶型药物的特殊性,实际审查中又存在一些差异,需要申请人在申请多晶型药物专利时注意。
定义方式
首先,对于多晶型药物来说,最重要的是清楚地表明想保护的药物具体是哪一种化合物的哪一种晶型。
清楚意味着权利要求中想保护的内容是清楚、无异议的,可以得到说明书的支持,并且与现有技术区分开来。
为了达到这一目的,可以定义某种多晶型药物的
化学式、生产方法
,如果还不能得到唯一可确定的保护范围,还可以通过
物理、化学参数
来定义。
需要注意的是,
晶型不能用数字或字母命名
,例如,化合物X的晶型II,这样的命名方法会导致混淆。
也不能用现有技术中已知的多晶型药物名称命名
,因为在现有技术中即使是同一种化合物的同一种晶型,命名方式也可能不一致。
最好的方式是通过物理化学参数表征
,并且所述参数是可以通过说明书中所示的方法、或者通过本领域通用的方法测得。
在欧洲专利体系中,
出于单一性的考虑,建议对于每一种晶型,独立权利要求用最相关和最独特的参数来限定,把其他的参数放在从属权利要求中。
定义参数
EPO推荐可以使用以下参数进行定义:
(1)X-射线衍射:
对于单晶或粉末,X-射线衍射非常适合用来表征多晶型。
单晶法
能够提供空间群、晶胞尺寸、晶胞中的分子数以及计算的密度。
X射线粉末衍射(XRPD)
则用于多晶型的定量检测和常规表征,其体现了衍射强度与2θ值之间的关系图,是待测固体的“指纹”,
可以在权利要求中用所有相关峰的2θ值来定义多晶型,但至少要在说明书中说明所有的相关测量条件和测量精确度。
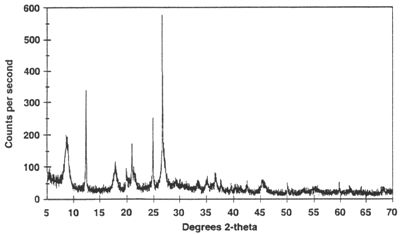
X-射线衍射图谱,参见https://serc.carleton.edu/research_education/geochemsheets/techniques/XRD.html
(2)固体谱方法:红外光谱(IR)
也是表征多晶型的一种确定的方法,因为在多晶型中特定见的构象和环境效应可能会发生变化并导致其IR谱产生差异。
说明书必须公开所有相关的实验条件,例如使用的技术、光谱类型、样品浓度、基质、以及温度,为了对比不同多晶型的IR谱,还必须公开样品的制备和纯度。拉曼光谱
可作为IR吸收的可选择的活补充的技术,拉曼光谱与IR光谱的谱带相似,但强度不同。
此外,
固态13C-NMR
也可作为参照,它提供的信息量在XRPD与IR之间。
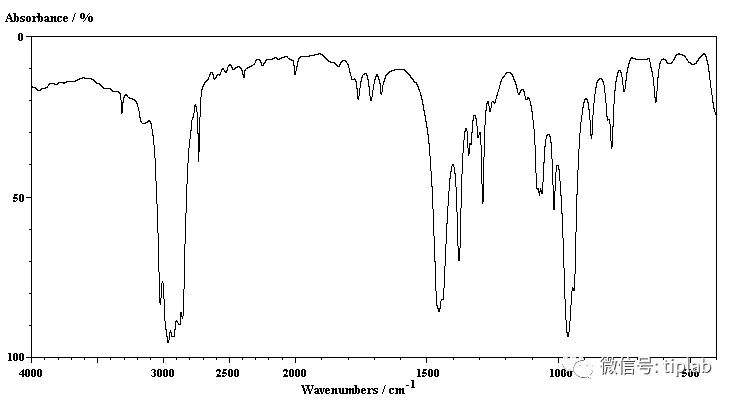
IR谱,参见http://www.chem.ucalgary.ca/courses/350/Carey5th/Ch13/ch13-ir-4-hc.html
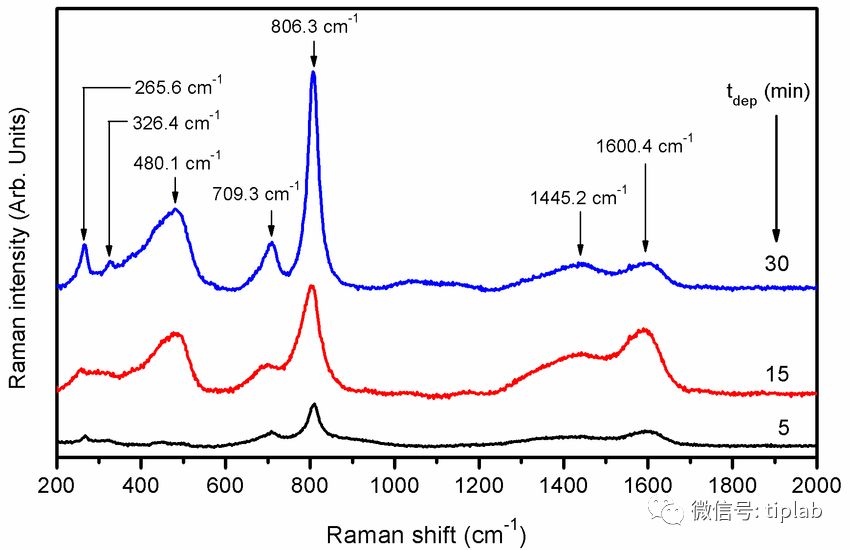
拉曼光谱,参见Pawbake, Amit & Waykar, et al. 2016
对于所有的光谱方法来说,权利要求中是提供全部的峰还是选择一部分取决于具体情况。
但是,在申请日递交的申请文件中尽可能公开完整的光谱数据。并且,如果申请人在权利要求中仅提到经选择的峰,这些经选择的峰应该是真正区分所保护的晶型与已知晶型的峰。
(3)热分析法:
固态物质检测中最常用的热分析法是
热重分析(TGA)、差热分析(DTA)和差热扫描量热法(DSC)
。
TGA适用于检测溶剂化合物中溶剂的流失或者检测降解反应,
可用于定义固态物质的重要参数包括降解温度
。
DTA和DSC适用于检测相变、脱溶剂化和降解过程,
可用于定义固态物质的重要参数包括熔点、熔融热或溶剂含量
。
类似地,建议充分公开采用热分析法测量的条件,例如升温速率、样品纯度和质量、研究溶剂化物时所用的样品盘类型、未检测到的杂质、其他多晶型物的核和种晶等。
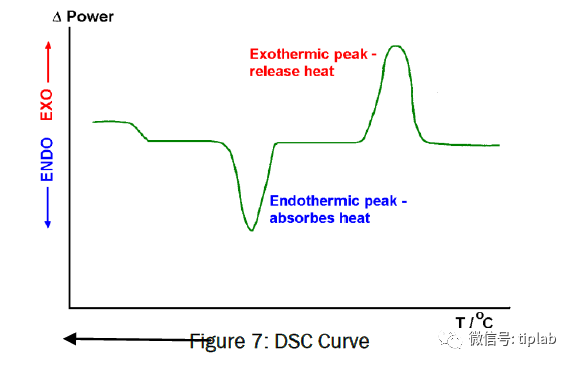
DSC曲线, Kodre KV, Attarde SR et al. 2014
对比试验数据
以上讨论了以参数方式定义多晶型的情况,
需要申请人注意使用合适的参数正确地表征并公开区别技术特征,但如果想保护的多晶型的药物和现有技术属于同一种化合物,光有表征本申请多晶型药物的数据是不够的,需要申请人提供与现有技术的对比实验数据。
因为根据EPO在审查指南中所述的规定,
如果对比文件中就区别技术特征用了不同的参数或者完全没有相关参数,而在其他方面和本申请想保护的产品相同,本申请会因新颖性缺陷而被驳回
(参见EPO审查指南,C-IV 7.5)。
计算机推测晶型类型
此外,随着计算机化学的发展,根据化合物的分子结构预测可能的晶体形式成为可能。
对于通过理论推测得出的唯一可能的晶型类型
,即使在理论上这种晶型已经存在,并且预测结果在出版物中公开,但是实际中通过实验制备得到的多晶型药物仍有可能是新的。
换句话说,如果申请人想通过专利保护多晶型药物,必须通过真实有效的制备方法制得该多晶型药物,并在申请文件中充分公开制备步骤及实验数据,例如如何测量得到上文所述的参数。光有理论推测或使用计算机模拟得到的数据不足以证明该多晶型药物的新颖性。
多晶型药物的效果
通过提供详尽的制备方法、测试得到的对于本申请想保护的多晶型药物至关重要的参数,以及与现有技术的比较试验数据,我们终于可以清楚、毫无疑义地确定这个晶型是我们想保护的多晶型药物,但是到目前为止,我们只能确定该晶型是对具有相同用途的相同化合物的已知晶体形式提供的另一种可供选择的方案。
如何才能证明该多晶型药物的创造性呢?
对于申请人而言,最简单的方法就是
表明所要求保护的多晶型相对于现有技术的固体状态能产生意料不到的技术效果。
与我国专利法类似,EPO采取类似于“三步法”的“problem-and-solution”法来确定最接近的现有技术、区别技术特征和所达到的技术效果、客观解决的技术问题和考察所问题是否得到解决以及创造性的评价。
由于多晶型药物专利申请请求保护的多为已知药物化合物的新晶型,对于预料不到的技术效果判断在创造性评述中尤为重要,可成为申请人与社会公众博弈的重点。
EPO在判断已知化合物新晶型时,重点关注效果的可预期性。
例如,
在EPO上诉案例T1422/12,替加环素案中,驳回决定认为本领域公知药物是晶体形式和无定形态相比更稳定保存,
本领域技术人员能够想到尝试将替加环素无定形态制备成晶体,因此不具备创造性。
而在驳回上诉中,申请人提出该晶型首次出现且提高了稳定性,具备创造性,
并提交对比数据证明
40℃时晶体和无定形态的稳定性试验,无定形态出现外消旋替加环素比例高、速度快,
替加环素的特定晶型相对于无定形态非显而易见。
EPO认为由于在这类四环抗生素的特定立体异构稳定性方面有预料不到的提高,因此具备创造性。
这提醒申请人在保护多晶型药物时除了物理化学特征,更应关注该特定晶型区别于其他晶型的技术效果,并且该技术效果不能根据结构可唯一确定,不等于权利要求中已知技术特征的简单叠加。
结语
本文介绍了欧洲专利局对于这一类药物专利保护的特殊要求和审查实践,在我国保护多晶型药物时还是要根据中国专利法的不同要求进行调整。















