BioArt按
:
piRNA是近年来在动物生殖细胞中发现的
一类非编码小分子RNA,它可以与
PIWI蛋白相互结合形成PIWI/piRNA“机器”,
在动物生殖细胞发育分化过程中发挥重要作用。2013年刘默芳课题组就已经发现了
小鼠piRNA在精子形成后期触发其结合蛋白PIWI(MIWI)经APC/C-泛素化降解的新途径和piRNA诱导PIWI降解的新功能,
为精子形成异常导致的男性不育症发生提供了潜在的分子信息。
那么PIWI突变是否会导致雄性不育,更准确的说人类不育症患者中是否存在PIWI突变?5月25日,来自中科院生化与细胞所的
刘默芳
研究组和上海计划生育科学研究所
施惠娟
研究组合作在
Cell
上发表了题为“
Ubiquitination-Deficient Mutations in Human Piwi
Cause Male Infertility by Impairing Histoneto-Protamine Exchange during Spermiogenesis
”的研究论文,
该研究首次发现了PIWI蛋白突变致男性不育并深入揭示了相关的致病机理,还发现了在精子变形过程中引发组蛋白-鱼精蛋白转换的新机制,
为相关男性不育症的精准医疗提供了理论基础和方法策略。
鉴于该工作在理论研究上的重要突破和潜在的应用前景,BioArt特别邀请了中科院动物所
陈大华
研究员和中科院生物物理所
俞洋
研究员撰写相关评论,以飨读者!论文通讯作者为
刘默芳
和
施惠娟
,第一作者分别为
苟兰涛
、
康俊炎
、
戴鹏
、
王鑫
和
李锋
。
特别值得一提的是,这是今年5月份,国内独立完成的第四篇研究型
Cell
论文,也是中科院上海生化与细胞研究所的第二篇文章(
陈玲玲
、
施一公
、
季维智/孙毅/陈永昌
、刘默芳),BioArt对上述成果都在第一时间做了详细报道。

论文解读:
撰文丨丁广进
点评丨陈大华研究员 俞洋研究员
piRNA是近年来在动物生殖细胞中发现的
一类非编码小分子RNA。
2006年,有4个独立的课题组几乎在同一时间报道了一类与PIWI家族蛋白相互作用的小分子RNA,长度约为24~32 nt,因为与PIWI蛋白相互作用,故称为PIWI-interacting RNA,简称piRNA。值得一提的是四篇论文中,其中一篇文章是来自耶鲁大学
林海帆
教授实验室(相关工作是在杜克大学任职期间完成的)【1-4】。
piRNA
起源于基因组中的反转座子、重复序列及一些被称为piRNA簇的区域,
piRNA与PIWI蛋白相互结合形成PIWI/piRNA“机器” ,
可以通过在表观遗传水平和转录后水平沉默转座子、反转座子等移动元件,维持生殖细胞自身基因组的稳定性和完整性,在配子形成过程中发挥重要作用。刘默芳实验室及其他国际同行实验室最近的研究显示,PIWI/piRNA机器也参与调控生殖细胞中编码基因的表达。
对
PIWI/piRNA“机器”
生物学功能及意义的研究,可以为相关男性不育症的诊断和治疗提供理论基础,具有十分重要的意义
【5】。
生殖细胞特异性表达的PIWI家族蛋白是piRNA作用途径的中心,是piRNA的生成及功能所必需。小鼠PIWI家族包括MILI、MIWI和MIWI2三个成员,特异性地在睾丸中表达,对小鼠精子发生至关重要。
刘默芳研究组近年来围绕“piRNA在哺乳动物精子发生中的功能和机制”方面做了大量系统的研究,取得了多项重要成果。
这些成果包括,发现
piRNA通过泛素-蛋白酶体途径调控其结合蛋白MIWI及自身的降解代谢,并首次揭示了PIWI/piRNA的代谢调控机制以及piRNA调控泛素化途径的新功能
(
Dev Cell
2013
); 小鼠粗线期piRNA指导父本mRNA在精子形成后期大规模降解(
Cell Res
2014
);发现了小鼠piRNA可直接介导部分睾丸mRNA的切割,揭示了piRNA可在小鼠睾丸组织中发挥siRNA类似的功能,而且该功能为雄性生殖细胞发育成熟所必需(
Cell Res
2015
)。值得一提的是,有关MIWI的代谢异常造成精子细胞发育受阻的研究,为精子形成异常导致的男性不育症发生提供了潜在的分子信息。

2013年刘默芳研究员课题组与王恩多院士课题组合作在
Dev Cell
杂志上揭示了
piRNA通过泛素-蛋白酶小体途径调控其结合蛋白MIWI及自身的降解代谢,并首次揭示了PIWI/piRNA的代谢调控机制以及piRNA调控泛素化途径的新功能
而
刘默芳研究组这篇最新的
Cell
论文在此前相关研究的基础之上,发现了无精/少弱精症患者存在拮抗人PIWI(HIWI)泛素修饰的基因突变,通过小鼠模型证明此类突变导致雄性不育,并深入揭示了其致病的分子机制。
此前在许多研究PIWI的动物模型中都证明了PIWI对生殖细胞发育的分化的重要作用,然而PIWI在人类生殖细胞发育分化中的功能并不清楚。那么作者首先提出的科学问题就是,
PIWI在人类生殖细胞形成中具有什么作用?人类不育患者中是否存在PIWI突变
?为了回答上述问题,作者首先检测了413例无精症患者(300例健康人群作为对照)
Piwi
基因(人类中又称为
Hiwi
)上一个在脊椎动物中十分保守的D-Box序列中是否存在突变。
测序结果显示,该课题组非常幸运地发现了3例无精症患者身上存在
Piwi
D-Box突变(
下图
)
。生化实验检测发现这类突变导致了PIWI蛋白泛素化缺陷,但是不影响PIWI对靶RNA分子的切割作用以及piRNA-loading的功能。
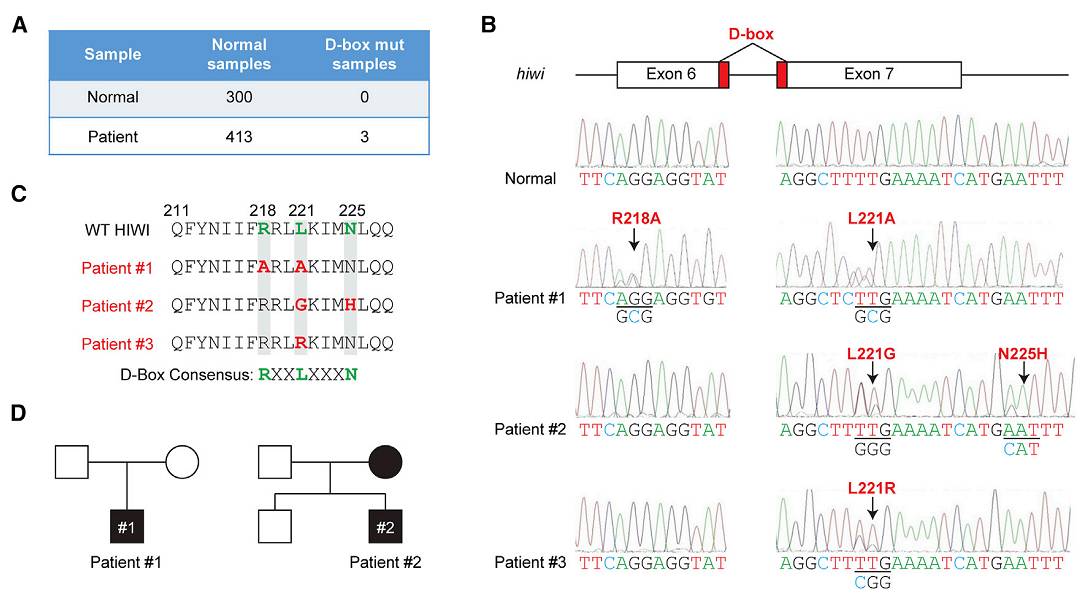
图为测序检测到的
3例无精症患者身上存在
Piwi
D-Box突变
为了进一步验证确实是
Piwi
D-Box突变是否确实可以导致的男性不育症的发生,那么接下来就很有必要构建条件性
Piwi
D-Box突变knock-in小鼠模型,小鼠模型显示
条件性
Piwi
D-Box
knock-in
突变后,小鼠出现雄性不育、精子形态异常以及细胞核结构疏松(
下图
)
。随后通过质谱检测发现,条件性
Piwi
D-Box
knock-in小鼠
精子中还存在多种蛋白异常表达。
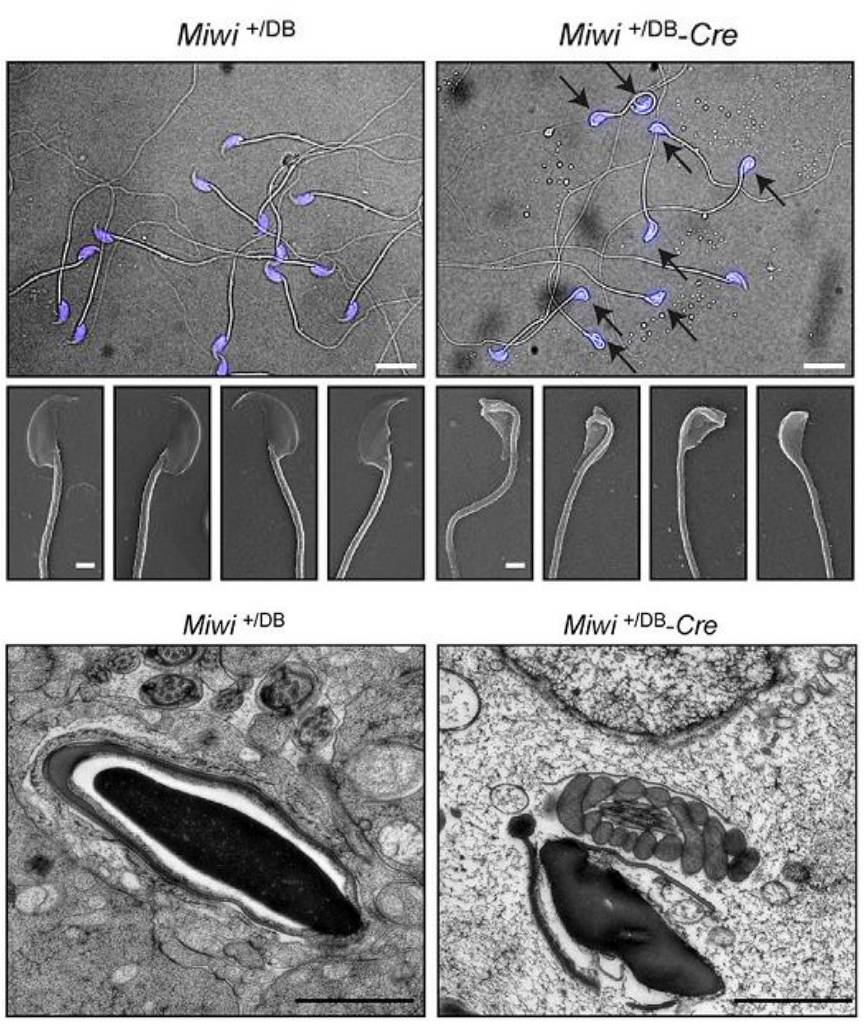
图为正常雄性小鼠精子和
Piwi
D-Box
knock-in小鼠
精子形态上的差异
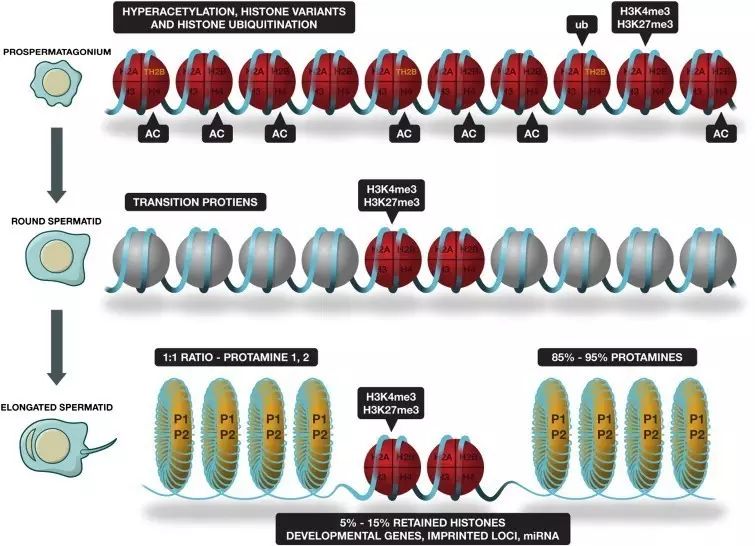
了解精子发育过程的人们应该知道,精子发育在结构特化的过程中会发生“
组蛋白-鱼精蛋白转换(Histone-to-Protamine exchange)
”(
下图
)。
2010年,
Dev Cell
杂志报道了RNF8介导的组蛋白泛素化启动了精子变形过程中的
“
组蛋白-鱼精蛋白转换
”(
下图
)。

有了上述研究背景,作者马上就想到检测小鼠精子中组蛋白泛素化修饰是否发生了变化。果然,
条件性
Piwi
D-Box
knock-in小鼠的后期
精子细胞中组蛋白泛素化水平显著下降(
下图
)。

Piwi
D-Box
knock-in小鼠
精子中组蛋白H2B泛素化水平大幅下降
然而上述这个过程中的分子机制又是什么呢?随后的生化实验表明,MIWI(PIWI)可以与RNF8相互作用,抑制了RNF8入核泛素化组蛋白。
Piwi
D-Box突变不仅导致MIWI突变体蛋白在细胞质中的累积,而且抑制了RNF8泛素连接酶入核,从而影响精子发生过程中组蛋白的泛素化以及进一步的“
组蛋白-鱼精蛋白替换
”过程
。
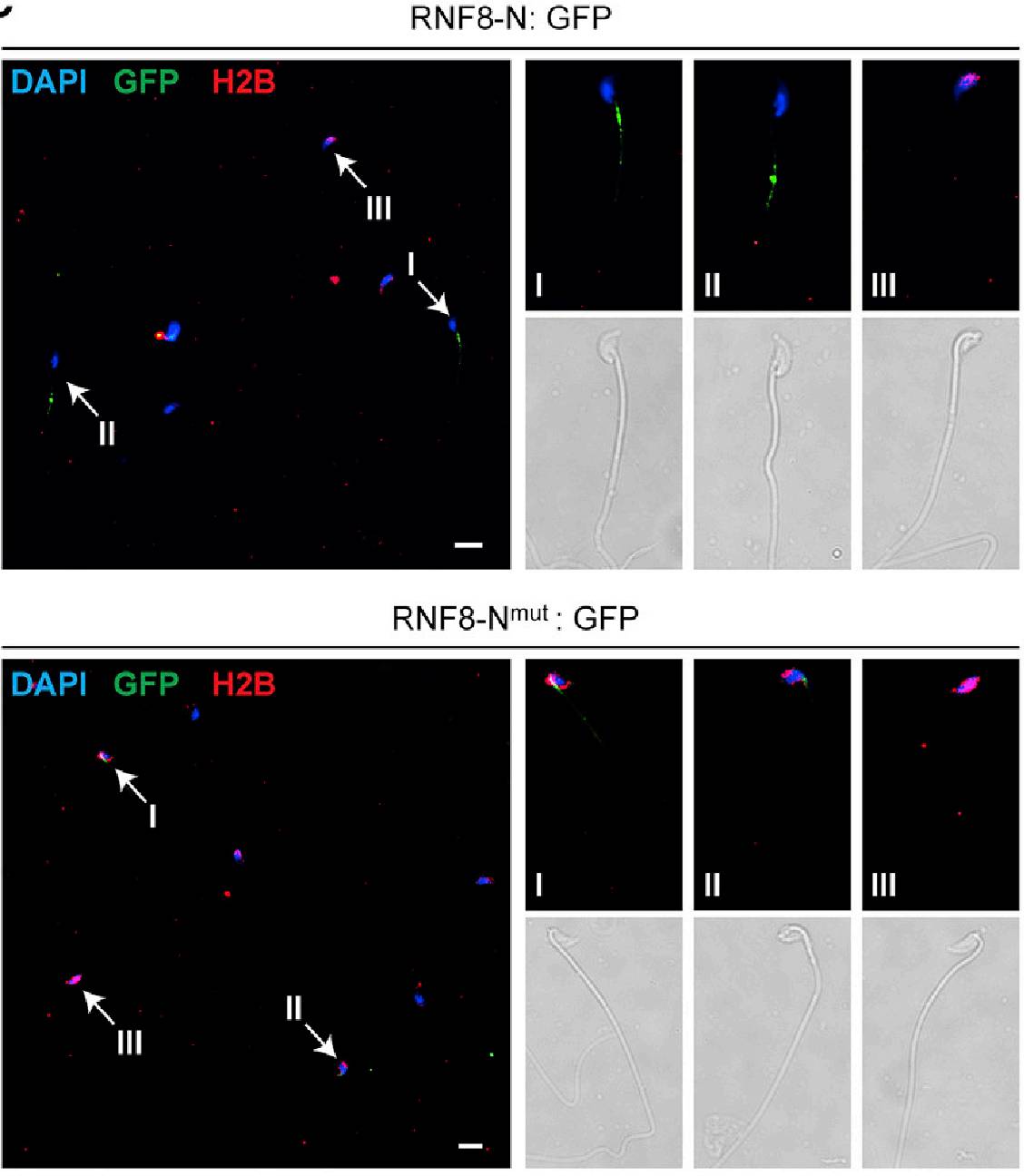
进一步实验表明RNF8-N(N端1-210aa)足以竞争RNF8全长蛋白和MIWI的结合作用。
好玩的是,在
Piwi
D-Box突变的精子中过表达
RNF8-N可以rescue精子的活力
(
下图
)。
总的来说,这项研究的重要意义在于首次发现人类
Piwi
基因突变可导致男性不育,深入揭示了其致病机理,并为相关男性不育症的精准医疗提供了理论基础和方法策略。
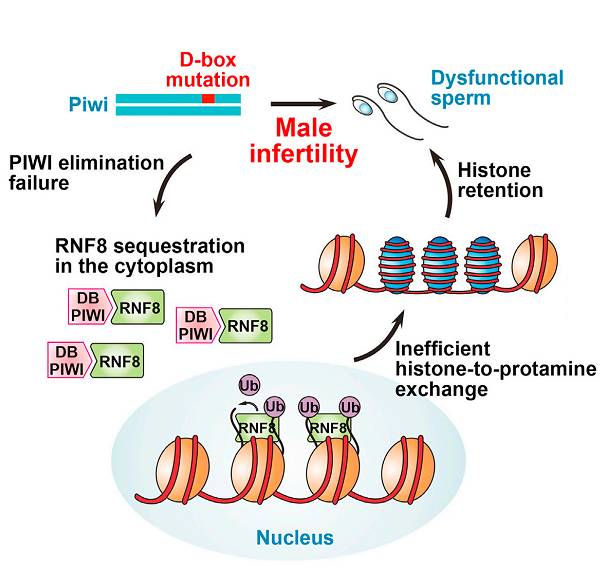
工作模型
专家点评:
陈大华
(中科院动物所研究员,国家“杰青”,中国科学院大学教授,“长江学者”)

Comments
:
模式动物(如果蝇和小鼠)的研究表明,Piwi家族蛋白在调控piRNA的生物发生、转座子沉默以及生殖细胞的发育发挥重要作用。刘默芳研究组前期工作(
Dev Cell
, 2013)发现生殖细胞中MIWI蛋白的稳定性,通过其D-box受到APC/C复合物的严格调控。该研究在前期工作基础上,通过对男性先天无精症患者的筛查以及动物模型的分析,意外的发现了PIWI蛋白的新功能:D-box突变不仅导致MIWI突变体蛋白在细胞质中的累积,而且抑制了RNF8泛素连接酶入核,从而影响精子发生过程中组蛋白的泛素化以及进一步的组蛋白-鱼精蛋白的替换过程。有趣的是,通过抑制MIWI与RNF8之间的结合可以挽救这一突变精子的活力。
该项研究不仅诠释了PIWI蛋白在调控精子发生中的新机制,同时也为HIWI突变-相关男性不育临床治疗提供了新思路





