责编 | 酶美
Hippo信号通路在生物个体发育特别是组织器官大小和稳态调控过程中具有关键功能,同时在肿瘤发生及免疫应答过程中发挥十分重要的作用【1-5】。在哺乳动物中,该通路主要是由MST1/2激酶(果蝇Hippo激酶的同源蛋白)和LATS1/2激酶在接头分子SAV1和MOB1的辅助下形成激酶级联反应,磷酸化该通路中发挥关键效应的转录激活子YAP或TAZ,使其滞留在细胞质中,进而发生降解。而Hippo信号一旦缺失,YAP/TAZ磷酸化水平下降并进入细胞核。虽然YAP/TAZ本身并无DNA结合能力,但其入核之后可与TEAD家族转录因子结合形成复合物,从而调控Hippo通路下游靶基因转录,最终促进细胞增殖,抑制凋亡。
研究表明,YAP/TAZ在多种恶性肿瘤中处于过度活化状态【6-9】。中科院分子细胞卓越中心周兆才团队较早研究了Hippo通路的核内调控,探究了其在胃肠道肿瘤发生过程中的病理作用,发现了YAP拮抗蛋白VGLL4以及激活蛋白IRF3等调控肿瘤发生发展的功能与机制,并设计发展了靶向抗癌的治疗性多肽及小分子化合物(Cancer Cell 2014; Cell Research 2014; Nature Communications 2017; The Journal of Experimental Medicine 2018)。近年来,该团队聚焦Hippo通路上游,围绕Hippo所在的MST激酶家族展开了一系列研究,发现了MST4调控巨噬细胞介导炎症反应的功能机制(Nature Immunology 2015; Journal of Biological Chemistry 2018; Cell Discovery 2019)。在此基础上,他们进一步探究了MST4激酶调控Hippo信号通路影响胃癌发生发展的功能机制。
2020年4月9日,中科院(生化细胞所)分子细胞卓越中心周兆才团队与同济大学附属上海市第十人民医院徐辉雄团队合作,在The Journal of Experimental Medicine在线发表题为 MST4 Kinase Suppresses Gastric Tumorigenesis by Limiting YAP activation via a Non-canonical Pathway 的论文,发现了MST4激酶直接磷酸化YAP形成一条非经典Hippo信号转导轴,阐释了其与经典Hippo通路之间响应信号刺激的内在联系,并进一步揭示了其调控胃癌的病理功能与机制,为探索胃癌的病变机理以及相关药物筛选和诊疗策略研发提供基础。
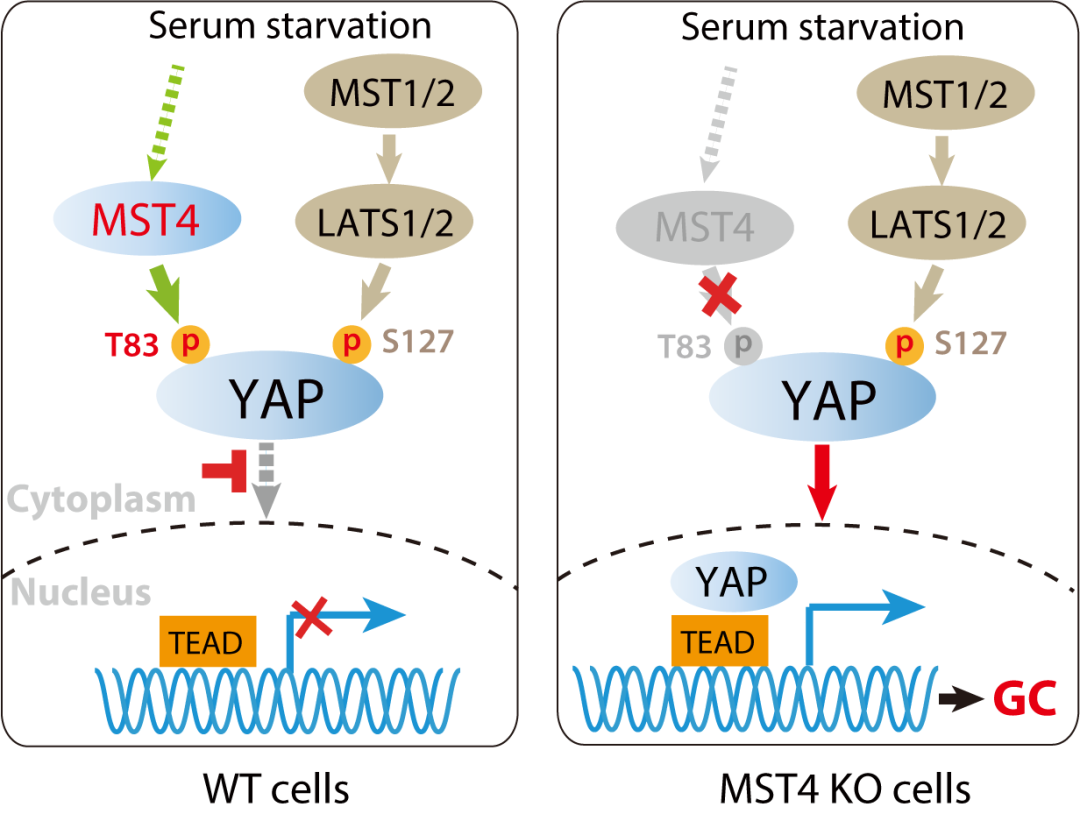
在该项工作中,研究人员首先发现MST4激酶(由STK26基因编码)可以响应不同信号刺激,依赖于其激酶活性而抑制YAP入核活化。进一步的分子机制研究表明,MST4能够直接结合YAP并磷酸化其第83位苏氨酸 (T83),而T83磷酸化可以显著抑制YAP与importin α介导的入核复合物结合,最终导致其在细胞质内聚集。有趣的是,MST4激酶与YAP的经典激酶LATS1/2激酶在体外可以互不干扰地磷酸化YAP。而在细胞和体内,两者则共同响应上游信号刺激,通过磷酸化YAP不同位点协同抑制YAP活化。与之相应的是,模拟MST4介导的YAP磷酸化(T83E突变)仍然能够抑制模拟经典Hippo信号缺失而引起的YAP过度活化及促癌活性(S127A突变)。最后,研究人员分析了MST4-YAP这一信号轴与胃癌的临床相关性,发现MST4的表达水平和YAP的T83磷酸化水平在胃癌组织中显著下降,且与病人不良预后相关。与此一致,在小鼠中敲除MST4则显著促进了MNNG诱导的胃癌造模。综上,这项工作定义了MST4-YAP这样一条不同于经典Hippo通路的信号轴,有助于理解YAP在病理条件下过度活化与多重调控的复杂性,也为针对胃癌的诊疗提供新的思路。
据悉,中科院分子细胞科学卓越创新中心周兆才研究员、焦石副研究员,以及同济大学癌症中心(附属第十人民医院)徐辉雄教授为本文共同通讯作者。联合团队副研究员安利伟、研究生聂平平和博士后陈敏为本文共同第一作者。
周兆才实验室(现已加盟复旦大学生命科学院)长期致力于研究胃肠道肿瘤发生及其免疫应答的分子细胞信号机制,近期代表性工作发表在Cancer Cell、Nature Immunology、Journal of Experimental Medicine、Nature Communications、EMBO Journal、Cell Research等国际学术期刊,并申请多项发明专利。基于前期已发表工作和已积累的未发表数据,现拟聘副研究员和博士后数名,从细胞互作、信号通路及分子结构等角度深入研究胃肠道肿瘤的细胞起源、演进规律、免疫调控等。候选人应具备良好的逻辑思维和实验操作能力,拥有肿瘤学、免疫学、发育生物学或结构生物学相关博士学位。本实验室已培养了包括国家优青和上海市浦江人才等多名优秀青年人才,未来仍将继续竭诚为团队成员提供最佳科研环境与职业发展晋升平台,同时提供具有竞争力的优厚薪资待遇。有意应聘者请联系[email protected]。
原文链接:
https://rupress.org/jem/article/217/6/e20191817/151647/MST4-kinase-suppresses-gastric-tumorigenesis-by?searchresult=1
1. Harvey, K.F., X. Zhang, and D.M. Thomas, The Hippo pathway and human cancer. Nat Rev Cancer, 2013. 13(4): p. 246-57.2. Park, H.W. and K.L. Guan, Regulation of the Hippo pathway and implications for anticancer drug development. Trends Pharmacol Sci, 2013. 34(10): p. 581-9.3. Liu-Chittenden, Y., et al., Genetic and pharmacological disruption of the TEAD-YAP complex suppresses the oncogenic activity of YAP. Genes Dev, 2012. 26(12): p. 1300-5.4. Hong, L., et al., Role of Hippo signaling in regulating immunity. Cell Mol Immunol, 2018. 15(12): p. 1003-1009.5. Onuora, S., Immunology: Hippo signalling influences T cell fate. Nat Rev Rheumatol, 2017. 13(7): p. 389.6. Varelas, X., et al., The Hippo pathway regulates Wnt/beta-catenin signaling. Dev Cell, 2010. 18(4): p. 579-91.7. Imajo, M., et al., A molecular mechanism that links Hippo signalling to the inhibition of Wnt/beta-catenin signalling. EMBO J, 2012. 31(5): p. 1109-22.8. Heallen, T., et al., Hippo pathway inhibits Wnt signaling to restrain cardiomyocyte proliferation and heart size. Science, 2011. 332(6028): p. 458-61.9. Azzolin, L., et al., Role of TAZ as mediator of Wnt signaling. Cell, 2012. 151(7): p. 1443-56.














