高危神经母细胞瘤是幼儿及青少年中高发型恶性疾病,为胚胎性肿瘤,其表面高度表达神经节苷脂GD2,故GD2成为此类恶疾的治疗靶标。在过去30十年中,GD2靶向药物用于神经母细胞瘤的治疗研究取得了巨大进展,其安全性和有效性得到了充分验证。
但是直到2015年,才诞生第一个GD2靶向药物。该年抗GD2抗体Dinutuximab(ch14.18)先后获得美国FDA和 欧洲药品管理局(EMA)的批准,与粒细胞-巨噬细胞集落刺激因子(GM-CSF)、白介素-2 (IL-2)和异维甲酸联用,治疗1~17岁神经母细胞瘤患儿,给此高危性肿瘤的治疗带来了新的希望。
抗GD2疗法作为早期的肿瘤免疫疗法的探索,在30年多年的研究过程中,历经坎坷,最后以Dinutuximab(ch14.18)抗体的成功上市取得阶段性胜利。而Dinutuximab作为抗
GD2疗法的缩影,
从最初的抗体筛选、工艺开发、临床设计以及上市后的供应链管理,可以说经历了所有抗体药物在开发中所能遇到的种种困难,即使在2017年5月Dinutuximab因为产能有限的问题在欧盟惨遭退市,回顾其研发之路对于其它药物的研发仍然值得借鉴。
神经母细胞瘤是自主神经系统的一种胚胎性肿瘤,由原始神经嵴细胞衍化而来,交感神经链和肾上腺髓质是其最常见的原发部位。因为组织的快速发育,神经母细胞瘤通常发生于幼儿及青少年时期,占所有儿科癌症病例的7%左右,而美国每年约有650例左右的其新增病例。神经母细胞瘤病例的90%是在5岁左右确诊,中位确诊时间为19个月左右。由于70%的患者在确诊时肿瘤已发生转移,因此神经母细胞瘤被归类为高危性疾病,仅40%~50%的患者可以达到5年的生存期。
神经母细胞瘤预后差异大,手术、化疗和放疗仍为神经母细胞瘤的3大主要治疗手段。在神经母细胞瘤的治疗中,一般对局限性肿瘤先进行手术切除,再化疗;而预计手术不能切除者,则应在确诊后采用先化疗、后手术、再化疗或加放疗的策略。其主流化疗方案主要可分为3类:(1)使用多剂量的顺铂、依托泊苷、环磷酰胺和长春新碱等药物,进行密集化疗,实施缓解性治疗;
(2)
自体造血干细胞移植联合传统化疗,进一步巩固缓解性治疗的疗效;
(3)
造血干细胞移植后的维持治疗阶段,使用异维甲酸等药物,进一步有效减少肿瘤的复发。
2015年
Dinutuximab(ch14.18)抗体被批准
以前,只有三种化疗药物被FDA批准用于神经母细胞瘤的治疗,它们分别是:
-
环磷酰胺,1959年11月16日获得批准
-
长春新碱,1987年7月17日获得批准
-
多柔比星,1987年12月23日获得批准
在近30年的时间里,FDA没有批准过任何用于神经母细胞瘤的新药。
Dinutuximab
的获批表明其疗效得到广泛认可,是神经母细胞瘤治疗的重大突破。
糖链不仅仅是生命体内的结构物质,同时也对细胞间及细胞内的信号传导起着重要作用,而糖基化的异常表达通常是肿瘤细胞转化的标志,某些肿瘤的糖基抗原被认为与肿瘤细胞的增殖、入侵、血管生成和转移紧密相关。1942年,德国生化学家Ernst Klenk从神经节细胞中分离得到一种富含糖链的糖脂化合物,随后被命名为神经节苷脂(Klenk, Hoppe-Seyler’s Zeitschrift für physiologische Chemie, 1942年)。
神经节苷脂GD2属b-series神经节苷脂,含有两个唾液酸单位,在细胞黏附和识别相关的信号转导中起重要作用。GD2是神经母细胞瘤表面过量表达的一种糖基抗原,存在于超过99%的神母细胞中。除了神经母细胞瘤,GD2还在黑色素瘤、小细胞肝癌、骨肉瘤和软组织肿瘤中异常表达。
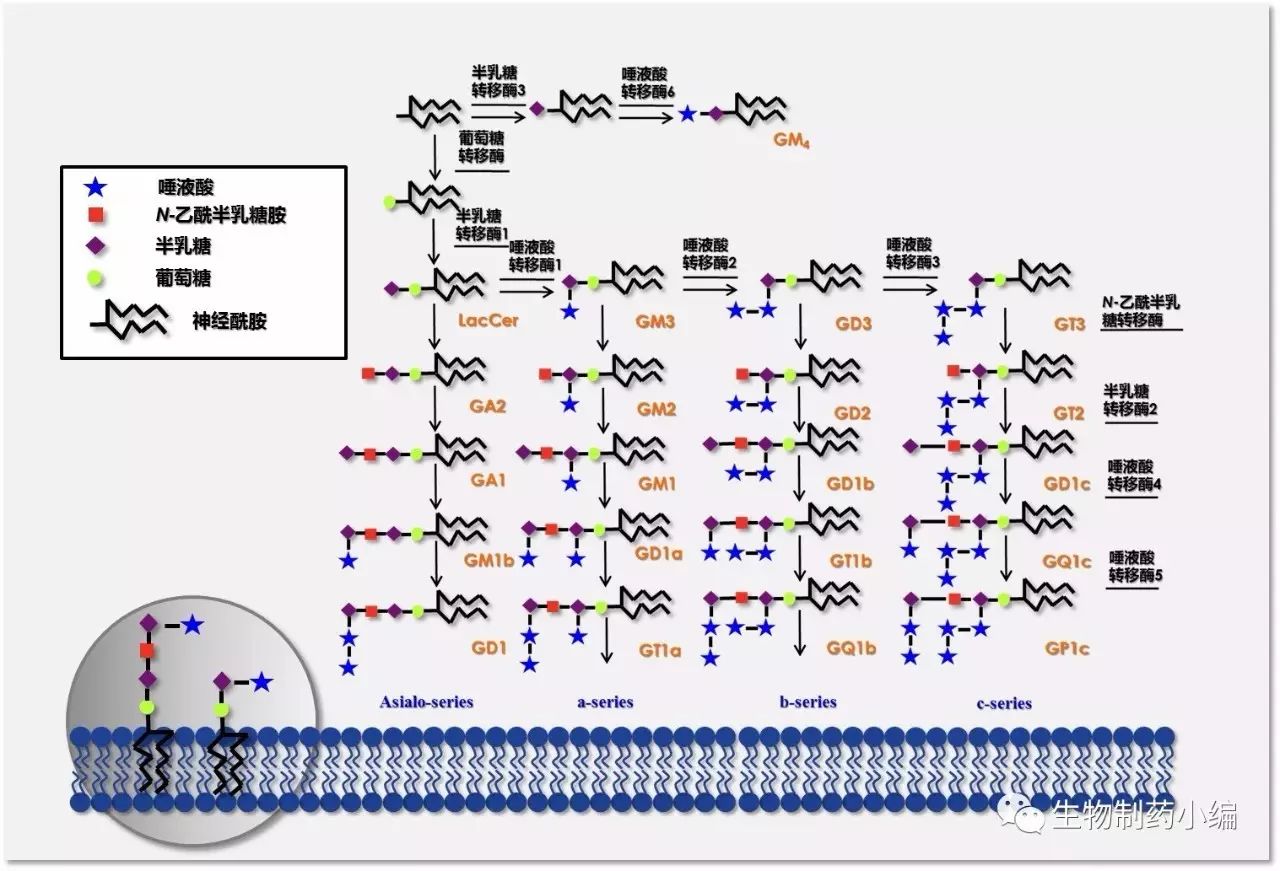
基于对神经节苷脂GD2结构与功能的深入研究,人们认识到,抗GD2抗体疗法可能对神经母细胞瘤具有一定的治疗作用。然而,抗GD2抗体要发挥抗肿瘤作用,首先即面临着两个巨大的挑战:(1)通常高亲和性的抗体依赖Fc受体介导的作用,以杀伤癌细胞,但是对糖链的免疫应答通常缺少T细胞的介入。因此,作用于糖链类抗原产生的抗体多为低亲和力的IgM抗体,而IgM的高分子质量,通常更难以侵入肿瘤细胞中,所以抗肿瘤疗效并不理想;(2)血脑屏障的存在,又会阻止静脉注射的抗GD2抗体进入中枢神经系统,并可能对GD2低表达的外周神经细胞和黑色素生成细胞造成不良反应 。
不过,即使存在以上挑战,在过去的30年中,以Dinutuximab单抗为代表的抗GD2抗体疗法在坎坷中不断发展,使高危性神经母细胞瘤的治疗研究进入新阶段
1985年,美国斯隆癌症中心的Nai-Kong Cheung教授率先研制出3F8抗体,是首个用于治疗神经母细胞瘤而进入临床试验阶段的抗GD2抗体。最早其形式为鼠源性IgG3抗体,与GD2的亲和力最高可达到5 nmol • L-1。临床前研究表明,3F8可通过与淋巴细胞、粒细胞及Fcγ受体的有效结合,进一步通过补体依赖性细胞毒效应(CDC)和抗体依赖性细胞介导的细胞毒效应(ADCC),对神经母细胞瘤产生剂量依赖性杀伤作用。但是,在随后用于治疗4期神经母细胞瘤的Ⅰ/Ⅱ期临床试验中,3F8却并没有显现明显的抗肿瘤作用,仅致显微骨髓疾病产生一定应答率。而与GM-CSF联用时,3F8则可致对化疗产生耐药性并转移至骨髓的神经母细胞瘤呈现80%的完全应答率,但是疼痛、高血压、发热和荨麻疹等急性不良反应极大地限制了其最大耐受剂量。为了减少这些不良反应,人们开发了一种热处理3F8的新的治疗策略,这样,在外周神经系统中,3F8因缺少Fc效应功能而仅仅保留了阻断剂的功能。Ⅰ期临床试验结果表明,这种治疗策略,可以有效减少用于疼痛控制的止痛剂用量。虽然后期对
3F8抗体的不同形式(
hu3F8,
131
I-3F8
和
124
I-3F8
)陆续进行了多项试验,但其临床结果仍然不够理想。

Nai-Kong Cheung
教授
但是Cheung 教授并没有停下脚步,2001 年,Cheung 教授和他的团队将人的神经母细胞瘤免疫小鼠,在经过一系列处理后获得了 一株新的8H9 单抗,他们通过免疫组化方法,对 330 份不同类型肿瘤样本、15 份正常人组织样本进行了测试 。测试的结果十分理想,87%(286 份) 的肿瘤样本与 8H9 单抗发生反应,其中,97%(87/97)的神经母细胞瘤样本对 8H9 单抗产生反应。而在正常组织中,除了胰腺、胃、肝和肾上腺皮质中能与 8H9 单抗发生非特异性结合外,其他组织,尤其是包括额叶、脊髓、脑桥和小脑在内的脑组织,对 8H9 单抗均不反应。
经过一系列分析后,他们发现,8H9 单抗所针对的似乎是一种新的肿瘤相关抗原,并且这种抗原在正常组织上的分布是有限的。只是,那时候,他们并不知道 8H9 单抗的靶向抗原是什么。即便如此,也不能阻止 MSK 肿瘤专家们对改进疗法研究的脚步,他们迫切希望将这一极具潜力的抗体,给那些绝望的神经母细胞瘤患者进行治疗。
2003 年 7 月具有转折性的历史时刻来临了,他们开始对来 MSK 就诊的患者采取 8H9 单抗治疗。 不过,此时,他们给 8H9 单抗做了改造,让它带有放射性同位素 131I。之所以用 131I 标记,是因为基于3F8抗体研究中发现,神经母细胞瘤对 131I 放射很敏感 。其中,接受 8H9 单抗治疗的首位女性患者,是一位勇敢的小姑娘 Emily Wang。2003 年 6 月底,这个不到 2 周岁的小姑娘出现了连续两周的低烧、腹痛。没有人会想到她将经历什么,经过多次检查后,最终被确诊为神经母细胞瘤。得知这个结果的家人悲痛万分,为了挽回这个幼小的生命,最终她被送到 MSK 就诊。 在这里,Emily 接受了包括手术、放疗、化疗、干细胞移植在内的一系列治疗,最终在经过两轮的 8H9 单抗治疗后,Emily 又重新变成了一个活泼、开朗、健康的小姑娘。她的妈妈很欣慰地说:“Emily 是我们的希望,教会了我们生活的真谛:生活有时候真的会否极泰来!”
2009 年,Cheung 教授团队终于解开了心中的谜团。原来 8H9 单抗之所以会如此有效,是因为它靶向的是一种特殊的抗原 4Ig-B7H3。这是一种广泛分布在儿童和成人实体瘤细胞膜上的糖蛋白,能够抑制自然杀伤细胞和 T 细胞的功能;并且,与正常人体组织相比,它更优先在肿瘤细胞中表达
。
8H9 单抗
疗法的精彩之处,就在于它采用鞘内注射,不经过血脑屏障直接把 131I 标记的抗体递送到颅腔中。这样,抗体结合在肿瘤细胞表面,一方面可以使自然杀伤细胞和 T 细胞重新发挥清除肿瘤细胞的功能,另一方面,还可以在原位对肿瘤细胞放射,不会损伤正常的脑组织。可以说是一举两得——既能增加抗体疗效,又能降低放射的副作用。这对儿童患者来说极其重要。因为常规的疗法,尤其是外照射放疗,可能会导致幼儿学习障碍和发育迟缓。
在开展临床研究的过程中,还发生了感人的一幕。2007 年,一群患儿家长问 Cheung 教授,他们可以为孩子们做些什么。Cheung 教授告诉他们,研究资金严重不足,而想要获得更好的疗法,只有通过更多的研究才能实现。于是,他们成立了一个名为 Band of Parents 的非营利性组织,专门资助神经母细胞瘤的新疗法。
2014 年 Cheung 教授及其团队取得了相关专利,
随后8H9 单抗被命名为Burtomab,
并于 2015 年 10 月 14 日将其授权给 Y -mAbs Therapeutics 公司。 YmAbs是一家临床阶段生物制药公司,专注于通过免疫学开发新的癌症治疗方案。此外,YmAbs利用其平台技术产生靶向GD2和B7H3的下一代人源化强亲和力双特异性抗体。
2017年6月,在经过 14 年临床研究后,终于获得了美国 FDA“突破性疗法”认证 ,该药在治疗转移至中枢神经系统的神经母细胞瘤方面,迈出了实质性的一大步。
目前,Burtomab 还在进行临床 II 期试验,也在招募志愿者。希望这款药物能够尽快完成临床试验早日上市,给更多神经母细胞瘤患儿带来福音!
与
3F8同期研发的
ME36.1是另一株尚处早期研究阶段的鼠源性IgG3抗体,对GD2的亲和力低于3F8,为77 nmol • L-1,但其不仅可以结合GD2,对GD3也具有部分亲和性。临床前研究表明,ME36.1的IgG2a亚型变体不仅对抗原的亲和力没有降低,同样也具有一定的抗肿瘤活性。但此后,对ME36.1的研究一直停滞不前,直到近年来基于它而开发的双特异性抗体,才又让它进入人们的视野。
1984年,在MIT做博士后期间,stephen gillies也开发出一款靶向GD2的鼠源性单抗14G2a,其对GD2亲和力介于3F8和ME36.1之间,为19 nmol • L-1。和3F8一样,14G2a在用于神经外胚层肿瘤的临床试验中,所表现出的抗肿瘤活性较为有限,而疼痛、发热和荨麻疹等严重的急性不良反应却极为明显。但与IL-2联用时,14G2a则显示出较为明显的临床疗效,推测这可能是由于IL-2有效地提高了14G2a介导的ADCC效应。
基于此推测,1989开发出人鼠嵌合型抗体ch14.18,以进一步减少抗体的免疫原性,提高其有效性。Simon等首先报道了ch14.18单独用于婴幼儿4期神经母细胞瘤患者的治疗效果:与12个月的口服化学药物维持治疗相比,对于小于1岁的患儿,两个月1次的ch14.18治疗,无论在无进展生存期还是总生存期方面,都没有显示出统计学上的显著性改善,但在大于1岁的患儿中,ch14.18治疗组患儿达到3年总生存期的比例却高于对照组(P=0.018)。
为了进一步提高ch14.18的治疗效率,研究人员将更多的细胞因子与ch14.18联用,以期提高肿瘤免疫效应。在加州大学圣地亚哥分校的陈铃津(Alice Yu)教授的领导下,美国儿童肿瘤协作组(Children’s Oncology Group,COG)主导的ch14.18与GM-CSF、IL-2和异维甲酸联用治疗神经母细胞瘤的一项Ⅰ期临床试验中,对招募的25名患儿进行了给药剂量和给药方式的初步研究,确定了ch14.18和IL-2的最大耐受剂量分别为25 mg • m-2 • d-1和4.5×106 U • m-2。

陈铃津(Alice Yu)教授
但此时由于神经母细胞瘤的病例少(美国每年只有约700个新发病例),药品的潜在市场规模也小。尽管临床一期和二期试验得到了乐观的结果,参与试验的Brunswick、Damon、Repligen、Abbott等药厂都在试验结束后决定不再生产抗体,使试验陷入僵局。为度过危机,陈铃津教授在1996年跑到华盛顿寻求帮助,最后在美国国家癌症研究所的支持下,由其下属的生物制药机构制备了Ch14.18抗体,临床三期试验才得以进行。
时隔七年后,2001年,COG终于得以继续开展
ch14.18的关键
Ⅲ期临床试验
ANBL0032,确认了
ch14.18与IL-2
联合治疗的有效性:在226名神经母细胞瘤高危患者中,标准治疗组(6个周期的异维甲酸治疗)和免疫治疗组(6个周期的异维甲酸治疗联合5个ch14.18相关的免疫治疗周期)受试者,两年无进展生存率分别为46%和66%(P=0.0115),总生存率分别为75%和86%(P=0.0116)。这一试验结果表明,以ch14.18为主的免疫治疗方式,可以有效提高高危神经母细胞瘤患者的生存率。
2010年,
Ch14.18结束长达10年的临床三期试验,随后结果在《新英格兰医学杂志》上发表。
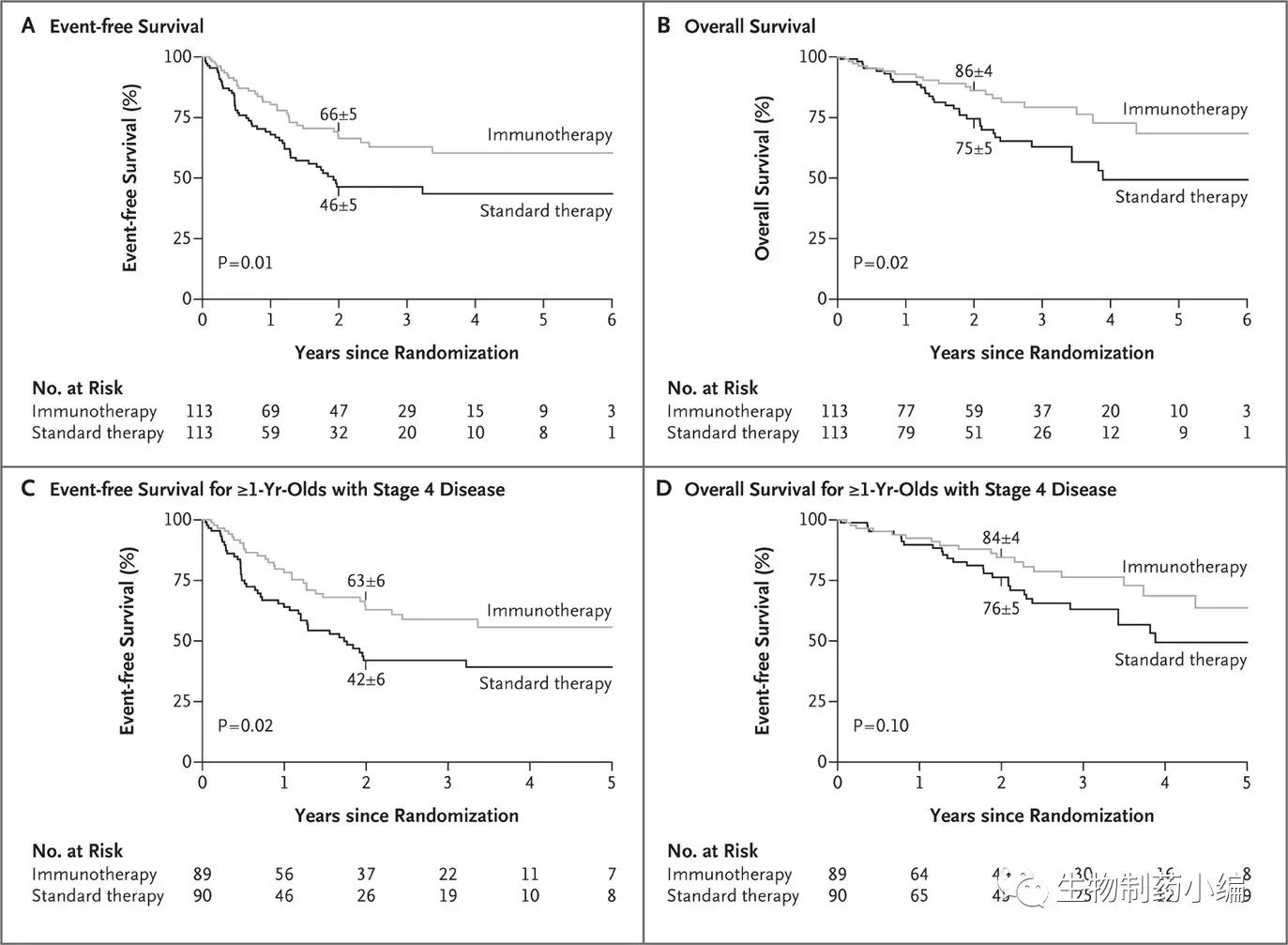
当然,这项试验也存在一些不足:首先,在对主要终点指标进行分析时,仅分析了在自体造血干细胞移植后具有部分响应性的受试患者,并未统计所有受试患者的生存率;其次,由于该试验中止时间较早,所以此疗法的长期有效性和安全性未能得到有效考察;第三,ch14.18在该试验中所用剂量为25 mg • m-2 • d-1,不同于最终FDA批准的剂量17.5 mg • m-2 • d-1;最后,与IL-2和GM-CSF的交替使用,很难确定Dinutuximab单独使用的疗效。
即便如此,这仍是首个显示抗癌抗体和促进ADCC效应的细胞因子联用可成为一种有效肿瘤治疗方式的临床试验,同时也是首个非蛋白类靶点被印证可用作抗癌靶点;而且,与标准疗法相比,以ch14.18为主的免疫疗法将神经母细胞瘤患者的两年无进展生存率提高了20%,这也推动了ch14.18更广泛地应用于儿童高危性神经母细胞瘤的治疗,以实现疾病快速缓解,并避免其复发。正是基于这项关键性Ⅲ期临床试验的良好数据,Dinutuximab单抗在2015年被FDA批准用于高危神经母细胞瘤的一线治疗。
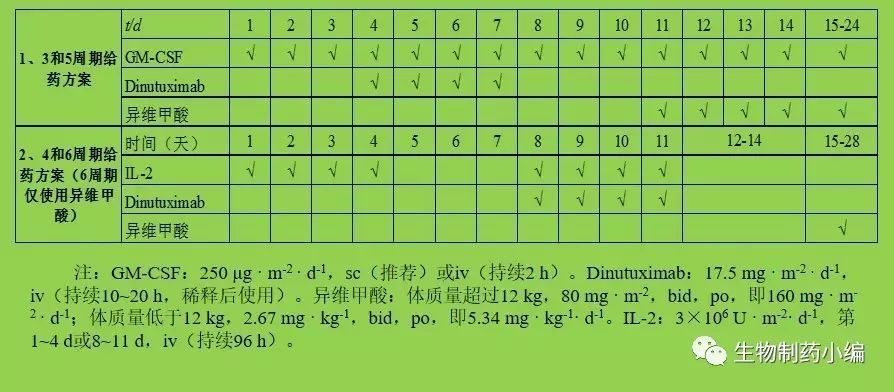
Dinutuximab获批的免疫疗法由6个治疗周期组成,神经母细胞瘤患者在第1、3、5周期,以Dinutuximab与GM-CSF及异维甲酸联用治疗,而在第2、4周期,则以Dinutuximab与IL-2联用治疗,到第6个周期时,使用异维甲酸治疗。
从1984年第一代
鼠源GD2抗体开发,到
2015年Ch14.18的成功上市,GD2的疗法与多位科学家的共同努力密不可分:
-
1977年,Robert C Seeger建立两种新的神经母细胞瘤细胞,为神经母细胞瘤的研发打下基础
-
1984年,第一代鼠源GD2抗体被研制出来
-
1989年,GD2的人鼠契合抗体Ch14.18被研制出来
-
1991年,分别由陈铃津和Handgretinger领导的Ch14.18临床一期试验在美国的UCSD和德国Tubingen开始进行
-
1992年,UCSD开始对Ch14.18和粒细胞–巨噬细胞集落刺激因子(GM–CSF)的联合使用进行试点研究
-
1994年,Ch14.18和GM–CSF联合使用的临床二期试验开始进行
-
2001年,Ch14.18、GM–CSF和白细胞介素2的关键
三期
临床试验
ANBL0032
开始,有226个患者参与。该试验的结果后来被FDA采纳,作为Ch14.18的临床数据
-
2009年,105名参与者进行了Ch14.18的药物毒性试验
-
2010年,作为神经母细胞瘤的孤儿药,Ch14.18获得了FDA的优先审批资格
-
2010年,
NCI
从15家企业中选择United Therapeutics公司,签订合作协议,由其进行后期的申报及商业运作
-
2010年9月,Ch14.18的临床三期试验结果在《新英格兰医学杂志》(The New England Journal of Medicine)发表
-
2011年1月,FDA表示认可Ch14.18临床三期试验结论,即联合使用Ch14.18和GM–CSF、IL–2以及维甲酸,对于标准治疗后有微小残留病变的高危神经母细胞瘤患者安全有效
-
2014年12月,由于在当时的制造批次中发现药物的细胞毒性有所增加,FDA延长了Ch14.18的审查期
-
2015年3月,Ch14.18获得FDA批准用于高危神经母细胞瘤的一线治疗。同年4月,Ch14.18被欧洲药品管理局批准用于高危神经母细胞瘤治疗,8月获得了欧盟委员会批准
-
2016年,美国国家癌症研究所获得了美国联邦实验室技术转化联盟的年度杰出奖,以表彰其在Ch14.18临床试验中的贡献
截至2015年7月31日,共有1554名神经母细胞瘤患者参与了Ch14.18的临床试验和治疗,部分参与者已经生存超过了十年。
由于
高危神经母细胞瘤的主要患者是幼儿及青少年,因此其临床价值和社会效应不可估量。
Ch14.18试点实验中第一个接受治疗的患者Matthew Haemsch,当时接受了Ch14.18和GM–CSF联合用药治疗。他在确诊时神经母细胞瘤的分期为四期,并伴有难治性骨髓转移和肾功能不全。今天,他已经是一个职业高尔夫运动员了。

这是另一个试点试验的参与者,确诊时为四期并伴有骨髓转移。这个孩子现在已经长成了一个健康的大学生。
ch14.18虽然在2015得以得以成功上市,但上市后其质疑和挑战仍然不断
Unituxin的副作用
2015年3月,FDA批准Unituxin用于高危神经母细胞瘤的一线治疗。同时,FDA也提醒医生和患者密切注意Unituxin的副作用:除了可能引起发热和神经疼痛,Unituxin还可能导致严重的输液反应,包括超敏反应、毛细血管渗漏综合征、低血压、败血症、器官感染、腹泻、荨麻疹和缺氧等。

在使用Unituxin的患者中,大约有26%会出现严重的输液反应,特别严重的甚至会危及生命。在输液之前,患者应通过补液或用药来预防可能发生的不良反应。大约2–9%的使用者会出现严重的周围神经疼痛,需要服用鸦片类药物止痛。一旦出现严重的不良反应,医生应立即停药。
一般来说,Unituxin的副作用是可控的,对人体的伤害也是可逆的。在治疗过程中,医护人员还应注意,为减轻并及时应对Unituxin的不良反应,医生、护士和药剂师应严格遵守治疗指南。
Unituxin的联合用药
在神经母细胞瘤的治疗中,Unituxin通常要和IL–2、GM–CSF以及维甲酸联合使用。FDA的批文也明确指出了联合用药的重要性。异维甲酸对神经母细胞瘤的疗效已经得到确认,但IL–2和GM–CSF等细胞因子的作用还不明确。这些细胞因子在理论上可以促进免疫反应,但临床效果还不明显,有时候使用细胞因子甚至会加剧不良反应。
是否需要IL–2?
在美国临床癌症协会(American Society of Clinical Oncology, ASCO)2016年会上,来自神经母细胞瘤研究机构SIOPEN(International Society of Paediatric Oncology Europe Neuroblastoma)的Ladenstein医生公布了在欧洲进行的Ch14.18和IL–2联合治疗的临床三期试验结果。该试验对402名高危神经母细胞瘤患者随机分组,其统计结果表明:相对于单独使用Ch14.18,联合使用IL–2并没有显著提高患者的无病生存率和总体生存率,反而显著加剧了毛细血管渗出和发热等不良反应。一些参与者不得不因此提前终止治疗。Ladenstein认为,联合使用IL–2不会给Ch14.18抗体治疗带来益处,只会进一步加剧药物毒性。
是否需要GM–CSF?
2012年,Nai-Kong Cheung教授在对3F8和GM–CSF联合使用的临床试验结果表明,3F8和GM–CSF联合使用可以提高疗效,尤其是采用皮下注射GM–CSF而不是静脉给药的时候,效果更加明显。陈铃津教授指出,Cheung的试验是一个序贯(sequential cohort)试验,而不是随机分组(randomized)试验,因此其统计结果的说服力还不够强。同时,斯隆癌症中心的Kushner医生已经将3F8和GM–CSF用于治疗复发的神经母细胞瘤。
2017年3月,在新加坡进行的第十一届St.Jude-VIVA儿童肿瘤论坛上,陈铃津教授报告了增强抗体治疗效果的其他方案:
-
增加疗程,延长给药天数,比如将给药天数延长到十天。相关试验正在德国进行。
-
和Lenalidomide联合用药。Lenalidomide是FDA在2005年批准的用于多发性骨髓瘤的药物。美国的儿童肿瘤研究组(Children’s Oncology Group, COG)正在进行Ch14.18和Lenalidomide联合用药的临床一期试验,台湾也有相关研究。
-
和PD–1抗体联用。近年来FDA批准了多种PD–1抗体药物,用于针对黑色素瘤、非小细胞肺癌、霍奇金淋巴瘤、头颈部鳞状细胞癌等的免疫治疗。研究PD–1抗体对于其他癌症的效果是当前的热点
Unituxin的产能和供应链
随着抗体免疫疗法的广泛使用和临床试验数量的增加,Unituxin的供给已经无法满足日益增长的需求,目前有一些国家已经断货。在这次论坛上,不断有医生和研究人员反映,由于Unituxin供应不上,一些临床试验已经被迫中断。陈铃津教授提到,制药公司已开始扩大生产,但需要大概两年的时间才能解决供应不足的问题。
由于没有充分考虑到青少年患者和复发患者需要大剂量用药,生产Unituxin的药厂United Technologies(UTC)低估了市场需求,造成了产能严重不足。目前UTC的应对措施有:
-
优先满足美国和加拿大的需求。
-
暂时停止向澳大利亚和新西兰提供Unituxin,2017年初,澳大利亚的
Unituxin
已经断货。澳大利亚的患者目前主要依靠欧洲药厂EUSA Pharma生产的GD2抗体Dinutuximab beta。
-
2017年3月22日,
与欧洲的监管机构协商,因为产能有限的原因
Unituxin抗体
不得不从欧
盟
退市。
-
建设更多的生物反应器。Unituxin的生产能力将翻倍,但扩建的过程可能需要长达三年。
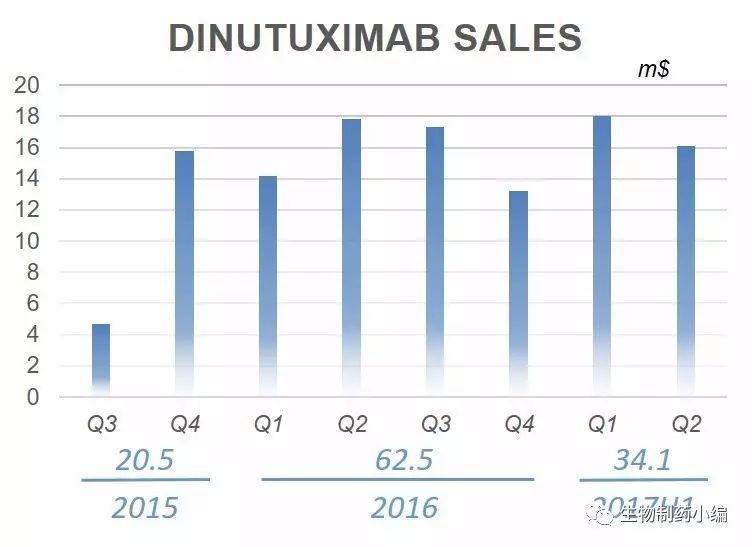
Unituxin产能有限一方面很可能跟United Technologies生产规模有限,另一方面也可能其使用生产细胞株为SP2/0,相比现在常用的CHO细胞,该细胞系表达量更低,同时考虑到前期细胞株可能是NCI构建,应该也比工业平均表达水平更低一下。
United Technologies显然已经意识这个问题,第二代CHO细胞表达的
Unituxin正在超过20国家进行临床试验。
即使Unituxin产能不够稳定
,
作为孤儿药,
Unituxin销售却还算理想,自2015年上市以来,截止到目前累计销售额达到1.17亿美元。值得注意的是,从每个季度的
Unituxin销售情况来看,稳定性还不够,持续增长势头不强。如果后期其产能够有效提升,其销售情况也应该比较乐观了。
不过对于United Technologies,其最大的收获可能并不是Unituxin的销售额。2015年,FDA在批准Unituxin时授予了United Therapeutics一张罕见儿科疾病优先审评券(PRV)。PRV是FDA为了奖励罕见儿科病药物的开发商所颁发的,可用于所有药物的优先评审,可加快药物评审时间1~4个月。同年,United Therapeutics与AbbVie达成一项协议,将手中的PPRV以3.5亿美元的天价出售给艾伯维,创造目前所有PRV交易的最高价格。
虽然以ch14.18为代表的抗GD2抗体已取得了一定的成功,但其在有效性和安全性方面仍然存在一定的挑战。和其他抗体类药物一样,目前抗GD2抗体有效性的提高主要有3种策略:(1)ADC药物的研发:与放射性试剂、毒素及细胞因子偶联,提高抗GD2抗体的杀伤力;(2)双特异性抗体的研发:与抗免疫细胞的抗体组成双特异性抗体,或者对T细胞进行特定的改造,以提高T细胞的肿瘤免疫能力;(3)Car-T 及其他药物的研发:以单链抗体为核心,进行一系列的功能改进,在提高抗体活性的同时,增强其对肿瘤的浸润性。
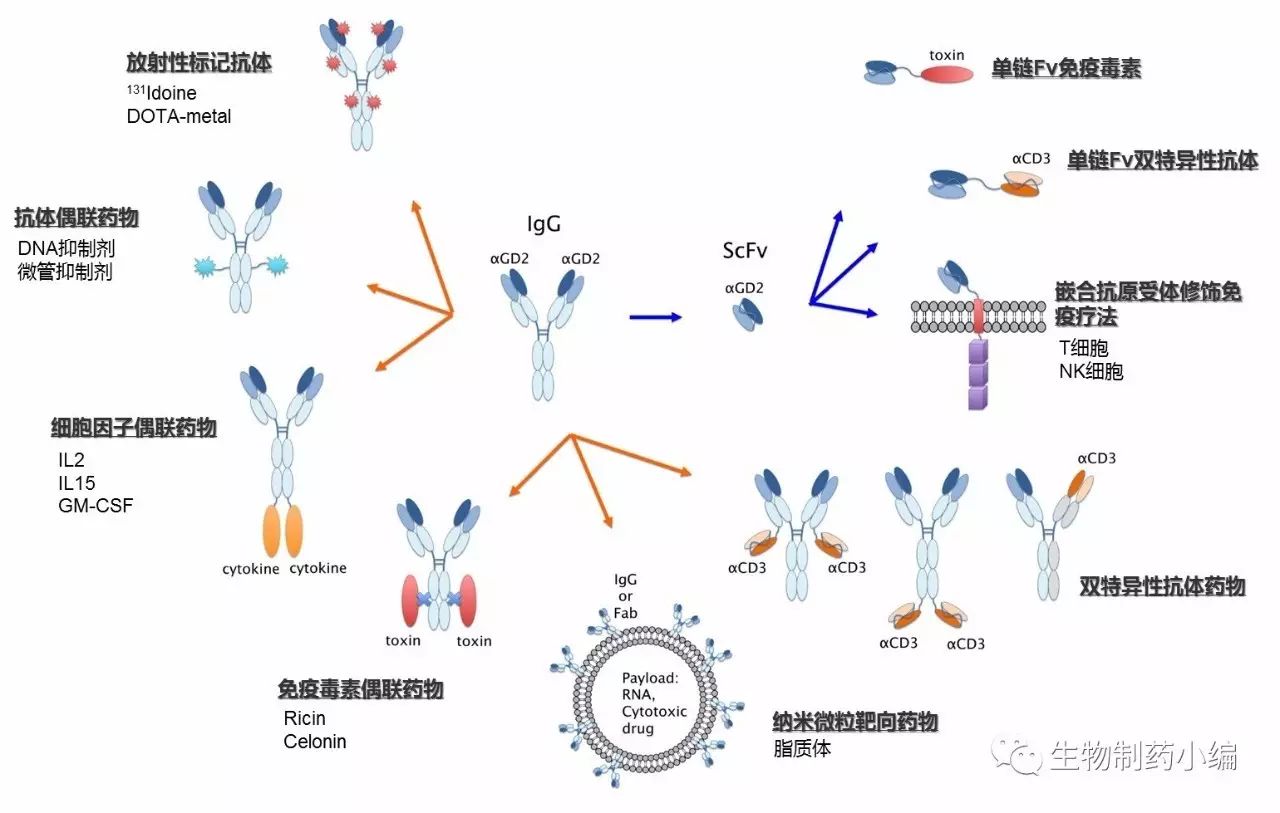
过去的30年中,抗GD2抗体疗法取得了长足进展,特别是Dinutuximab单抗的获批给高危性神经母细胞瘤的治疗带来了新的希望。Dinutuximab单抗的获批至少可以给神经母细胞瘤等儿科疾病治疗药物的研发带来两点启示:
1.创新药物在转化研究过程中离不开关键技术的支撑。Dinutuximab单抗的开发历经30多年,从最早的IgG3鼠源单抗,到最终获批的IgG1嵌合体形式,这些突破来源于人们对抗体结构与功能更深入的认识以及嵌合体抗体制备等关键技术的推动。目前,以CAR-T细胞治疗等新技术开展的疗法也进一步刷新着人们对疾病的认识,可以更大地推动白血病及神经母细胞瘤等儿科疾病的临床治疗。
2.孤儿药或者儿科药物的开发需要多方组织共同的努力。Dinutuximab单抗在长达10多年的临床研究过程中,前期的临床试验均是由美国国家癌症研究所(National Cancer Institute, NCI)等官方组织主导,直到2010年关键临床试验成功后,United Therapeutics公司才和NCI签订合作协议,进行后期的申报及商业运作。孤儿药或者儿科药物由于所面对的患者人数较少,一直都未引起药企的高度重视,其前期的研究通常由NCI等官方组织主导,药企只是在看到药物的临床价值后,才会参与到其后期的开发中。而相信如果在药物的早期研究中,药企即与NCI等研究机构进行合作,发挥各自的优势,相信会极大地加快Dinutuximab等突破性药物的上市,更早地为特定患者带来福音。
同时,必须承认的是当今药物研发的low hanging fruit 已经越来越少,很多药物的研发成本已逾10亿美元,好不容易上市后销售情况其实并不理想。而看到
United Therapeutics今天在
Dinutuximab上的收益,应该让那些当年放弃与
陈铃津教授合作的药企后悔不已。
总体来讲,Dinutuximab单抗的上市只能算是抗GD2疗法的开始,对高危性神经母细胞瘤的治疗还存在诸多挑战。一方面,对GD2与神经母细胞瘤的关系还有待进一步研究,肿瘤细胞对GD2与糖基转移酶相互作用的调节机制仍不明了。另一方面,目前Dinutuximab单抗免疫疗法的疗程还比较复杂,其副作用及不良反应仍不可忽视。因此,仍需从结构和功能上进一步优化抗GD2抗体,进一步提高抗GD2疗法的安全性和有效性。可以相信,随着CAR-T等更多先进治疗技术进入临床,抗GD2疗法将会在高危性神经母细胞瘤的治疗中取得更大进展。
参考文献
1.Engineering anti-GD2 monoclonal antibodies for cancer immunotherapy. FEBS Lett, 2014,588(2): 288-297.
2.GM-CSF enhances 3F8 monoclonal antibody-dependent cellular cytotoxicity against human melanoma and neuroblastoma. Blood , 1989, 73(7): 1936–1941.
3.Monoclonal Antibody 8H9 Targets a Novel Cell Surface Antigen Expressed by a Wide Spectrum of Human Solid Tumors.CANCER RESEARCH,2001, 61(5):4048–4054.
4.Anti-GD2 antibody with GM-CSF, interleukin-2, and isotretinoin for neuroblastoma. N EnglJ Med, 2010, 363(14): 1324-1334.
欢迎加入小编团队成为小编一员
请加 小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]

版权为生物制药小编所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。

坚持原创、坚持专业
欢迎关注
生物制药小编
投稿信箱:[email protected]
小编团队现有15位成员:
Armstrong、医药局外人、Fairy、
Jone、
东胜西牛、Alpharesearcher、MT、百草、
Irene、
彩虹天堂、蛋白工人、At.Zhou、Julia、游方和尚、Grand
欢迎有共同兴趣的朋友加入





