一、
中国版一致性评价的由来
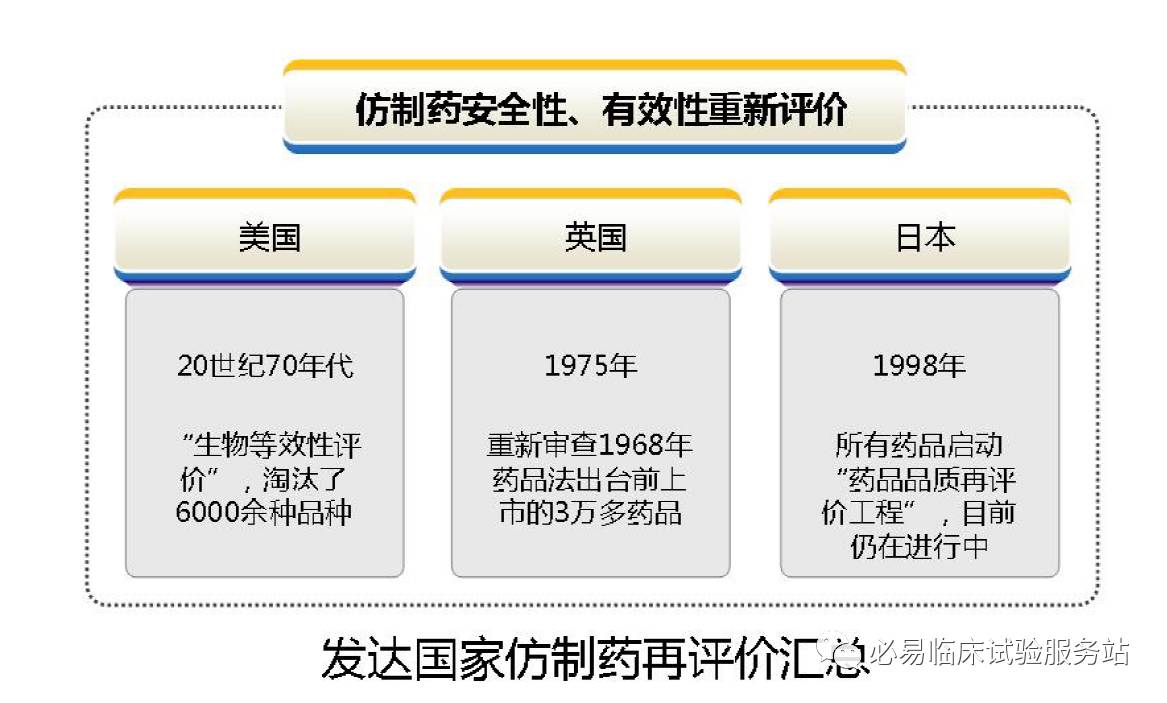
仿制药一致性评价是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行质量一致性评价,就是仿制药需在质量与药效上达到与原研药一致的水平。对已经批准上市的仿制药进行一致性评价,这是补历史的课。因为过去批准上市的药品没有与原研药一致性评价的强制性要求,有些药品在疗效上与原研药存在一些差距。历史上,美国、日本等国家也都经历了同样的过程,日本用了十几年的时间推进仿制药一致性评价工作。开展仿制药一致性评价,可以使仿制药在质量和疗效上与原研药一致,在临床上可替代原研药,这不仅可以节约医疗费用,同时也可提升我国的仿制药质量和制药行业的整体发展水平,保证公众用药安全有效。仿制药一致性评价在我国是补课,也是创新。做到与原研药质量疗效一致,离创制新药也就不远了。
2012
年
2
月,国务院印发《国家药品安全“十二五”规划》,明确提出“部分仿制药质量与国际先进水平存在较大差距”。《规划》提出,对
2007
年修订的药品注册管理办法实施前批准的仿制药(据
CDE
数据,中国现有的
18.9
万余张药品上市许可证中的
95%
是在
2007
年以前发放的),分期分批与被仿制药进行质量一致性评价。其中
570
种纳入国家基本药物目录和临床常用的化学药在
2015
年前完成,共涉及
3.3
万个批准文号。
2012
年
11
月底,
CFDA
成立了仿制药质量一致性评价工作办公室,并启动评价工作。此后,国家食药监局开始推动仿制药质量一致性评价工作,分两批选择了
75
个试点品种进行一致性评价。
2015
年
CFDA
新任管理层上任,中国药监进入新时期。一年以来药监局出台系列改革政策,其中工作重心之一就是全面推行仿制药一致性评价。继
CFDA
在
2015
年
11
月发布《关于开展仿制药质量和疗效一致性评价的意见(征求意见稿)》后,
2016
年
3
月
5
日国务院办公厅下发《关于开展仿制药质量和疗效一致性评价的意见》,
2016
年
3
月
18
日
CFDA
公布参比制剂选择、溶出曲线测定及生物等效性研究三个技术指导原则,仿制药一致性评价工作已步入正轨。
2016
年
5
月
26
日,国家食药监总局对仿制药一致性评价最后定稿,发布关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告,并列出
2018
年底前须完成仿制药一致性评价品种目录,也就是国家基本药物目录(
2012
年版)中
2007
年
10
月
1
日前批准上市的化学药品仿制药口服固体制剂。该目录包含
289
个药品通用名,细化到剂型和规格。这些
化药仿制药须在2018年底前完成一致性评价。
2016年11月7日,我国发布“十三五”《医药工业发展规划指南》,将一致性评价列入产品质量升级工程,其全面开展对提升中国制药行业整体水平、保障公众用药安全具有重大意义。国家局、中检院、网站都设立了一致性评价专门栏目来推进这个工作的进行。
对企业来讲,仿制药一致性评价已成为当下事关生死的最重要事件,已获批上市仿制药市场存量格局将被重构,只保留质量水平高、能尽早通过一致性评价的品种;而未来按照新的注册分类办法,新申报的仿制药将完全按照与原研药品质量与疗效一致的原则进行审评,只有制剂处方工艺能达到原研药水平的药企才有希望不断获批新产品上市,过去低水平仿制、蒙混过关的时代将一去不复返。
二、评价对象和实施阶段
1.
化学药品新注册分类实施前批准上市的仿制药,包括国产仿制药、进口仿制药和原研药品地产化品种,均须开展一致性评价。
2
.凡
2007
年
10
月
1
日前批准上市的列入国家基本药物目录(
2012
年版)中的化学药品仿制药口服固体制剂,原则上应在
2018
年底前完成一致性评价。
3.
上述第
2
款以外的化学药品仿制药口服固体制剂,企业可以自行组织一致性评价;自第一家品种通过一致性评价后,三年后不再受理其他药品生产企业相同品种的一致性评价申请。
4
:注射剂将在
5-10
年内完成一致性批评工作。
三、参比制剂的选择和确定
1.
药品生产企业对拟进行一致性评价的品种,参照《普通口服固体制剂参比制剂选择和确定指导原则》(食品药品监管总局公告
2016
年第
61
号)要求选择参比制剂。
2.
药品生产企业按照《仿制药质量和疗效一致性评价参比制剂备案与推荐程序》(食品药品监管总局公告
2016
年第
99
号),将选择的参比制剂向食品药品监管总局仿制药质量一致性评价办公室(以下简称一致性评价办公室)备案。行业协会可向一致性评价办公室推荐参比制剂,原研药品生产企业、国际公认的同种药物生产企业可向一致性评价办公室申报参比制剂。一致性评价办公室主动对参比制剂的备案、推荐和申报信息向社会公开。食品药品监管总局及时公布推荐和确定的参比制剂信息,药品生产企业原则上应选择公布的参比制剂开展一致性评价。
3
.企业找不到且无法确定参比制剂的,由药品生产企业开展临床有效性试验。
四、一致性评价的研究内容
1.
在开展一致性评价过程中,药品生产企业须以参比制剂为对照,全面深入地开展比对研究。包括处方、质量标准、晶型、粒度和杂质等主要药学指标比较研究,以及固体制剂溶出曲线的比较研究,以提高体内生物等效性试验的成功率,并为将药品特征溶出曲线列入相应的质量标准提供依据。对符合《人体生物等效性试验豁免指导原则》(食品药品监管总局通告
2016
年第
87
号)的品种,由药品生产企业申报,一致性评价办公室组织审核后公布,允许该药品生产企业采取体外溶出试验的方法进行一致性评价。
2.
开展生物等效性试验的品种,应根据《关于化学药生物等效性试验实行备案管理的公告》(食品药品监管总局公告
2015
年第
257
号)规定的程序备案,并按照《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》(食品药品监管总局通告
2016
年第
61
号)等的有关要求进行试验研究。
3.
对无参比制剂需开展临床有效性试验的品种,区分两种情况处理:(
1
)如属于未改变处方、工艺的,应按一致性评价办公室的要求进行备案,并按照有关药品临床试验指导原则的相应要求开展试验研究;(
2
)如属于改变已批准处方、工艺的,按照《药品注册管理办法》补充申请有关要求开展试验研究。
五、一致性评价的程序
1.
药品生产企业完成一致性评价研究后,按照《仿制药质量和疗效一致性评价工作程序》(食品药品监管总局公告
2016
年第
105
号)进行申报:(
1
)国产仿制药由省级食品药品监督管理部门负责本行政区域内一致性评价资料的接收和相关补充申请资料的受理,组织研制现场核查和生产现场检查,现场抽取连续生产的三批样品送指定的药品检验机构进行复核检验。完成上述工作后,由省级食品药品监督管理部门汇总报送一致性评价办公室。(
2
)进口仿制药由食品药品监管总局行政服务受理和投诉举报中心(以下简称受理和举报中心)受理,对申报资料进行形式审查,并通知企业送三批样品至指定的药品检验机构进行复核检验。完成上述工作后,由受理和举报中心汇总报送一致性评价办公室。
2.
在中国境内用同一条生产线生产上市并在欧盟、美国或日本获准上市的药品,由受理和举报中心负责申报资料受理;一致性评价办公室通知食品药品监管总局药品审评中心(以下简称药审中心)对原境内、外上市申报资料进行审核,通知食品药品监管总局食品药品审核查验中心(以下简称核查中心)对生产现场进行检查。经一致性评价办公室审核批准视同通过一致性评价。
3.
国内药品生产企业已在欧盟、美国或日本获准上市的仿制药,按照《关于发布化学药品注册分类改革工作方案的公告》(食品药品监管总局公告
2016
年第
51
号)的有关要求申报仿制药注册申请,由药审中心审评,批准上市后视为通过一致性评价。
六、复核检验与核查
1.
一致性评价样品的复核检验不适用属地原则。同一品种的复核检验,原则上由食品药品监管总局指定的同一药品检验机构进行(名单另行公布);补充申请样品的复核检验,按照上述原则执行。对未分配复核检验药品检验机构的品种,企业在提交申报资料前,向一致性评价办公室提出相关申请,由一致性评价办公室提出复核检验药品检验机构名单,报食品药品监管总局批准后执行。
2.
对生物等效性试验和临床有效性试验等临床研究数据的真实性、规范性和完整性的核查,由核查中心负责总体组织协调。其中,对申请人提交的国内仿制药的临床研究数据,由省级食品药品监督管理部门进行核查,核查中心进行抽查;对申请人提交的进口仿制药的国内临床研究数据,由核查中心进行核查;对申请人提交的进口仿制药的国外临床研究数据,由核查中心进行抽查。一致性评价办公室可根据一致性评价技术评审过程中发现的问题,通知核查中心开展有因核查















