
生物医药产业作为一种知识密集、前景广阔的战略新兴产业,其准入门槛高、研发投入大、周期长、风险高、回报高。在所有的技术领域内,
生物医药行业对知识产权的依存度最高
,国内外生物医药企业对医药知识产权的保护也贯穿于整个药物研究与开发全过程中。产品要研发,专利需并行甚至先行,最终通过药物专利的独占来实现市场盈利。那如何最大限度的扩大药物的独占权,延长专利药的生命周期,增加新药的投资价值是每家创新企业需要努力思考的命题。
A. 专利间的关系:
基本专利
(核心专利 or 强专利)、
从属专利
(改进专利 or 外围专利);
B. 专利的类型:
产品专利、方法专利、用途专利
;
以含有新化学实体(NCE)的新药研发中涉及到的专利分类举例:

图1.新化学药物专利间的关系
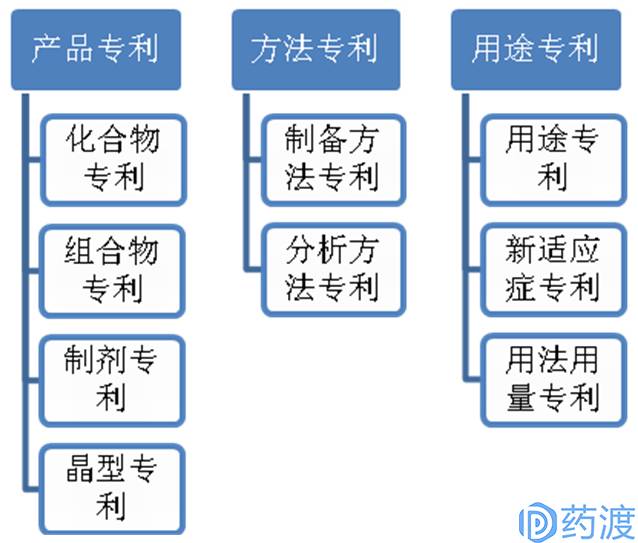
图2.新化学药物专利的分类
在药物开发的不同阶段,根据研究进展和专利保护策略,专利申请的侧重点往往不同(如图3)。专利申请策略的基本原则是
产品专利
的申请应尽量在前期完成,尤其是与化合物相关的专利(化合物盐、酯、异构体、晶型等),以便后期进行全面的药理毒理研究;
方法专利
和
用途专利
可在新药研发的后期申请。
-
在活性新化合物发现阶段,专利申请主要包括
化合物专利
(通式化合物、具体化合物);化合物专利为核心专利,是新药专利中最具价值的专利;
-
随着药理毒理学的研究,此阶段专利申请开始建立
外围专利
,包括晶型专利、活性化合物盐、酯、异构体、水或溶剂化专利等;此时,新化合物的专利池开始形成雏形;
-
临床阶段,随着临床试验的深入和试验数据的积累,该阶段专利申请常常包括组合物专利,各类剂型专利,工艺专利及用途专利等;
-
新药成功上市后,为了进一步扩大专利的独占权,延长新药的生命周期,该阶段的专利申请主要集中在新组合物专利、新剂型专利以及新用途专利等。
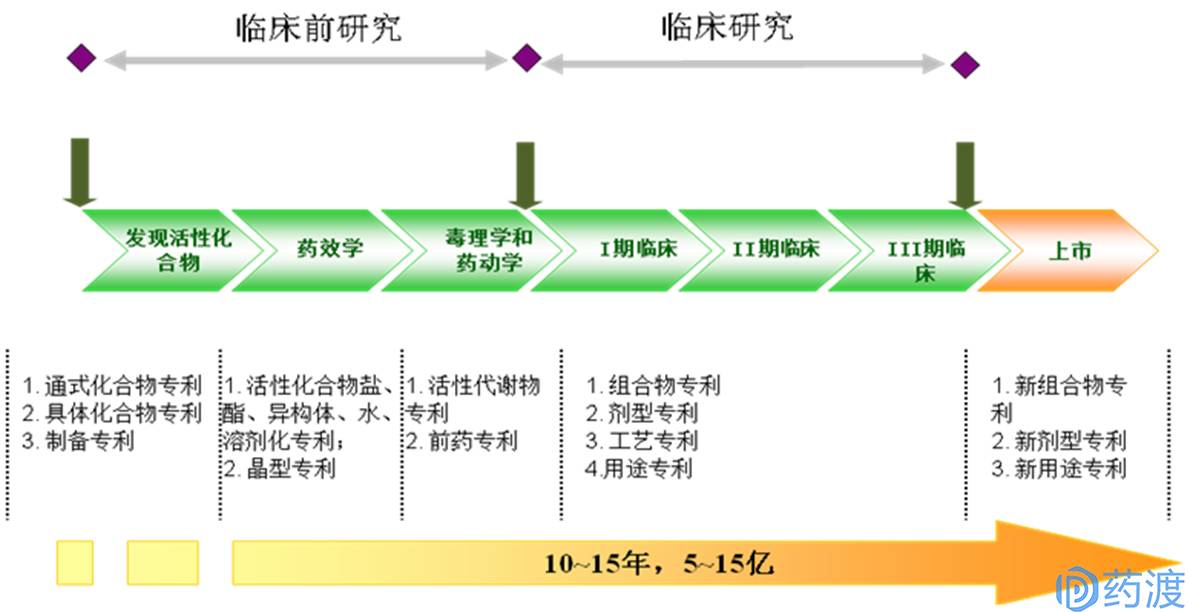
图3.新药不同研究阶段的专利申请策略
以上是不同研究阶段常见的专利申请策略。实际专利申请过程常有交叉,如新化合物的工艺专利在临床前研究、临床研究以及上市后均可以申请。
抗HCV神药索非布韦由美国Pharmasset制药企业研制,吉利德科学(Gilad Sci)公司收购后开发上市,代号为GS-7977。FDA于2013年12月6日首次批准上市,制剂为片剂400mg,商品名Sovaldi。索非布韦的专利申请策略如下图所示:
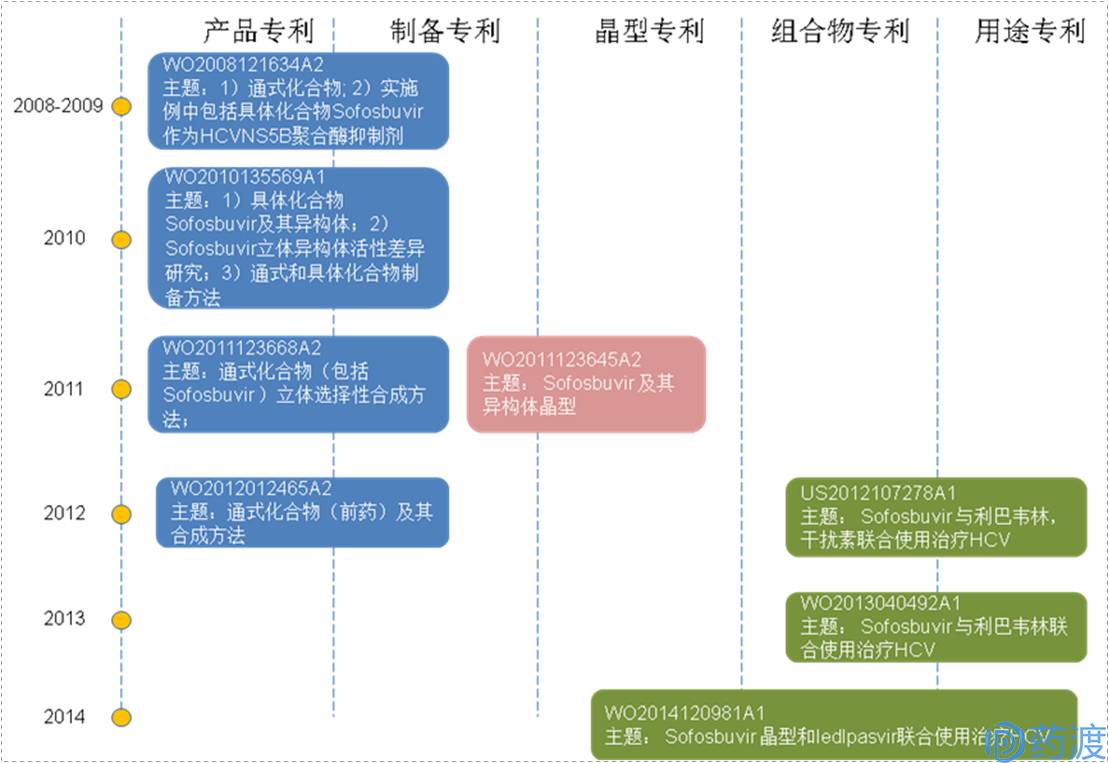
图4.Sofosbuvir专利申请策略路线图
2008年,Pharmasset专利申请WO2008121634A2要求保护包括Sofosbuvir的通式化合物(实施例25为Sofosbuvir的外消旋体)、其立体异构体、酸或碱加成盐、水合物、溶剂合物或结晶形式等多种衍生物。该申请公开的实验结果表明,Sofosbuvir外消旋体等化合物能够抑制HCV NS5B聚合酶,达到特异性治疗HCV的目的。该专利申请的美国同族已经授权(
US7964580B2
),其授权的权利要求相对于原权利要求,其要求保护的范围大大缩小,只保护Sofosbuvir及其异构体以及其制备方法。由此可见,该专利保护的重点就在于Sofosbuvir及其异构体,原申请中要求保护范围很大的通式化合物可能是出于公司的专利战略考虑。
2010年,Pharmasset申请了专利
WO2010135569A1
(中国同族
CN102459299A
),其要求保护通式化合物的制备方法,其中包括Sofosbuvir及其异构体的制备方法,并请求保护具体化合物Sofosbuvir及其异构体、其溶剂化物、水合物及晶体。生物实验表明,Sofosbuvir及其异构体都显示对HCV基因型1-4具有活性,而且Sofosbuvir比其异构体抗HCV活性更优。
2011年,Pharmasset申请
WO2011123668A2
、
WO2011123645A1
。WO2011123668A2要求保护包括Sofosbuvir的通式化合物的立体选择性合成方法;WO2011123645A1要求保护Sofosbuvir(申请中以Sp-4表示)及其异构体(申请中以Rp-4表示)的晶体,其要求保护的范围落在了之前提及的WO2010135569A1的范围内。同年年末,美国Pharmasset被吉利德科学公司(GILE)高价收购。





