BioArt按
:
此前有研究表明,与染色质结合的延胡索酸水合酶Fumarase(FH)能通过它的代谢活性影响组蛋白的甲基化。然而, 这一结果如何进一步影响基因转录从而影响肿瘤的发生发生并不清楚。6月19日, 上海交通大学附属第一人民医院
蒋玉辉
研究员课题组在
Nature Cell Biology
杂志上在线发表了题为“O-GlcNAcylation of fumarase maintains tumour growth under glucose deficiency” 的研究论文,
揭示了延胡索酸水合酶调节基因转录的新机制。此外,该研究还解释了胰腺癌中高水平表达的N-乙酰氨基葡萄糖转移酶(OGT) 是如何影响肿瘤生长这一重要科学问题。这项研究将OGT的异常活性和肿瘤细胞在葡萄糖缺失条件下的优势生长联系了起来,揭示了葡萄糖缺失时,FH的O-GlcNAc 糖基化维持肿瘤生长的新机制。

论文解读:
延胡索酸水合酶
Fumarase(fumarate hydratase/
FH
)是参与三羧酸循环的一个关键酶,
在细胞内能够催化延胡索酸
(fumarate)
转变成L-苹果酸
(malate)
,并广泛存在于动植物和微生物中【1】。
此前有研究表明 FH的基因突变会导致遗传性平滑肌瘤和肾癌(hereditary leiomyomatosis and renal cell cancer,HLRCC)等疾病【2】,
FH功能性突变失活能够在多种癌组织中检测到,并促进肿瘤的发生【2,3】。然而 FH功能与肿瘤发生之间关系的具体分子机制有待阐明。
延胡索酸作为一种促肿瘤的代谢产物【4】,一方面可以通过影响TCA循环破坏线粒体的功能,另一方面延胡索酸可以作为α-酮戊二酸(α-KG)的竞争性抑制剂,影响α-KG依赖的组蛋白去甲基化酶和DNA去甲基化酶TET的,进而引起一些表观修饰的紊乱从而影响肿瘤的发生发展【5】。
蒋玉辉研究员在美国安德森癌症中心(MD Anderson Cancer Center) 做博士后期间曾发现
FH 能通过其代谢产物fumarate 拮抗α-KG依赖的去甲基化酶从而影响组蛋白甲基化水平,进而促进DNA损伤修复(
下图
)
【6】。而众所周知,组蛋白甲基化修饰在调控细胞内基因转录过程中发挥着关键的作用。那么FH是否能通过fumarate影响组蛋白甲基化水平从而调控基因转录过程,目前还缺乏相关的研究和报导。

此外,一些研究也表明代谢酶除了能够发挥其经典的代谢相关的功能以外,在外界刺激细胞的情况下还具备其它非代谢相关功能【7,8】。
在这项研究中,蒋玉辉课题组研究人员首先发现,在正常胰腺导管上皮细胞中,葡萄糖缺失促进FH和转录因子ATF2 的结合(ATF2由质谱鉴定)(
下图
)。
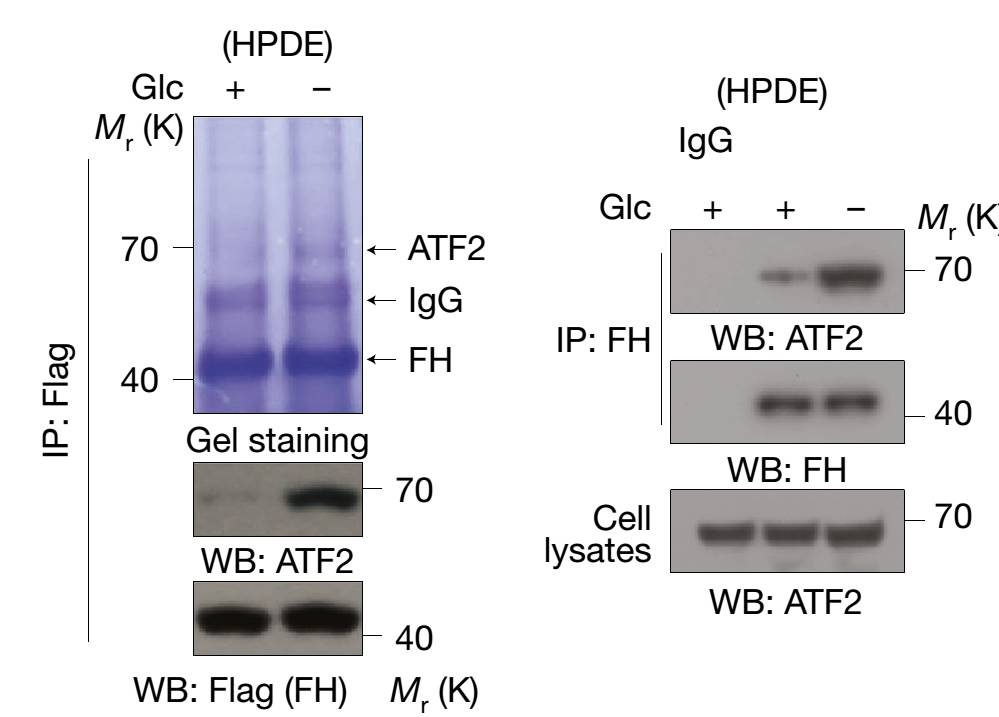
随后进一步的研究表明,在葡萄糖缺失时(葡萄糖的缺失或者能量短缺的情况下能够激活AMPK的酶活),FH第75位的丝氨酸残基上发生AMPK介导的磷酸化修饰,磷酸化的FH作为ATF2的相互作用蛋白被招募到ATF2下游基因启动子区域,而FH 在启动子区域局部代谢产生的延胡索酸能抑制赖氨酸去甲基化酶KDM2A对组蛋白的去甲基化,进而促进导致细胞周期阻滞的基因表达。
另外,研究人员还发现FH第75位的丝氨酸也能够被O-GlcNAc 糖基化,该糖基化修饰能够阻滞FH与ATF2的相互作用及下游信号通路。在高水平表达OGT的胰腺癌细胞中,葡萄糖缺失时仍能维持较高水平的FH糖基化进而抑制FH-ATF2信号通路导致的细胞周期阻滞,维持肿瘤细胞生长(
下图
)。
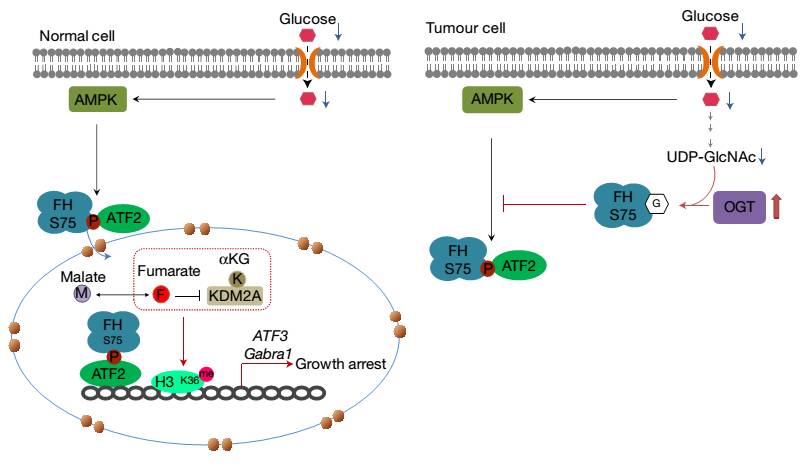
工作模型
比较有意义的是,在胰腺癌病人的样本中也发现FH-Ser75磷酸化和OGT的蛋白水平以及病人的差预后成负相关。
总的来说,这项研究揭示了FH调节基因转录的新机制,同时很好的阐明了在葡萄糖缺失的条件下,肿瘤细胞如何通过OGT对FH 的糖基化修饰维持肿瘤生长。
据悉,
该论文的第一作者为
王霆
博士和
余秋景
博士,
蒋玉辉
研究员和
王霆
博士为共同通讯作者。同时参与或支持本项研究的还有华东师范大学
廖鲁剑
教授和中科院上海生命科学院的
秦樾
教授和
刘新垣
院士等。本研究工作得到了国家中组部、国家自然科学基金委以及上海市科委的经费支持。
参考文献:
1.Yogev, O. et al. Fumarase: a mitochondrial metabolic enzyme and a cytosolic/nuclear component of the DNA damage response.
PLoS biology
8, e1000328 (2010).
2.Tomlinson, I.P. et al. Germline mutations in FH predispose to dominantly inherited uterine fibroids, skin leiomyomata and papillary renal cell cancer.
Nature genetics
30, 406-410 (2002).
3.Gottlieb, E. & Tomlinson, I.P. Mitochondrial tumour suppressors: a genetic and biochemical update.
Nature reviews. Cancer
5, 857-866 (2005).
4.Yang, M., Soga, T., Pollard, P. J., & Adam, J. (2012). The emerging role of fumarate as an oncometabolite.
Frontiers in oncology
, 2, 85.
5.Xiao, M., Yang, H., Xu, W., Ma, S., Lin, H., Zhu, H., ... & Zhao, S. (2012). Inhibition of α-KG-dependent histone and DNA demethylases by fumarate and succinate that are accumulated in mutations of FH and SDH tumor suppressors.
Genes & development
, 26(12), 1326-1338.
6.Jiang, Y. et al. Local generation of fumarate promotes DNA repair through inhibition of histone H3 demethylation.
Nature cell biology
17, 1158-1168 (2015).
7.Yang, W. et al. PKM2 phosphorylates histone H3 and promotes gene transcription and tumorigenesis.
Cell
150, 685-696 (2012).
8.Yang, W. et al. Nuclear PKM2 regulates beta-catenin transactivation upon EGFR activation.
Nature
480, 118-122 (2011).

蒋玉辉
,博士,现任上海交通大学附属第一人民医院研究员,第13批国家“青年千人计划”入选者。
蒋玉辉博士2006年本科毕业于湖南师范大学生命科学学院,2011年获得中国科学院上海生命科学研究院营养所生物化学与分子生物学博士学位,2011年-2015年在美国休斯顿德克萨斯大学MD安德森癌症中心从事博士后研究工作。2015年6月作为人才引进到上海交通大学第一人民医院工作。蒋玉辉博士参加过多项NIHR01、Cancer Prevention & Research Institute of Texas (CPRIT)等重要科研项目的研究工作,2013年获得安德森癌症研究中心Odyssey Fellowship计划资助。获得中科院院长优秀奖、Odyssey Fellowship以及Caroline Ross Endowment Fellowship in Brain Cancer Research等多项学术奖励。目前已在
Nature Cell Biology、Molecular Cell、Nature Communications、Cancer Research
以及
Molecular and Cellular Biology
等国际主流学术期刊发表多篇研究论文。主要研究领域为代谢与肿瘤细胞分裂以及表观遗传的关系。


BioArt,一心
关注生命科学,只为
分享更多有种、有趣、有料的信息。
关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:
fullbellies
或邮箱:
[email protected]
。





