来源:全球医生组织公众号,作者:时占祥

本周二,作为改革药品审评制度和鼓励创新目标之一,美国FDA公布了170种即将或已经到期的原研药目录(如下图)。这些原研药至今仍没有企业或研发机构提出申请准备仿制研发。或许是国内制药企业难得的良机!
FDA如此做的目的,是希望公开且透明化鼓励仿制药研发,旨在降低和控制药价。对任何企业或研发机构提出仿制研发申请,FDA甚至可以一路开"绿灯",包括放宽仿制药上市审评流程等。
FDA并不把控原研药或仿制药市场定价的话语权,但是,FDA可以通过开放和鼓励仿制药研发,让更多制药企业通过公开竞争方式获得仿制研发权益,有更多仿制药上市,利用市场竞争机制来左右药品的最终价格导向。
据悉,美国联邦总审计署去年的财政报告中(负责联邦医保等结算)显示,在过去50年里,至少有300多种药品的市场价格已经被哄抬超过了100%。这是造成美国医保费用持续攀升的重要原因之一。
业内人士对此普遍认为此举肯定会有积极效果,并且也是历届FDA局长希望改革的内容之一。此次FDA公布的可仿制药品名单目录,为制药企业和研发机构指明了道路和方向。
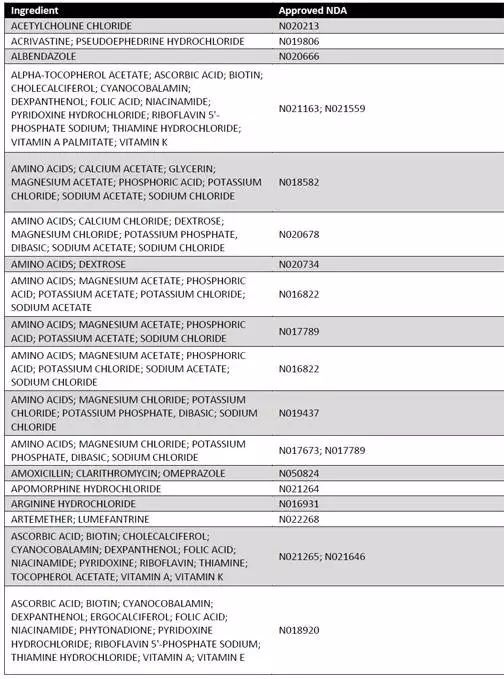
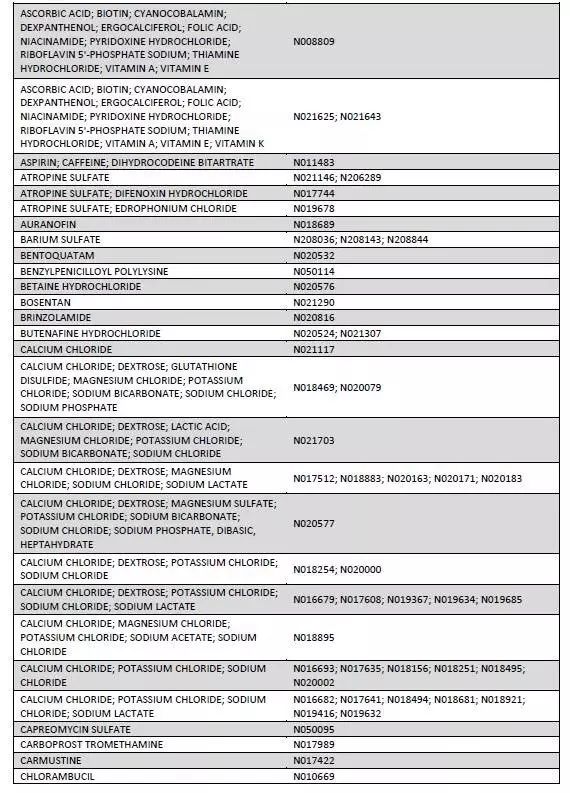
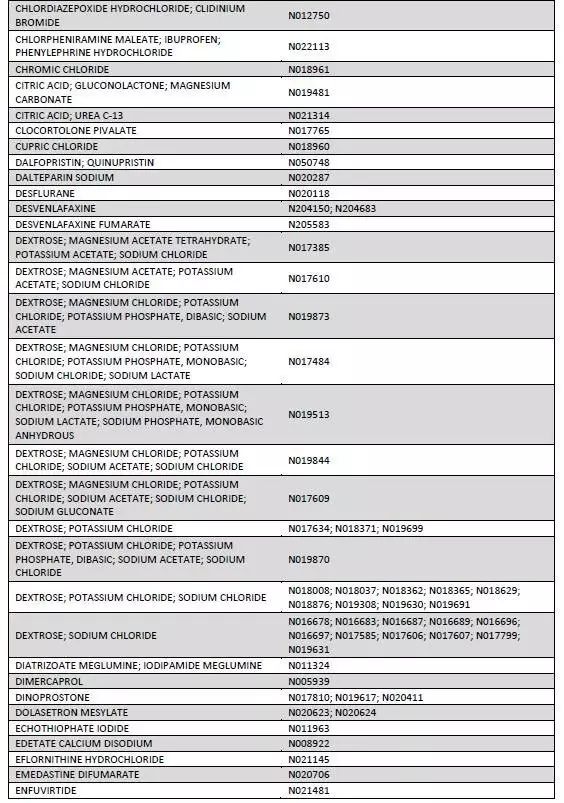
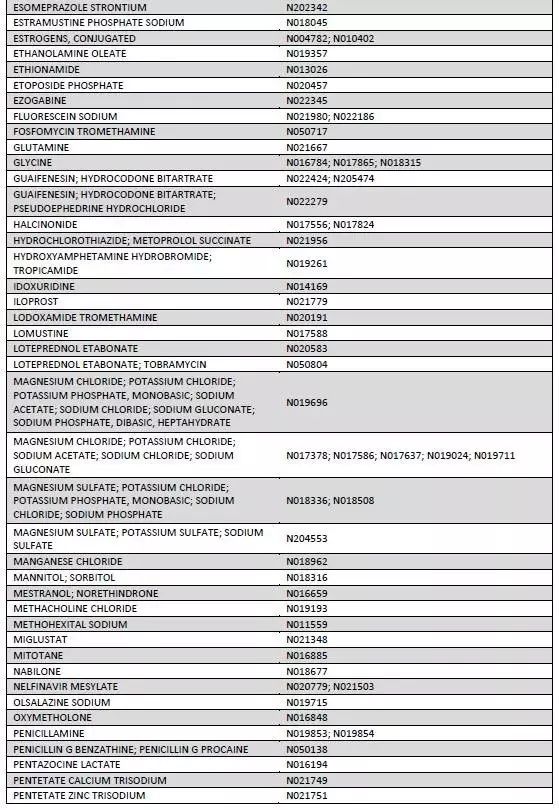

参考信息https://www.fda.gov/downloads/Drugs/ResourcesForYou/Consumers/BuyingUsingMedicineSafely/UnderstandingGenericDrugs/UCM564441.pdf





