
一般认为血流导向装置(FD)主要通过2种方式达到治疗效果:1)血流阻断作用,降低瘤内血流;2)脚手架作用,通过血管上皮细胞的内膜化作用达到瘤颈治愈。
————摘自文章章节
【Ref:Ravindran K,
et al
. AJNR Am J Neuroradiol 40:295–301. doi.org/10.3174/ajnr.A5955】
随着神经介入技术的的不断发展,血流导向装置(FD)逐渐成为颅内动脉瘤的重要手段,其金属覆盖率远高于传统支架,一般认为FD主要通过2种方式达到治疗效果:1)血流阻断作用,降低瘤内血流;2)脚手架作用,通过血管上皮细胞的内膜化作用达到瘤颈治愈。然而,DSA与MRI对动脉瘤治疗效果评估的“错配”效应以及应用FD装置后双抗应用的时间问题尚未达成共识,因而,对内膜化作用的研究有助于临床适宜病人的筛选,进而解决上述问题。Ravindran等人对目前关于FD植入后内膜化作用的相关文献进行了系统综述,结果发表在2019年1月的《AJNR》上。
该研究共纳入10项相关文献,其中2篇为在体研究,其余8篇为动物实验。
动物实验&在体实验:通过野兔动脉瘤模型的CFD(计算流体力学)研究显示,FD植入后降低了瘤内血流速度,进一步导致瘤内血栓形成(其机制见图1)。在冠脉相关研究中,支架贴壁良好与瘤内血栓化成正相关,另外,PED支架释放后贴壁良好的模型中影像学栓塞预后明显好于贴壁不良的模型。因此建议:为达到更好的栓塞效果,术者应选择高金属覆盖率的支架。
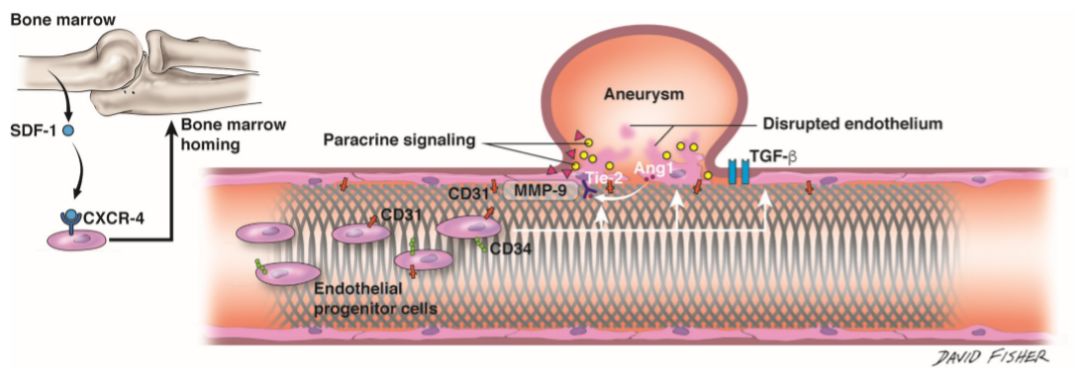
图1. FD植入后的内膜化作用。FD、血管上皮细胞、循环内皮祖细胞、分子等因素间相互作用,其中,SDF-1(基质细胞衍生因子-1)自骨髓中释放,并与循环内皮祖细胞表面的CXCR-4(C-X-C趋化因子4型)相结合,直接归巢于骨髓;FD植入后,CD31+于CD34+表型的循环祖细胞聚集于FD表面,在瘤腔内,多种分子如MMP-9(基质金属蛋白酶-9)开始进行血管修复,破损的内皮细胞进一步释放Ang-1,并通过血管内皮细胞表面的Tie2受体介导发挥修复作用。TGF-β:转化生长因子-β。
在体研究显示,瘤内血栓形成是使瘤腔与血管隔绝的远期效应,FD植入后可降低瘤内血流、壁面剪切力;另有研究显示,瘤内血流速度低、流量少的动脉瘤达到完全栓塞的时间更短。瘤内弹簧圈的辅助栓塞可以促进内膜化作用,弹簧圈植入后还可被诱导富含胶原蛋白的组织覆盖,进一步促进瘤内血栓形成。
覆盖在FD表面的上皮细胞来源尚未解决,这些细胞既可能是通过旁分泌来源于临近的上皮细胞,也可能是通过血运循环中骨髓来源的上皮祖细胞(EPC)分化而来。有研究通过免疫组化技术发现这些细胞存在CD34余CD31表型,通过对EPC细胞进行荧光标记,可以追溯其迁移路线,然而,该研究显示覆盖在支架表面与其他血管表面迁移的EPC细胞数量并无统计学差异;另一项研究显示支架表面并无CD34+表达,因而,内膜化细胞的来源问题依旧有待解决。
FD植入后的血管上皮细胞内膜化是动脉瘤治愈的基础,既往研究已经在动物模型的基础上获得初步结果,下一步研究应当围绕覆盖在支架上的细胞来源是临近的上皮细胞抑或循环内皮祖细胞,这将进一步为动脉瘤治疗措施的优化提供理论基础。


请点击左下方“
阅读原文
”即可查看原文。






