整理自蒲公英、 识林
FDA检查动向_无效的OOS案列
翻译:
kslam 来源:蒲公英
FDA检查印度2家制药商列举无效的OOS:
1. 在2016年9月5日-14日检查了印度迈兰 (Mylan) 制药有限公司 - 警告信列举139个OOS结果断定101个为无效OOS(约72%)。
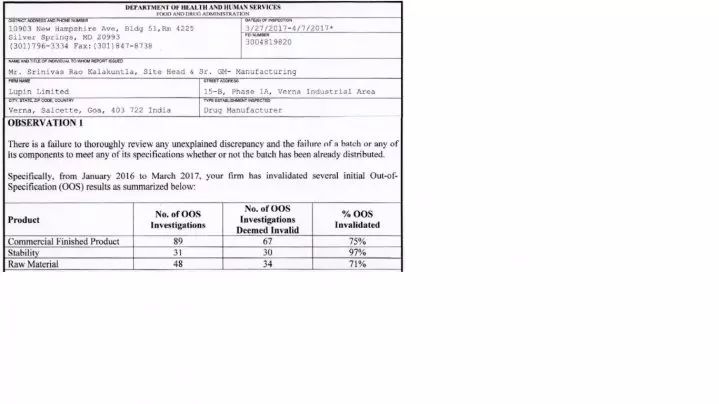
2. 在2017年3月27-4月7日检查了印度 (Lupin) 制药有限公司 - 483 报告列举89个OOS结果断定67个为无效OOS(约75%)。
FDA指出OOS 调查不彻底。通过重新检测判定初始的OOS结果无效, 而不是经科学评估或对制造过程的审查。
反映 FDA检查动向
FDA 在其质量量度质量修订草案中阐述了无效的 OOS 率量度。无效的 OOS 率的定义为:报告期内,批次放行检验和长期稳定性检验的OOS结果中,因检验过程中的过失而被判定无效的OOS结果,除以批次放行和长期稳定性检验的全部OOS结果。作为衡量实验室操作的稳定可靠性的指标, 无效的 OOS 率越高,意味着实验室操作的稳定性越差。
 以下来自识林
以下来自识林
FDA在检查观察项中引用“无效的OOS率”
美国 FDA 在向印度一家制造商签发的 483 中提到无效的 OOS 率过高,这是 FDA 提出用于评估药品制造设施质量量度的三个指标之一。这可能表明,即使行业迫使 FDA 延迟其质量量度计划,FDA 仍然可以并将通过检查过程来对其提出的指标开展性能评估。
FDA 在一份检查观察项的 483 报告中对于 2016 年 6 月 16 日对印度 Lupin 公司一所设施的检查中观察到的批检验中无法解释的高差异率提出担心。该 483 中的第一个观察项关注未解释的差异,强调 Lupin 两年内在某些批放行和稳定性测试中的超标(OOS)结果中 87% 无效。
相似的引述也出现在近期两封警告性中:
4 月 3 日 Mylan 公司的警告性中提到其在印度 Nashik 的工厂在 2016 年上半年中存在 72% 无效 OOS 率。
2 月 17 日 Wockhardt 公司 Morton Grove 子公司的警告信中提到 OOS 调查不彻底和不当的无效 OOS 结果,并要求列出有效期内产品的所有 OOS、无效 OOS、预期外和超趋势(OOT)的中控检测结果。
FDA 在其质量量度质量修订草案中阐述了无效的 OOS 率量度,作为衡量实验室操作的稳定可靠性的指标。无效的 OOS 率的定义为:报告期内,批次放行检验和长期稳定性检验的OOS结果中,因检验过程中的过失而被判定无效的OOS结果,除以批次放行和长期稳定性检验的全部OOS结果。
无效的 OOS 率越高,意味着实验室操作的稳定性越差。FDA 在 483 中指出,Lupin 公司通常通过重新检测而不是通过科学评估或对制造过程的审查使初始 OOS 结果无效。另外值得注意的是,对 Lupin 的检查是 FDA 检查员 Doan Nguyen 在 CDER 药品质量办公室工艺与设施办公室中分处主管 Zhigang Sun 的陪同下进行的。该部门主要负责审评制造工艺设计和控制。这也反映了近期 FDA 现场检查的变革。
行业似乎已经获得白宫的支持,反对 FDA 提出的自愿的量度报告计划和规划中的强制报告计划。大多数反对者反对报告标准化量度的预期要求。对于检查期间质量量度的审查并不太担心,因为在检查期间公司有更多机会对情有可原的情况作出解释,而且重点可能在公司自己的内控指标上。






