
事项
8月25日,CFDA发布《总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)》,就一致性评价的关键事宜及后续申报、审评工作流程进行了说明。
评论
本次是一致性评价的第四个纲领性文件,意义重大。自2015年11月,CFDA正式启动一致性评价工作以来,到目前为止共有四份纲领性文件,就评价的关键事宜逐渐进行规定、更新与确认:

上述系列发文围绕着审评时限、参比制剂、BE试验、特殊品种、通过评价后的政策优待等关键问题不断进行更新,本次100号文则是在一致性评价开展一年半之后,通过对实践的总结针对关键问题进行了一锤定音的确认(文件中明确说明“本公告自发布之日起实施,原发布的一致性评价相关文件与此件不一致的,以此件为准”)。同时100号文也确认了后续的申报和审评流程,文件明确指出,“自公告发布后第十个工作日起,一致性评价申请由国家食品药品监督管理总局行政事项受理服务和投诉举报中心负责受理或接收”,标志着一致性评价的报审阶段正式拉开帷幕。
100号文中未提及审评时限相关内容。100号文未再提及审评时限相关内容,包括此前文件中提到的289目录品种“原则上应在2018年底前完成一致性评价”、 其它品种“自第一家品种通过一致性评价后,三年后不再受理其他药品生产企业相同品种的一致性评价申请(实际上关于这点的说法,在过去这三次的文件中表述也在悄悄变化)”等。我们推断这可能意味着不再对一致性评价的时限进行刻板规定,这也是出于对过去一年多企业在开展评价过程中遇到问题较多,进展普遍不乐观所作出的务实性调整。不设具体时间并不意味着企业可以放慢节奏,实际上100号文再次确认“同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种”,该规定一方面激励企业尽早开展评价以享受招标采购方面的优待,同时也仍是横亘在所有企业面前的生死时限。若企业品种不能通过评价,则无缘集采市场,基本等同于文号被注销。
我们认为本次100号文对企业在开展一致性评价过程中遇到的系列疑问进行了最后确认,将大大加快一致性评价进进程,随着报审阶段拉开帷幕,药企间竞争已进入肉搏阶段。
100号文就一致性评价的系列关键问题进行了确认,解答了企业的疑虑,包括:参比制剂(按进口原研、经审核确定的原研地产化品种、未进口原研药品的顺序选择;CFDA已公告参比制剂的,企业无需再备案);BE试验(也可在其它具备条件的机构开展;BE开展前需在CDE指定网站进行登记;CFDA将分批公布BE豁免具体品种目录);支持中国境内企业生产的在欧盟、美国或日本批准上市的药品在中国上市(在中国境内同一条生产线同一处方工艺生产的,可直接以境外上市申报的技术资料进行申报,CFDA组织现场检查;非同一条生产线或处方工艺不同,可提出变更申请;尚未在中国境风上市的可以境外申报资料提出上市申请,需证实无种族差异)。
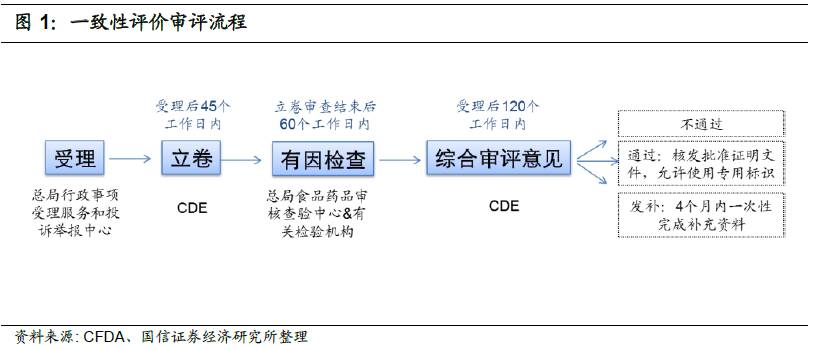
100号文规定,自本公告发布后第十个工作日(9月11日)起,CFDA将开始受理一致性评价申请。具体流程如下:
近日,CFDA公布《关于企业开展289目录内仿制药质量和疗效一致性评价基本情况信息》,我们统计发现目前企业开展一致性评价的进展较慢,289目录中有15个品种尚无企业开展评价,有141个品种已开展评价的企业数量≤5家,37个品种已开展评价的企业数量在6~10家之间。考虑到一致性评价通过的难度,国内很多企业并不具备足够的制剂研发能力,实际可能会有较多品种在未来较长一段时间内难有合格产品能过评价(针对参评企业较少的品种,CFDA会出台相关鼓励政策)。

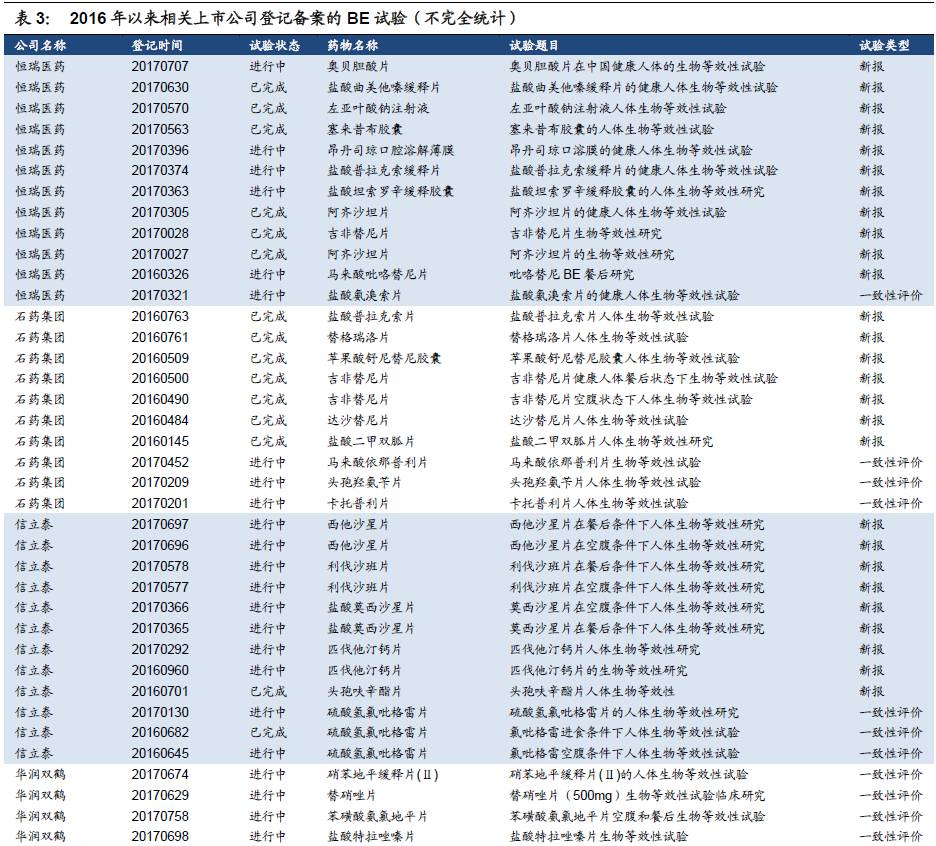
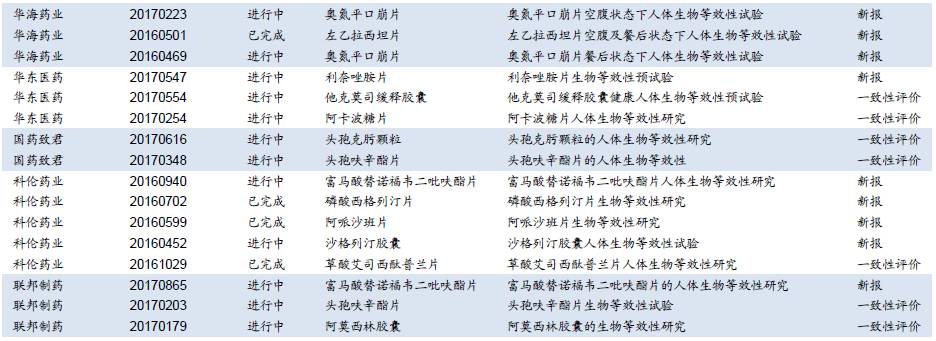
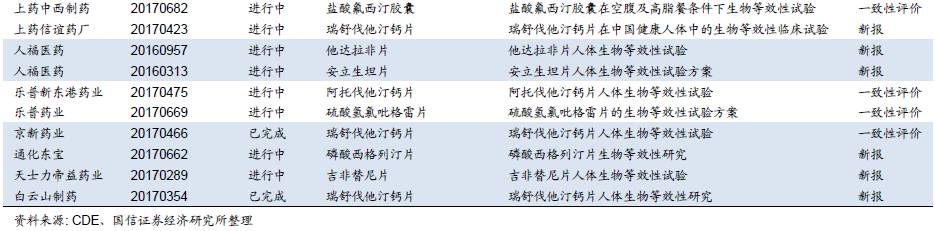
目前BE备案数量较少,预计后续将加快。我们对CDE临床试验登记平台的信息进行统计,选取相关上市公司进行检索,2016年以来企业备案的BE试验数量有限(一致性评价从2015年底启动,对BE试验的要求也相应提高,在2015年之前备案的试验由于设计方案不满足新规定等原因基本中止),并且其中大部分为新申报仿制药开展的BE试验,属于开展一致性评价备案的BE试验数量较少。但一些上市公司的重要品种进展较快,如信立泰的氯吡格雷、科伦药业的草酸艾司西酞普兰片、京新药业的瑞舒伐他汀钙片已完成或部分完成BE试验;另外,恒瑞医药、石药集团、华润双鹤、华东医药、国药致君等企业均已有多个品种进行了BE试验备案,目前正在进行中(平台登记可能会有滞后)。
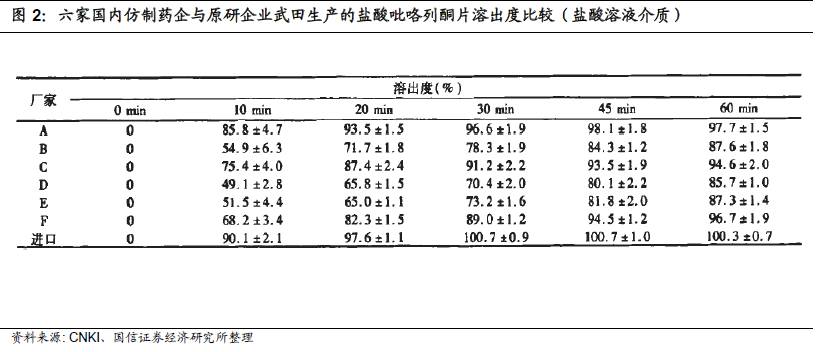
从过去一年多企业开展BE试验的结果来看也并不乐观,显示国内药物制剂工业与国外原研仍存在巨大差距。由于药物制剂开发过程涉及多因素,从剖析原研药出发,需要针对具体制剂品种的特点,在原料药、辅料选择与配比、生产工艺流程设计及参数优化等多个环节进行反复的试验与优化,才能做到与原研药一致。这一过程需要资本投入(包括合格原料药及精细化辅料、生产设备等),也需要技术经验积累,而技术积累不可一蹴而就。目前国内大多数制剂企业尚不具备这种能力,BE试验成功率不高也属情理之中。因此,制剂水平是一致性评价的核心限速步骤,拥有较高药物制剂技术经验积累的企业将在本轮产业结构升级的过程中获得巨大的发展机会。
投资建议
 推荐有高端制剂技术积累及有资本实力有望实现突围的药企,关注CRO企业
推荐有高端制剂技术积累及有资本实力有望实现突围的药企,关注CRO企业
我们认为此次100号文的发布标志着一致性评价正式进入报审阶段,将加快推进国内仿制药工业产业升级,随着企业竞争日趋白热化,市场格局将开始重构。我们推荐两类药企:
一是有高端制剂技术积累,其积累体现在有高品质制剂已出口到欧美日等规范市场、或在为跨国企业代工过程中积淀优势、或在国内市场针对重点品种或高难度制剂品种进行攻关与开发并积累一定经验等,推荐华海药业(600521,增持)、恒瑞医药(600276,买入)、京新药业(002020,买入)、华东医药(000963,买入)、信立泰(002294,买入),建议关注石药集团、普利制药、东阳光药等;
二是有资本实力有望在此次一致性评价中实现突围,把握住产业升级机会的药企,推荐现代制药(600420,买入),上海医药(601607,买入),人福医药(600079,增持),建议关注华润双鹤、科伦药业等。
另外,随着一致性评价加快推荐,CRO企业前期承接的大量BE合同订单后续将进入加快落地执行和收入确认阶段,贡献一定业绩弹性,这点从上半年部分上市公司的半年报中已有所体现,我们判断这种趋势将会加快,未来三年是BE试验大举推进的高峰期,相关CRO企业值得重点关注。
独立性声明 作者保证报告所采用的数据均来自合规渠道,分析逻辑基于本人的职业理解,通过合理判断并得出结论,力求客观、公正,结论不受任何第三方的授意、影响,特此声明。
作者保证报告所采用的数据均来自合规渠道,分析逻辑基于本人的职业理解,通过合理判断并得出结论,力求客观、公正,结论不受任何第三方的授意、影响,特此声明。
风险提示
本订阅号(微信号:GuosenHealthcare)为国信证券股份有限公司经济研究所医药行业小组运营的唯一官方订阅号,版权归国信证券股份有限公司(以下简称“我公司”)所有,仅供我公司客户使用,不因接收人收到本信息而视其为客户。其他机构或个人在微信平台以国信证券研究所名义注册的、或含有“国信证券研究”及相关信息的其他订阅号均不是国信证券经济研究所官方订阅号。未经书面许可任何机构和个人不得以任何形式修改、使用、复制或传播本订阅号中的内容。国信证券保留追究一切法律责任的权利。
本订阅号中的所有内容和观点须以我公司向客户发布的完整版报告为准。我公司不保证本订阅号所发布信息及资料处于最新状态,我公司将随时补充、更新和修订有关信息及资料,但不保证及时公开发布。
本订阅号信息及观点仅供参考之用,不构成对任何个人的投资建议。投资者应结合自身情况自行判断是否采用本订阅号所载内容和信息并自行承担风险,我公司及雇员对投资者使用本订阅号及其内容而造成的一切后果不承担任何法律责任。



















