
近年来,中国心血管疾病死亡率持续上升,心血管病死亡占城乡居民总死亡原因的首位。一系列临床研究表明,血液中高密度脂蛋白(high-density lipoprotein,HDL)水平与动脉粥样硬化、冠心病等心血管疾病的发生风险呈负相关。ABCA1是一种依赖于ATP进行物质转运的膜蛋白,能促进细胞内胆固醇和磷脂的流出,对于HDL的形成至关重要。尽管目前关于ABCA1在调控胆固醇在细胞内的稳态以及其在预防心血管疾病中的重要作用多有报道,但是我们对ABCA1的结构及其介导的脂质运输和新生HDL形成的分子机理却知之甚少。6月8日,清华大学结构生物学高精尖创新中心颜宁教授领导的团队在Cell杂志上发表了题为“Structure of the Human Lipid Exporter ABCA1”的论文,
首次获得了人源ABCA1近原子分辨率的结构,并从分子水平揭示了ABCA1的功能及其作用机理,为将来以ABCA1为靶点开发治疗心血管病的药物奠定了坚实的基础。
该论文第一作者为博士生钱洪武,通讯作者为颜宁教授和龚欣博士。

论文解读:
近年来,中国心血管疾病死亡率持续上升,据《中国心血管病报告2015》显示,我国心血管病死亡占城乡居民总死亡原因的首位,农村为 44.60%,城市为 42.51%【1】。一系列临床研究表明,血液中高密度脂蛋白(high-density lipoprotein,HDL)水平与动脉粥样硬化、冠心病等心血管疾病的发生风险呈负相关【2】。
人源ABCA1基因于1994年克隆,最初命名为ABC1【3】,包含有2261个氨基酸,含有两个跨膜结构域(transmembrane domain,TMD)构成。每个TMD包含6个跨膜片段和1个核苷酸结合结构域(nucleotide-binding domain,NBD)【4】。人类ABC家族一共包含49个成员,分为7个亚家族(A-G)【5】。
ABCA1(ATP-binding cassette transporter A1,三磷酸腺苷结合盒转运体 A1)是一种依赖于ATP进行物质转运的膜蛋白,能够促进细胞内胆固醇和磷脂的流出。这些脂质流出后与细胞表面的载脂蛋白 AⅠ(apolipoprotein AⅠ,ApoA-Ⅰ)结合形成HDL前体(这一过程为HDL生成的限速步骤),因而过剩的胆固醇被转运至肝脏分解处理,最后形成胆酸盐被排泄出去,从而减少胆固醇积累,这一过程也被称为“胆固醇的逆转运”(reverse cholesterol transport,RCT)【6】。1999年有两项研究差不多同时报道了ABCA1基因突变会导致丹吉尔病(Tangier disease)和家族性HDL缺陷【7,8】。
此外,目前对 ABCA1 的研究认为,它不仅能够减少动脉粥样硬化(atherosclerosis,As)脂质的沉积、 泡沫细胞的形成,而且还参与动脉粥样硬化 的炎症反应过程,贯穿了动脉粥样硬化 发生发展的多个环节。动脉粥样硬化是引起冠心病的主要病因,因而以ABCA1为切入点是目前研究防治动脉粥样硬化从而减少冠心病发生的热点【9】。因此,弄清楚ABCA1的结构及其作用机理,以ABCA1 为药物靶点防治动脉粥样硬化有着十分重要的意义。
尽管目前关于ABCA1和载脂蛋白ApoA-Ⅰ的直接相互作用的研究有一些报道,然而有关ABCA1的结构及其介导的脂质运输和新生HDL形成的分子机理却仍然知之甚少,与此相关的一些分子模型尚存在某些争议。值得一提的是,此前有关ABCA亚家族蛋白的结构生物学研究非常少,目前大概只有ABCA4蛋白的结构有相关报道,而且分辨率为18埃【10】。
在该项研究中,颜宁课题组报导了人源ABCA1(ATP-binding cassette transporter A1)的冷冻电镜结构,整体分辨率为4.1 Å。而ECD(extracellular domains)区域在经过soft mask处理后,分辨率提升至3.9 Å。
该研究首次揭示了ABCA1的高分辨率三维结构(未结合ATP/nucleotide-free),其中的ECD区域更是从未在任何其它ABC转运蛋白结构中被观察到过。该重要成果为进一步厘清ABCA1的分子机制提供了极为关键的结构基础。
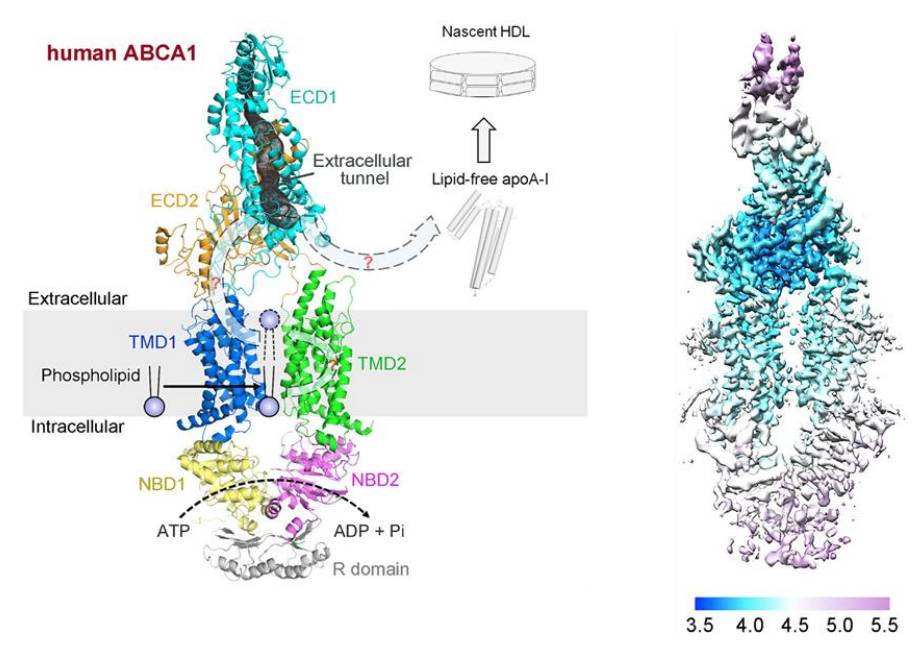
乍一看,人源ABCA1好似一个火炬,ECD区域位于上方的火焰部分,而下方的TMD(transmembrane domain)区域、位于胞内的NBD区域(nucleotide-binding domain)和R domain则共同组成了火炬的把手部分。由于ECD区域和TMD区域的分辨率较高(约为3.5-4.5 Å),研究人员得以通过全新建模(de novo model building)的方式确定1,065个氨基酸的侧链位置以及330个氨基酸主链的空间走向(ABCA1共含2,261个氨基酸)。相比之下,ABCA1胞内结构域的分辨率则较低(约为4.5-5.5 Å)。该模型中的NBD1和NBD2的结构实际为ABCG5/G8(与ABCA1同属于type II ABC转运蛋白)的NBD区域的晶体结构;而位于整个结构最下端的R domain的结构则是由结构预测算法I-TASSER所生成。幸运的是,上述结构皆可很好地对接(dock)入ABCA1胞内域的电子云密度图中。此外,研究人员还成功解析了7个糖基化位点处的糖链结构。
本文报导的ABCA1的冷冻电镜结构是ABCA亚家族转运蛋白的的第一个高分辨率结构(2013年有课题组报导了牛源ABCA4的负染电镜结构,但分辨率仅为18 Å)。这使得研究人员得以清楚地观察到ABCA1有别于其它大多数ABC转运蛋白的结构细节,例如:
1.ABCA1的TMD区域在未结合ATP的情况下呈现出朝外结构(outward-facing conformation),而此前所报导的未结合ATP的其它ABC转运蛋白的TMD区域则全部呈现出朝内结构(inward-facing conformation);
2.TMD1及TMD2独立折叠(type II ABC转运蛋白的主要结构特征),而不像其它type I ABC转运蛋白的TM区域具有交替折叠现象(TM swapping);
3.两个NBD区域在未结合ATP时也相互结合,而不像其它多数type I ABC转运蛋白在未结合ATP时相互分离;
4.ABCA1具有一个很大的ECD区域,由顶盖(lid)、疏水性通道(hydrophobic tunnel)、以及底座(base)组成,这一中空构象以及该通道的疏水性都可能与储存及转运脂类底物有关。
这些构象特征都表明ABCA1很有可能使用了与众不同的“lateral access”方式来对底物进行转运,而非其它ABC转运蛋白所使用的“alternating-access”方式。此外,该高分辨率结构也帮助研究人员顺利定位了许多导致ABCA1功能异常的突变,并对其背后的分子机理做了相应的解释。
随后,通过对该结构模型的深入分析,研究人员提出了一个基于“lateral access”原理的详细转运模型。首先,TMD1区域中靠近胞内的极性团簇(polar cluster)可以与磷脂双分子层中位于内层的底物(如磷脂)的极性头部相互作用,并在NBD区域及TMD区域的协同作用下将底物招募至TMD1与TMD2之间的空腔。其后,底物被翻转(flop)至磷脂双分子层的外层,并被转运至ECD区域中的一个疏水性通道(hydrophobic tunnel)中。最后,底物离开该疏水性通道,被ABCA1呈递给ApoA-Ⅰ,从而生成HDL(完成上述步骤的能量来自于ATP与NBD区域的结合及水解过程)。有意思的是,在极性团簇附近与疏水性通道中均观测到了可能来自底物/去垢剂的电子密度,进一步佐证了这一模型。
该研究成果极大地加深了我们对于ABCA1结构及功能的认识,但其转运过程中仍有许多细节有待于通过后续研究来阐明:
一是ABCA1结构的分辨率仍需进一步提升以获得完整的原子分辨率结构,但由于该蛋白结构柔性较高(NBD区域在结合ATP前后、ECD区域和TMD区域在转运底物时都很可能会发生大范围的构象变化),如何获得结构均一性更好的样品将是提升分辨率的主要难点之一;
二是ABCA1对底物的转运是一个动态过程,某些中间步骤很可能转瞬即逝。仅使用结构生物学技术可能难以完全捕获这一过程中的所有步骤,应该还需要结合生物化学、生物物理学等多种技术手段加以阐明;
三是ABCA1将底物呈递给ApoA-Ⅰ的具体机制还不清楚。由于ABCA1、底物、以及ApoA-Ⅰ的协同作用尚未被完全表征,可能需要先通过更深入的生化乃至细胞生物学等研究手段来阐明这一呈递过程的具体分子机制,才能够更好地帮助研究人员制备高质量的复合物样品,用于后续的结构生物学研究。
撰文:聂焱(上海科技大学免疫化学研究所Roger Kornberg课题组Co-PI)/丁广进
来源:BioArt
· END ·






