免疫相关性肺炎
ICPi相关性肺炎是一种起病方式多样,临床、影像和病理表现各异的毒副反应;可见于抗PD-1/PD-L1单抗治疗,而抗CTLA4单抗治疗时偶有发生。但当抗CTLA4单抗与抗PD-1/PD-L1单抗联合使用时则更为常见。据报道,单用抗CTLA4单抗治疗时,有多个病例出现了明显的危及生命的呼吸系统事件。急性间质性肺炎或弥漫性肺泡损伤综合征(diffuse alveolar damage syndrome,DADS)是其中最为急迫、危及生命的事件[55],另外还有有机化性肺炎(organising inflammatory pneumonia)和一种肉瘤样肺肉芽肿病,导致与疾病进展很难进行区分[56–58]。罕见情况下,尽管应用免疫抑制药物,肺炎仍进一步恶化,因合并感染或疾病进展而危及生命。
据报道,在抗PD-1/PD-L1单抗治疗的病例中,咳嗽、呼吸困难等呼吸系统不良事件发生概率高达20%~40%,其中,2%~9%的患者有3~4级的咳嗽、1%~2%的患者有3~4级的呼吸困难。肺炎的发生率为2%~4%,其中1%~2%为3级及以上,致死性肺炎的发生率为0.2%,由于肺炎导致治疗中断的发生率为0.2%~4%[6, 7, 62–65]。由于缺乏直接对比的结果,到目前为止还没有令人信服的证据表明抗PD-1和抗PD-L1药物在呼吸系统不良事件的发生率方面存在显著差别[63]。
不断有回顾性分析和大型前瞻性研究及其后续的扩展队列研究报道免疫相关肺毒性的数据,尤其是在黑色素瘤、NSCLC和肾癌的研究中。但是,到目前为止,对免疫相关性肺炎的认识仍然欠缺。
尽管肺部不良事件在多数情况下与疾病进展有关,尤其是在存在肺原发肿瘤和肺转移瘤时,但是任何新发的呼吸系统症状都应谨慎评估,以排除存在肺毒性的可能。所有出现肺部症状的患者,如上呼吸道感染、新发的咳嗽、喘气或呼吸困难,都应该完善CT检查。因为一直有致死的和危及生命的肺炎病例被报道,因此必须密切监测所有呼吸系统症状或体征。
发生率
据多个黑色素瘤的临床试验报道,相比ipillimumab单一治疗的患者,接受抗PD-1治疗的患者肺炎的发生率增加约1.5~2倍[12]。抗PD-1/PD-L1单抗联合CTLA4阻断剂治疗明显增加了肺炎发生的可能,一项关于黑色素瘤的3臂随机试验发现,与单药治疗相比联合治疗使各级和3级以上不良事件的发生率增加了3倍[2]。
排除了由于肿瘤和感染引起的肺炎后,一项大型多中心回顾性分析研究比较了PD-1/PD-L1单药治疗与联合抗CTLA4单抗治疗的免疫相关性肺炎的发生率[66]。在915例抗PD-1/PD-L1单药治疗的患者中,肺炎的发生率为4.6%。肺炎的发病时间从9 d到19.2个月不等,中位发病时间2.8个月,而联合治疗的患者肺炎发病时间有提前的趋势(2.7个月vs 4.6个月)。联合免疫治疗与单药治疗相比,前者肺炎的发生率更高(10% vs 3%)。黑色素瘤与NSCLC患者中肺炎的发病率总体上相近(5% vs 4%),另外在单药免疫治疗(3.6% vs 3.3%)与联合治疗(9.6% vs 7%)中肺炎的发生率也无显著差别。在所有肺炎病例中,72%的患者为1~2级,85%的患者可以通过停药和免疫抑制治疗得到缓解或治愈。肺炎的发生率与治疗的线数无关。
虽然肺炎可能在任何时间发生,但是与其他irAE相比,肺炎发生的时间相对较晚,通常是在治疗开始后的几个月。各类肿瘤中3~4级的肺炎的发生率相近,且与剂量无关;然而,在NSCLC患者中因肺炎导致的治疗相关性死亡事件更多[13, 67]。值得注意的是,这些症状的发现、诊断和处理,随着时间的推移不断改进,相关的死亡率也明显降低,因此在这方面很难进行汇总分析。重要的是,这类肺炎的影像学特点缺乏特异性,主要特征包括毛玻璃样变、原发性机化性肺炎样表现、间质性肺炎[ 55, 66, 68 ]以及过敏性肺炎的特点。
一般而言,对于这类患者的诊治,肺组织活检并非必须。然而,如果影像或临床上对肺部浸润的原因有疑问时,组织活检可能会协助诊断。活检可以帮助从上述的多种炎症的影像学改变中鉴别出是急性感染还是肺癌的贴壁或沿淋巴道播散。如果临床表现不显著,就治疗和预后而言,鉴别DADS是有帮助的。免疫治疗引起的其他形式的肺部反应并无特别之处,表现为一系列慢性炎症,推测其与机体的免疫进程相关,导致一系列的变化,如非特异性间质性肺炎、结节病样[ 69 ]或过敏性肺炎样等改变和机化性肺炎样改变。这些病变也可能是由于其他药物的毒性或者与药物无关的情况引起。尽管经支气管肺活检也可以鉴别感染和恶性肿瘤,甚至可能鉴别肉芽肿性病变和机化性肺炎,但通过胸腔镜手术进行外科肺组织活检明确诊断的机率更大。是否进行活检以选择何种活检方式取决于影像上病灶的位置和分布、胸部手术团队的技术水平以及患者个体的危险因素。如果进行活检,向完成报告的病理学家告知疾病的背景、活检的原因及诊断过程是很重要的。
此外,结合CT的影像学特征以及包含支气管肺泡灌洗的支气管镜检查有助于鉴别感染,包括潜在的机会性感染或非典型病原体所致感染,推荐给有任何症状的肺炎患者。
处理措施
对于确诊或高度怀疑是免疫相关性肺炎的患者,应该立即开始免疫抑制治疗。理想情况下,为了保证免疫抑制治疗的安全性,尤其是在出现2级及以上肺炎的病例中,应该通过支气管镜检查排除感染。如果不能准确评估感染状态,大多数情况下,对于3级及以上的肺炎病例在免疫抑制治疗的同时推荐口服或静脉注射广谱抗生素(见图9)。
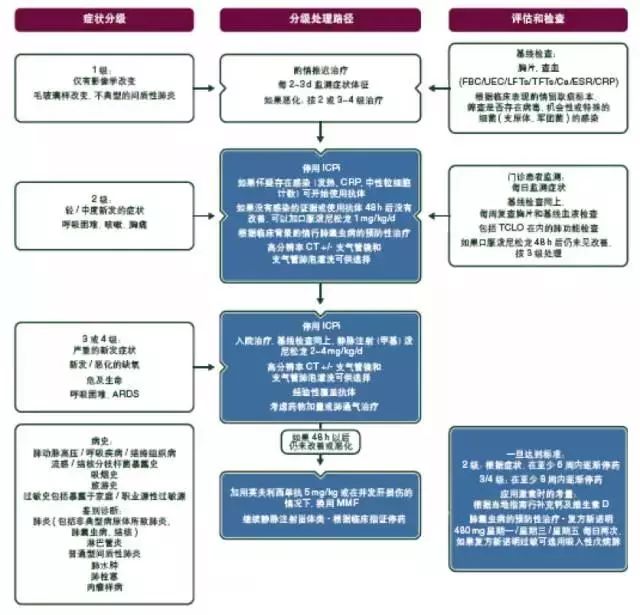
图9. ICPi相关毒性:肺炎的处理。
ARDS:急性呼吸窘迫综合征;ICPi:免疫检查点抑制剂;MMF,吗替麦考酚酯;FBC:全血细胞计数;UEC:尿素、电解质、肌酐;LFT:肝功能试验;TFT:甲状腺功能试验;ESR:红细胞沉降率;CRP:C反应蛋白;TCLO:一氧化碳转运因子。
对于1~2级肺炎,治疗包括口服甾体类药物——泼尼松1 mg/kg/d或等效药物[IV-V,B]。最初患者应该每2~3 d进行一次临床评估,理想情况下,2级肺炎的患者还应该进行影像学评估。甾体类药物应该在症状恢复后4~6周开始逐渐减量,同时推迟恢复使用ICPi的时间,直到甾体类药物的日剂量相当于每天口服10 mg或者更少量的泼尼松。对于3~4级中到重度的病例,应该收治入院,治疗方案应该包括大剂量静脉注射皮质类固醇[(甲基)泼尼松龙2~4 mg/kg/d或等效药物],永久停止使用免疫治疗[IV–V, B]。在皮质类固醇治疗2 d后,患者一般状况或者影像学上仍然没有好转,应当加用免疫抑制剂治疗方案[55, 70, 71]。可选择英夫利西单抗、MMF或者环磷酰胺。甾体类药物的减量应该非常缓慢谨慎,应该超过6周甚至更久;已有甾体类药物减量期间肺炎复发的报道,再次免疫治疗的患者中复发的可能性增大[66]。
罕见的免疫相关毒性
神经系统毒性
据报道,神经系统相关不良事件的发生率为1%。然而,最近一项包含59项试验共9208例患者的研究报道其发生率略高:接受抗CTLA4单抗治疗的患者为3.8%,接受抗PD-1单抗治疗的患者为6.1%,接受抗CTLA4和抗PD-1单抗联合治疗的患者为12%;发病时间在6~13周之间。包括一系列的神经系统事件,如多神经病、面神经麻痹、脱髓鞘、重症肌无力、格林-巴利综合征、可逆性后部白质脑病、横贯性脊髓炎、肠神经病、脑炎和无菌性脑膜炎。排除由于潜在肿瘤进展、癫痫发作、感染和代谢紊乱导致的神经系统损害是至关重要的一点。根据临床表现和中枢神经系统的影像学表现,神经传导检查和腰椎穿刺术可以辅助诊断。建议尽早咨询神内科医生。
除了轻度(1级)神经系统症状,在确定不良事件发生的原因之前[V, B],应该停止ICPi治疗。对于症状轻微者应考虑使用泼尼松龙0.5~1 mg/kg。对于有明显神经系统毒性的患者[V, B],应采取大剂量甾体类药物治疗,通过口服泼尼松龙(1~2 mg/kg)或者静脉注射等效药物。此外,血浆置换或静脉注射免疫球蛋白(Ig)可用于肌无力和格林-巴利综合征[V, B](见图10–12)。
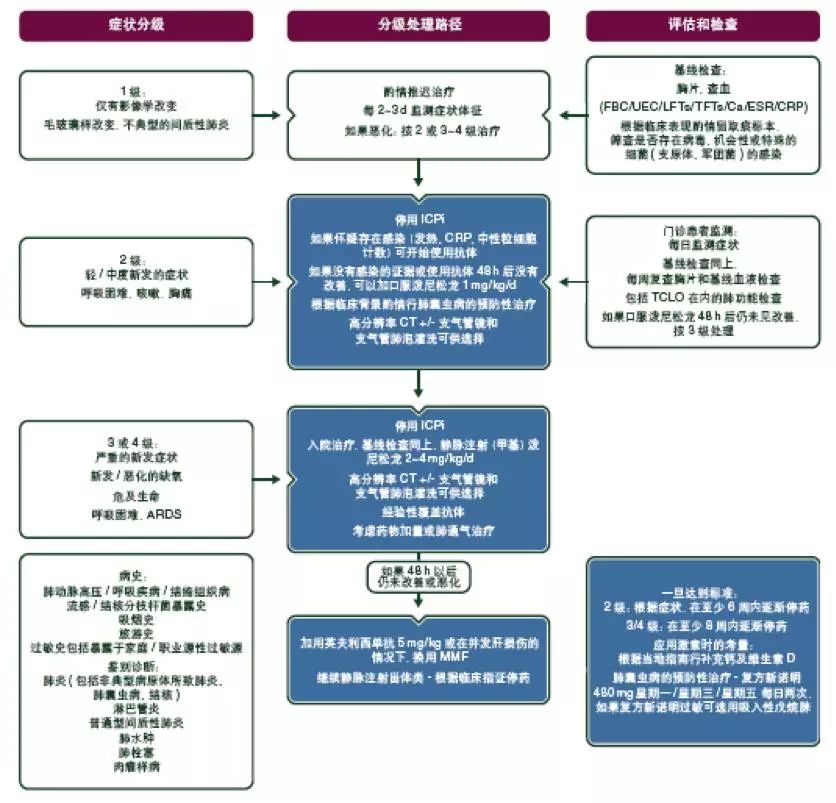
图10. ICPi相关毒性:疑似外周神经毒性的处理。
ICPi,免疫检查点抑制剂;HIV,人免疫缺陷病毒;TSH,促甲状腺激素;MRI,磁共振成像;MRA,磁共振血管造影;NCS/EMG,神经传导研究/肌电图。
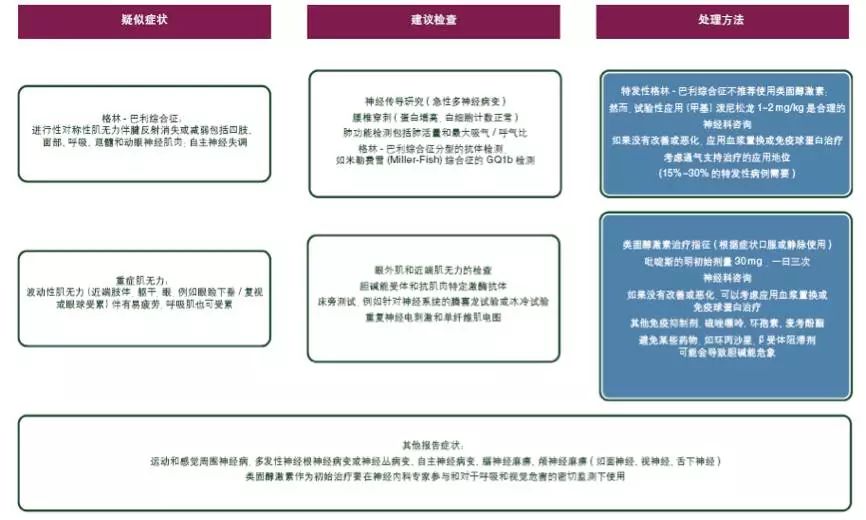
图11. ICPi相关毒性:疑似外周神经毒性的处理;ICPi,免疫检查点抑制剂。
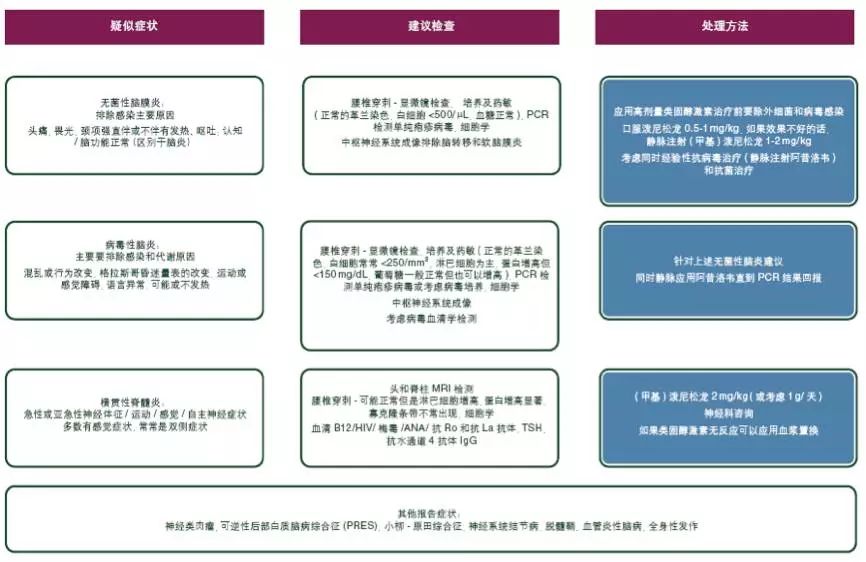
图12. ICPi相关毒性:疑似中枢神经毒性的处理。
ANA,抗核抗体;HIV,人免疫缺陷病毒;ICPi,免疫检查点抑制剂;IgG,免疫球蛋白G;MRI,磁共振成像;PCR,聚合酶链反应;TSH,促甲状腺激素。
心脏毒性
Ipilimumab、pembrolizumab、nivolumab治疗后,心脏不良事件发生率虽然不足1%,但是据报道其毒副作用的表现形式多样,包括心肌炎、心包炎、心律失常、心肌病和心室功能损害[72–75]。然而,与单独使用nivolumab(0.06%)相比,联合使用ipilimumab和nivolumab(0.27%)的心脏毒性发生率更高。推荐尽早咨询心内科医生。大剂量皮质类固醇激素可以有效治疗心脏不良事件,当怀疑是检查点抑制剂诱发的心脏不良事件时应尽快使用。如使用甾体类药物以后症状没有迅速缓解[V, B],可在必要时加用其他的免疫抑制药物,如英夫利西单抗、MMF和ATG。
风湿免疫毒性
2%~12%的患者发生轻度或中度的肌痛及关节痛,更常见于抗PD-1单抗治疗的患者[76]。也有患者表现为脉管炎、多肌炎、肌炎和颞动脉炎等[73]。对于轻中度症状,推荐使用对乙酰氨基酚和/或非甾体类抗炎药止痛[V,B]。除此以外, 10~20 mg/d的泼尼松龙或者等效药物对中度的症状可能有缓解作用。症状严重者应该尽早咨询风湿科医生,同时考虑应用大剂量皮质类固醇激素和TNFα-受体阻断剂[V, B](见图13)。
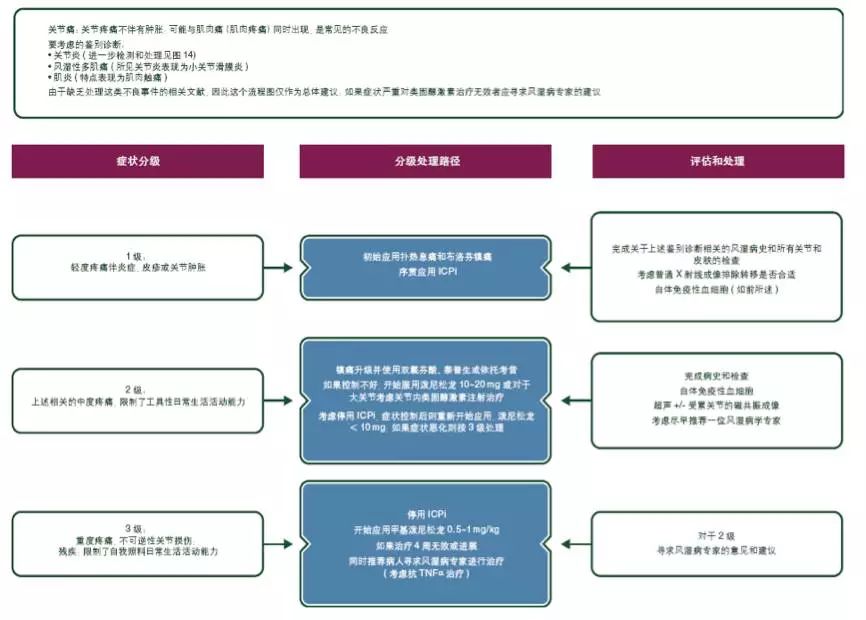
图13. ICPi相关毒性:关节痛的处理; ICPi,免疫检查点抑制剂;TNFa,肿瘤坏死因子α。
肾毒性
肾功能不全较少见于ipilimumab和抗PD-1单抗治疗的患者,发生率不足1%[77]。在联合使用ipilimumab和nivolumab时发生率会增加,达4.9%,其中1.7%出现3~4级的肾毒性。同样,ipilimumab和nivolumab的序贯疗法也使肾毒性的发病率增加到5.1%,其中2.2%出现3~4级肾炎[78]。在每次使用ICPi之前,都应该检测血清钠、钾、肌酐和尿素氮,并且通过停用肾毒性药物(包括非处方药)、排除感染和尿路梗阻以及纠正低血容量来达到早期控制肾功能紊乱的作用。当发生严重的肾功能不全时应该停用ICPi并且考虑给予系统性皮质类固醇治疗[0.5~2 mg(甲基)泼尼松龙或者等效药物] [V, B]。发生严重肾功能不全时应该咨询肾内科医生。当鉴别诊断困难时,肾活检也许可以辅助诊断[V, B]。在一系列使用ICPi期间发生了急性肾损伤并行肾脏活检的患者中,最常见的病例特征是伴随淋巴细胞浸润的急性肾小管间质性肾炎[79]。最近,有人报道了1例胸腺上皮癌的患者经pembrolizumab治疗后发生了严重的抗中性粒细胞胞浆抗体相关的急进性肾小球肾炎的病例[80]。与其他器官的组织病理学发现一样,约有1/4的患者存在肉芽肿性病变,并且有1例患者发生了血栓性微血管病(见图14)。















