
美国当地时间5月9日上午,
霍华德休斯医学研究院(
Howard Hughes Medical Institute,
HHMI
)的官方网站公布了第二批
“
科学家早期生涯项目(Early Career Scientist Program)
”入选者名单,其中我国共有7名科学家入选,他们分别是:中科院生物物理所
李国红
研究员和
王艳丽
研究员、清华大学生命科学学院
颉伟
研究和医学院
祁海
研究员、北京大学分子医学研究所
刘颖
研究员、中科院上海生化与细胞研究所
陈玲玲
研究员、中国科学院古脊椎动物与古人类研究所
付巧妹
研究员(
详见下图
)。他们将获得HHMI为期5年的资助,总资助经费为65万美元。

上述7位入选者在各自的研究领域都非常优秀,
非常值得一提的是,
有三位是80后(
颉伟、刘颖、付巧妹
),其中最年轻的付巧妹出生于1983年,最近她还入选了第十三批国家“千人计划”青年项目(
公示名单
),回国建立实验室还只有不到一年半的时间,去年还入选《自然》杂志评选的十位中国科学之星。此外,还有一点应该注意到的是此次有4位女性科学家入选,而上一届只有两位,这充分展示了中国生命科学领域女性科学家的魅力与中流砥柱作用。
据悉,入选第二批HHMI
“
科学家早期生涯项目
”的41科学家来自16个国家,是从
1500余名候选者中脱颖而出,我国成为入选者最多的国家。
早在2012年,我国共有7名科学家(
颜宁
、
邵峰
、
朱冰
、
王晓晨
、
张宏
、
唐淳
和
胡俊杰,
见下图
)获得该项目的资助(
为期五年,每人共获得65万美金资助
)。

HHMI是全球规模最大的非盈利性私立医学研究机构,
由著名飞行员,工程师
Howard Hughes
于1953年成立
。
HHMI 经过多年的发展,目前已经成为美国
最大的生物医学研究私立基金会之一 , 长期致力于支持
生物医学前沿基础研究 , 在美国抑或是世界生
物医学研究的发展中具有举足轻重的地位。
该研究所每年从来自全美大学和研究机构的提名人选中,通过严格选拔,遴选出若干最杰出的生命科学家成为HHMI研究员,无偿为其提供研究支持和资助。每位研究员每年可获得100万美金的资助,
以支持具有创造性但可能具有高风险的研究领域,并使这些科学家集中精力进行科学研究,不必再为申请基金而分心
。目前该研究所在美国共有304位研究员(HHMI Investigator),其中16人是诺贝尔奖得主(
下图
),160人是美国科学
院院士。



近年来,为鼓励美国之外的科学家从事生物医学基础科学研究,HHMI还设立了国际青年科学家项目,以资助美国以外的其它国家的杰出科学家,此前已有37位
(
International Early Career Scientist
项目科学家24位,五年共获得65万美金资助;
Senior
International
Research Scholar
项目科学家13位,
五年共获得50万美金资助
)
美国以外的其它国家的杰出科学获得了HHMI的资助。入选人员一般是已经或者具有潜力成为科研领军人才的青年科学家,而且正处于开展独立科研的初始关键阶段,一般建立实验室不超过7年。
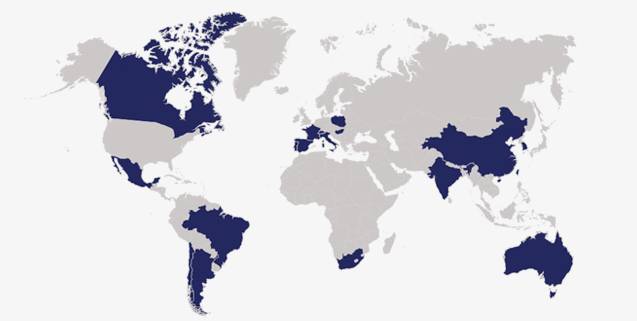
深蓝色部分表示HHMI
资助美国以外的其它青年科学家所在的国家
7位中国入选者简介:

李国红
,博士,现任中科院生物物理所研究员,博士生导师。国家“杰青”获得者、中组部“
万人计划
”创新领军人才、中科院“百人计划”入选者。现任中国科学院大学生物化学与分子生物学教研室副主任,
J Biol Chem
和
Genome Biol
杂志编委。
1995年
本科毕业于
武汉大学病毒系,2003年于德国海德堡大学获得博士学位。先后在美国新泽西医科大学和纽约大学医学院霍华德休斯医学研究所(HMMI)从事博士后研究。2010年全职回到
中科院生物物理所
生物大分子国家重点实验室担任PI。
李国红研究员长期致力于染色质高级结构与表观遗传调控的研究。主要贡献包括利用染色质体外组装体系和冷冻电镜三维重构技术,解析了30nm染色质纤维的高分辨率结构,发现了全新的30nm染色质纤维左手双螺旋结构模型;阐明了重要组蛋白变体CENP-A和H3.3特异识别和装配,以及它们调控染色质高级结构与功能的分子机理。2010年回国后以通讯作者/共同通讯作者在
Science, Dev. Cell, Mol. Cell, Nat Struct Mol Biol, Genes & Dev
(2篇)
, eLife, Nature Communications
等杂志发表研究论文10多篇。

王艳丽
,博士,
现任中科院生物物理所研究员,博士生导师,入选中科院“百人计划”。1992年进入武汉大学生命科学学院微生物专业学习,
2004年博士毕业于中国科学技术大学,2006-2011年美国斯隆-凯瑟琳癌症研究中心Dinshaw J Patel 实验室博后,2011年起回国
任中科院生物物理所PI。
主要从事于CRISPR/Cas系统的作用机理和小分子介导的基因沉默的结构生物学研究。近期成果包括成功解析了分辨率为3埃的
E.coli
Cascade复合物结构,揭示了由11个Cas蛋白以及一个61核苷酸的crRNA共同组成的分子量为405kDa的Cascade复合物的精确的组装方式,揭示了CRISPR作用的分子机理,同时也为进一步了解靶标的识别机制提供了新的见解(Zhao et al.,
Nature
,2014);解析了Cas1-Cas2与多种类型DNA的复合物的晶体结构,发现了Cas1-Cas2识别外源入侵DNA分子机制,揭示了外源核酸片段的长度是如何确定的,同时也解释了该阶段中的核心蛋白Cas1和Cas2各自的功能,该成果为揭示原核生物这一新的抵御病毒及遗传物质的入侵的机制奠定了重要的理论基础(Wang et al.,
Cell
,2015);解析了嗜热菌Argonaute(TtAgo)和5磷酸化引导DNA(gDNA)和一系列靶点DNA三元复合物的晶体结构,在结构生物学水平阐明了细菌的Agos蛋白指导导向DNA双链切割靶标DNA双链的机制,这一发现在分子生物学水平也证明了细菌通过Argonaute蛋白介导的DNA干扰机制来对抗转座子和可移动的遗传原件(Sheng et al.,
PNAS
,2014);解析了AcrF3以及AcrF3-Cas3复合物的结构,阐述了AcrF3在对抗CRISPR/Cas系统发挥的作用,揭示了病毒与细菌在长期进化中形成的相互拮抗的作用机制(Wang et al.,
Cell Research
,2016);解析了结合有sgRNA的C2c1晶体结构(
Liu et al.,
Mol Cell
,2016
);解析Ⅵ型CRISPR-Cas系统C2c2-RNA复合物结构(
Liu et al.,
Cell
,2017
);合作发现细菌Argonaute蛋白生成和加载DNA引导链的分子机制(
Stwarts et al.,
Mol Cell
,2017
)。曾获得第十三届“中国青年女科学家奖”和“第九届谈家桢生命科学奖(创新奖)”。

颉伟
,博士,现任清华大学生命科学学院研究员,清华-北大生命科学联合中心PI,中组部“青年千人”,国家“优青”获得者。颉伟研究员
1981年出生,1999年成为甘肃省理科状元,2003年本科毕业于北京大学生物科学专业,2008年在美国加州大学洛杉矶分校完成生物分子学博士以及统计学硕士(双学位)学习,并于2009-2013年在美国Ludwig癌症研究所(UCSD)任兵教授实验室进行博士后研究。2013年入选中组部青年千人计划,并加入清华大学生命科学学院任研究员,同时入选清华-北大生命科学联合中心PI。
颉伟课题组同时应用实验生物学和计算生物学研究细胞命运决定中的表观遗传调控和人类疾病相关的表观遗传调控机理。颉伟研究员2013年起到清华建立自己的实验室,
2014年获得“求是杰出青年学者奖”,
2016年连续发表多篇重要论文(包括两篇
Nature
和两篇
篇
Mol Cell
)报道了哺乳动物着床前胚胎染色质动态调控图谱和小鼠植入前胚胎发育过程中的组蛋白修饰图谱(入选BioArt评选的“2017中国生命科学十大进展”,详见:
BioArt推选出2016年度“中国生命科学十大进展”丨岁末钜献
),以及揭示TET蛋白通过亚型转换调控代间表观遗传记忆机制。
目前,颉伟老师以第一作者或者通讯作者身份在
Cell、Science、Nature
和
Mol cell
等高水平期刊上发表研究性论文多篇,谷歌学术显示总引用数超过4000次。详见:
【学术重磅】清华颉伟组和同济高绍荣组在《自然》发表“背靠背”论文,揭示早期胚胎发育的表观遗传图景
;
清华颉伟组在《自然》长文报道哺乳动物着床前胚胎染色质动态调控图谱
。

祁海
,教授、博士生导师。1996年毕业于北京医科大学(现为北京大学医学部),2003年获得美国德克萨斯大学加尔维斯顿医学分部(University of Texas Medical Branch, Galveston)实验病理学博士学位,2003-2009年在美国国立卫生研究院(NIH)传染病与变态反应病研究所免疫实验室博士后,2009年回国任职清华大学医学院,2015年晋升为清华大学教授。祁海教授还是教育部“长江学者”特聘教授、国家自然科学基金委“杰出青年”,科技部“973”项目首席科学家,在2014年入选科技部创新人才推进计划“中青年科技创新领军人才”(万人计划),2015年获第八届谈家桢生命科学奖创新奖,2016年获得第十一届华人生物学家协会青年奖。祁海教授综合运用分子与细胞免疫学手段、基因工程小鼠模型以及基于双光子显微镜的活体动态成像技术,致力于研究免疫细胞相互作用、粘附、迁徙以及反应性组织结构生成的机制,同时探索这些机制在诸如先天性免疫缺陷及自身免疫病等免疫病理过程中的作用。近年来,祁海教授以通讯作者身份在包括
Nature、Science、Nature Communication、JEM、Cell Report
等杂志上发表多篇高水平研究性论文。此外,祁海教授还在
Nature Review Immunology、Annual Review of Cell and Developmental Biology、
Current Opininon in Immunology
杂志上发表特邀综述。今年4月13日,祁海课题组以长文形式在
Science
杂志上在线发表了题为“Ephrin-B1-mediated repulsion andsignaling control germinal center T-cell territoriality and function”的研究论文,该研究发现了一种维持抗体免疫应答正常运转的新机制,有助于为抗艾滋病和针对其它病毒的抗体疫苗研发开拓思路。

刘颖
,博士,研究员,现任北京大学分子医学研究所、
清华-北大生命科学联合中心
PI,中组部“青年千人”。刘颖研究员
2006年毕业于南京大学生物化学系,2011年在美国西南医学中心获得博士学位,随后在Massachusetts General Hospital和Harvard Medical School做博士后研究,并于2014年获得哈佛中国生命科学年度杰出研究奖,同年入选中组部青年千人计划,任北大分子医学研究所研究员。主要从事于线粒体质量控制和营养感觉机制的相关研究。在
Nature, Science, Mol. Cell,Nat. Struct. Mol. Biol. , Cell Res,Mol. Cell Biol. , RNA, Toxicology
等国际知名学术期刊发表多篇研究论文。刘颖研究员回国建立实验室后迅速做出了有影响力的研究成果,其中包括2016年以封面论文形式发表在
Cell Res
杂志上的论文,揭示细胞非自主性的线粒体应激新机制。详见:
北大刘颖组封面文章揭示细胞非自主性的线粒体UPR新机制丨BioArt深度解读

陈玲玲
研究员2009年2月毕业于美国Universityof Connecticut Health Center 获得生物医学博士学位,并同时获得商学院工商管理学硕士学位。同年5月作为独立PI获得Connecticut Stem Cell Seed Award研究经费资助,受聘于University of Connecticut Stem Cell Institute 从事博士后研究,并于2010年5月起任助理教授。主要从事RNA编辑和长非编码RNA对基因表达调控和干细胞命运决定的分子机制研究。从2011年起担任上海生命科学院生物化学与细胞生物学研究所研究员,研究组长。建立独立实验室以来,在
Cell, Molecular Cell, Genes & Development, Cell Research, Nat Rev Mol Cell Biol, Trends Cell Biol, Trends Biochem Sci
等杂志上以通讯作者发表研究论文和综述论文10多篇。 目前担任国际期刊
Trends in genetics、Genome biology、Journal of Biological Chemistry
编委。陈玲玲研究组从事长非编码RNA研究,近年来揭示细胞核内非编码RNA参与基因表达调控的机制(
Genes Dev
, 2015;
Cell Res
, 2014, 2015)。也首次创建非poly(A)转录组纯化体系(
Genome Biol
, 2011),系统发现一系列新RNA分子家族,揭示其生成加工机制及生物学功能,其中包括sno-lncRNAs (
Mol Cell
, 2012;
NAR
, 2015;
Mol Cell
, 2016),内含子来源环形RNA (
Mol Cell
, 2013)及外显子反向剪接环形RNA (
Cell
, 2014)。相关研究极大地推动了长非编码RNA和环形RNA研究领域的发展。目前是国家基金委优秀青年基金获得者、中组部“万人计划”青年拔尖人才、第八届上海青年科技英才和第十一届华人生物学家协会Young Investigator Award等。今日,陈玲玲研究组又在
Cell
杂志上发表论文,究首次在人类细胞中发现了可以调控Pol I转录的长非编码RNA,并阐释了此RNA与众不同的功能,拓展了长非编码RNA的作用机制。详见:
陈玲玲组Cell首次发现调控RNA聚合酶转录的lncRNA—附专家点评丨BioArt特别推荐













