
作者:子非鱼
转载请注明:解螺旋·临床医生科研成长平台
2003年,一名富有天分且即将完成医学学业的科研者LukasWartman被不幸诊断出患有急性淋巴细胞白血病(ALL),而这种致命血癌正张牙舞爪地要收割这位年轻医生的生命。
于是一场生存之战就此打响,其中涉及了70多种药物治疗、经历了两轮细胞移植以及一连串的反复折磨。尽管干细胞移植确实帮助这位年轻医生击退肿瘤,但现在该疗法附带的慢性病正在折磨他的身体。
干细胞移植,助人死中求生
确诊后Wartman的病情在化疗的作用下得以暂缓,因而顺利从华盛顿大学医学院(WUSM)毕业的他也立刻选择从事白血病领域里的临床护理与实验研究。
但是不幸的是,5年后ALL卷土重来。而当化疗再次把癌症打回无法检测的阶段后,为了将他弟弟的骨髓移植给Wartman,医生们双管齐下,化疗和放疗齐齐上阵,对他本身骨髓细胞进行大清洗。这种粗暴但有效的方法使得逃过化疗之灾的“顽固分子”癌细胞被尽数消灭。
骨髓移植后Wartman的血细胞包括免疫系统细胞得以重建,且在不到一年时间内,他就开始全职工作并定期跑步,生活几乎已经回归到正常轨道了。但是老天总喜欢给他开玩笑,2011年Wartman体内的ALL再次死灰复燃,这次他的预后非常糟糕,毕竟是这是癌症的二次复发了。
来势凶猛的癌症让化疗的功效尽数散去,并再次化身为死神将Wartman带到了死亡的边缘。但此时WUSM基因组中心的一项基因分析再次给他点燃了生的希望,他们已确定一种治疗晚期肾癌的药物,可抑制白血病患者体内普遍存在一个过度活跃的基因。至此他才第三次死中求生。
然而,考虑到药物可能无法阻遏活跃的恶性肿瘤细胞,Wartman果断选择了第二次移植,而这次移植来自于非亲属关系捐赠者的外周血干细胞。而他在恢复健康后再次重返医生岗位,并继续通过小鼠动物模型来进行白血病实验。且每天遛两只狗狗以及每周六的6.5公里跑步也成为了他日常生活的一部分。
并发症GVHD,浮于水面的夺命杀手
虽然Wartman的ALL病情已得到缓解,但数次与死神擦肩而过的他目前又在经历另一番身体上的折磨,慢性移植物抗宿主病(GVHD,干细胞移植的副作用)硬是让他在痛苦中反复煎熬。
GVHD病发后,移植物中的免疫细胞开始反噬,并大肆攻击Wartman身体组织。他的肝脏、肺、胃肠道和生殖器都收到不同程度的损害,眼睛干燥并患有皮疹。
而肌肉的消瘦致使Wartman在一次意外的摔倒中臀部发生塌陷,并迫使他的一条腿缩短了几厘米,因而他现在的步伐非常迟缓而蹒跚。

(左)2011年3月Wartman在GVHD病发钱仍在实验室里进行科研实验。
(右)Wartman近期接受物理治疗阶段。
其实,Wartman的症状并不罕见,全球每年都有3万人接受干细胞移植,而近一半的人群会产生GVHD症状。目前,接受移植和身患GVHD的人群比例正在逐年增加,但是其治疗方法却没有保持同步,市场上甚至没有针对GVHD的特效药,这也使得GVHD的死亡率高达15%~20%。
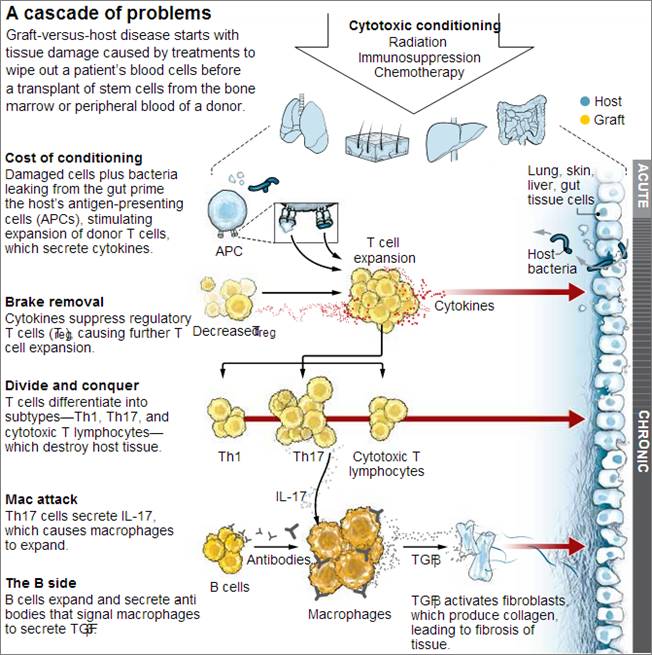
GVHD大致可分为两种:急性和慢性。急性GVHD完全是一种由T细胞介导的疾病,T细胞的疯狂扩增会任意攻击机体的肠道、肝脏和皮肤的组织并对其造成伤害。而此症状也可通过免疫抑制让T细胞能够“容忍”新的宿主。
但慢性GVHD的生物学机制仍然是模糊的,除了T细胞异常外,可能B细胞和巨噬细胞也发生了异常。高比例的Th17细胞也会通过分泌出IL- 17促使巨噬细胞增殖,而过度增殖的B细胞所产生的大量抗体,在与巨噬细胞表面受体结合后,也会促使其分泌转化生长因子β(TGF-β),进而激活产生胶原的成纤维细胞并导致组织纤维化。
最让人头疼的是,这种GVHD并不是一无是处,它的存在对抑制肿瘤复发竟也是有益处的。1979年诺贝尔医学生理奖得主E. Donnall Thomas发现在接受骨髓移植的白血病患者中,其骨髓来源于同卵双胞胎的患者肿瘤复发率要远高于骨髓来源于与之匹配但不完全相同的兄弟姐妹的患者。而这主要是因为移植物中免疫细胞的“无差别攻击”也会使得隐藏的癌细胞难以复活。
治疗与死亡,平衡点在哪儿?
因而,如何在确保GVHD的抗白血病(GVL)效应的前提下,阻遏GVHD对机体所造成的伤害就成医学者所面临的核心挑战。
目前GVHD的主要治疗方式是通过药物来降低IL-2(可促进T细胞增殖分化)的产生,同时联合使用类固醇药物。因而,Wartman也在通过高剂量的强的松(prenisone)和IL-2抑制药物tacrolimus来稳定病情,但这并不足以解决他的症状,因为GVL依赖于T细胞,所以医生们不愿完全压制活跃T细胞。
为了弥补过度预防所付出的代价,血液专家Luznik的研究团队则尝试给予移植不久的患者高剂量的环磷酰胺(一种具有免疫抑制作用的化疗药物)以寻求平衡。而这种方法也确实能抑制供体中活跃的T细胞,不仅增加了患者非匹配移植的耐受性,且已有研究也证实了该法可将严重急性和慢性GVHD的发病率降低到15%以下。因而尽管可能会增加肿瘤复发的风险,但该疗法已经逐渐赢得人心。
而改良供体移植物的另一个存有争议的方法依赖于马或兔子体内产生的一种称为抗胸腺细胞球蛋白的抗T细胞抗体。理论上,给移植前的患者注入该抗体,不仅可以减少了宿主本身残留T细胞,最大限度地降低移植排斥的风险,同时也可消除供体T细胞以防治GVHD。
另一种更有针对性的方法就是去除移植物中的特定细胞群:尚未分化为特定类型细胞的初始T细胞。匹兹堡大学医学院的研究小组通过与铁珠结合的单克隆抗体的磁性系统从移植物中去除了初始T细胞,并发现虽然这种方法对接受外周血干细胞移植的35名患者的急性GVHD没有任何影响,但却大大降低了慢性GVHD的风险,复发率持平。
澳大利亚血液学家Geoffrey Hill所带领的研究团队,则专注于另一个不良因子——IL-6,其过度分泌可导致Th17细胞增殖。
他们在治疗48名服用tocilizumab药物(治疗风湿性关节炎的单克隆抗体,可阻断IL-6受体)的移植患者过程中,发现尽管此类干预对慢性GVHD的发病率没有明显的影响,但仅仅只有12%的人患上了急性GVHD。
第二个独立小组也发表了类似的结果,动物实验表明这种疗法并不影响GVL。然而,无论是tocilizumab还是初始T细胞的清除都没有在随机研究中都证明其价值。
在尚未进行临床试验的研究工作中,Leslie Kean等人发现,GVHD患者的T细胞表面高表达OX40。猴子实验中,他们将抗体与OX40结合,并联合使用药物雷帕霉素,可降低IL-2的产生,且可大致控制GVHD:在一个高度不匹配的供体移植后的100天内,5只动物中均没有产生GVHD症状。
也许更精准识别GVHD高危人群可显著改善接受细胞移植的人的选择范围。为了寻找疾病的早期预警信号,Ferrara等人招募了近700名接受移植的患者,比较了GVHD患者与没发生GVHD患者的血液中蛋白质水平,结果发现机体内具有高浓度蛋白ST2和REG3α的患者更有可能遭受严重的GVHD和死亡。
Ferrara指出,如此可避免一些GVHD低风险的患者使用强的松(一种危险的类固醇),且能预警高危人群中并使其进行积极的治疗。更重要的是,生物标记可以帮助研究人员选择最佳的临床试验参与者。















