
导语:
在该项研究中,邓宏魁教授课题组成功实现了胚外内胚层样细胞快速扩增与命运维持,这项研究无论是对于干细胞科研领域还是再生医学治疗领域的意义都是深远而重大的。
来源:梅斯医学
作为利用化学小分子诱导体细胞向可诱导多能干细胞重编程领域的著名学者,北京大学邓宏魁教授及其团队近期又建立了一套完整可靠的小分子重编程方法[1]。
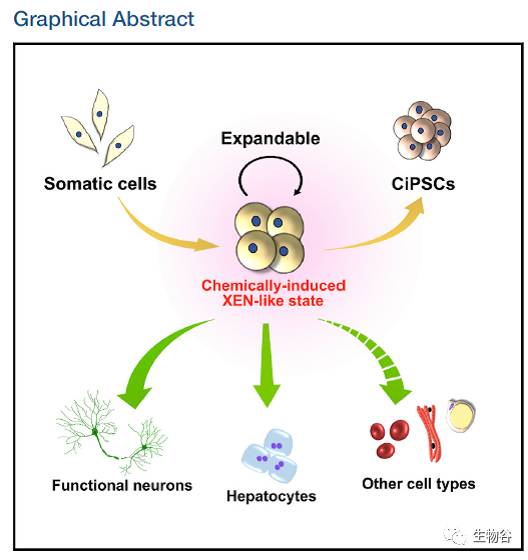
令人惊奇的是,在体细胞经化学小分子重编程为诱导多能干细胞的过程中,细胞会经历一种胚外内胚层样细胞(Extra-Embryonic Endoderm-like state, XEN-like state)中间状态[2],通过对这一中间状态细胞的详细研究发现,胚外内胚层样细胞能够像多能干细胞一样分化成部分体细胞,如功能性神经元及肝脏细胞,也有望分化产生更多类型的体细胞,如此一来,在不经历多能态(pluripotent state)下,从单一体细胞向多种体细胞的分化便成了现实。更难能可贵的是,胚外内胚层样细胞在特定培养条件下能够实现细胞命运的维持,在多次传代后(大于20代),依然能稳定地保持胚外内胚层样细胞主导基因(Sox17,Gata4,Gata6,Sall4)的表达和基因组稳定性,同时能够像低代次胚外内胚层样细胞一样分化成为功能性神经元及肝脏细胞,因此以胚外内胚层样细胞为平台,能够实现细胞的大规模扩增,为临床及科研供给不同类型的体细胞。
背景介绍
如何在体外获得具有生理功能的体细胞对于再生医学而言是个重要问题,近年来细胞系的重编程让问题的解决看到了希望。化学介导的重编程更是获得了众多研究资源的青睐[3-5]。相比于传统转基因方法介导的重编程,化学方法解决了内源基因的修改所导致的潜在致突变及致癌风险,同时化学小分子兼具了细胞膜穿透性、可逆性、可控性和易于制造等诸多优点。
邓宏魁教授课题组在近期获得了鼠源体细胞向干细胞状态化学重编程的稳定方法,该方法的第一阶段是将鼠源体细胞重编程为独特的上皮型胚外内胚层样细胞(epithelial XEN-like state),第二阶段是进一步重编程为限定型胚外内胚层样细胞(defined XEN-like state),因此研究人员可在第二阶段稳定地获取胚外内胚层样细胞。
在这项研究中,研究人员试图绕过干细胞阶段,通过胚外内胚层样细胞产生特定功能的体细胞。通过对重编程小分子化合物组合的微调,获得了稳定的神经元诱导方法。参照肝脏细胞诱导方法,肝脏细胞也能通过胚外内胚层样细胞诱导产生。研究人员同时实现了胚外内胚层样细胞命运的维持,在长时间培养及多次传代的基础上,保持了相关基因的稳定表达、细胞基因组的稳定性及分化可塑性,实现了胚外内胚层样细胞的规模化量产。
结果
化合物的微调以获得稳定的胚外内胚层样细胞
根据已经发表的文献,胚外内胚层样细胞的原始克隆可在重编程的早期阶段通过引入7种小分子化合物(VPA,CHIR99021,616452,tranylcypromine,forskolin,AM580,and EPZ004777;即VC6TFAE)获得。TD114-2和CHIR99021均为GSK3-β抑制剂,然而TD114-2已被证明具有更强的作用[6],在该实验中,研究人员将CHIR99021替换为TD114-2后发现胚外内胚层样细胞的原始克隆提高了3倍,但胚外内胚层样细胞的主导基因(Sox17,Gata4,Gata6,Sall4)的表达并未受到影响(图1 A-C),因此通过对化合物的微调,显著地提高了从体细胞到胚外内胚层样细胞的重编程效率。
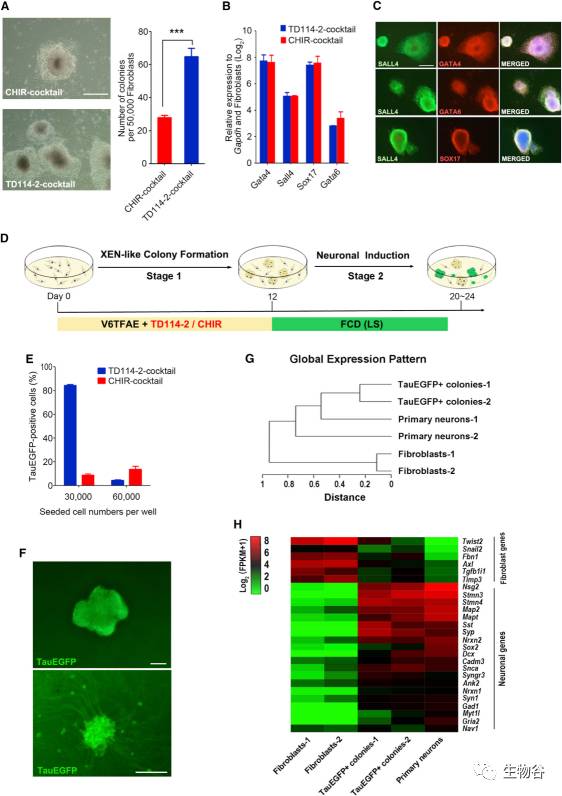
图1 化学诱导神经元的分化策略
A. 胚外内胚层样细胞的相衬图像和原始克隆的诱导效率(经TD114-2 组合或 CHIR 组合);
B. 胚外内胚层样细胞主导基因(Sox17,Gata4,Gata6,Sall4)的定量PCR分析(经TD114-2 组合或 CHIR 组合);
C. 经TD114-2 组合诱导产生的原始克隆的免疫染色分析;
D. 胚外内胚层样细胞重编程及神经元分化示意图;
E. 不同初始细胞密度下,Tau-EGFP阳性细胞的诱导效率(经TD114-2 组合或 CHIR 组合);
F. Tau-EGFP阳性细胞在进一步诱导前后的对比图;
G. 成纤维细胞、Tau-EGFP阳性细胞和初级神经元的聚类分析;
H. 成纤维细胞、Tau-EGFP阳性细胞和初级神经元的基因表达热图.
由胚外内胚层样细胞稳定地产生神经元样细胞
Tau蛋白的表达可以作为神经元生成的标志,因此研究人员制备了Tau-EGFP细胞系来实时监测神经元样细胞的产生。研究人员综合概括了不同的诱导生成神经元的实验方案,确定了Forskolin, CHIR99021及Dorsomorphin(FCD)联用的实验思路(图1 D),发现最早可于诱导的第4天出现Tau-EGFP阳性细胞,在诱导的第8-12天Tau-EGFP阳性细胞可占比50%以上,继续延长神经元诱导时间发现Tau-EGFP阳性细胞延伸出了轴突样分枝,这一现象标志着神经元的逐渐成熟(图1 F)。且通过对成纤维细胞、Tau-EGFP阳性细胞及初级神经元阳性对照的转录组测序(RNA-seq)分析表明,Tau-EGFP阳性细胞的基因表达已经完全不同于成纤维细胞,但和神经元阳性对照极其相似(图1 H)。以上结果证明,神经元样细胞能够通过胚外内胚层样细胞诱导分化产生。
诱导产生的神经元样细胞在基因表达上和初级神经元相似
为进一步探究这些诱导产生的神经元样细胞(Tau-EGFP阳性细胞)的基因表达特征,研究人员检测了典型的泛神经元标志物的表达,共免疫染色结果显示,Tau-EGFP阳性细胞同时表达了包括 TUJ1, MAP2, NF-H 在内的轴突生长共表达神经特异性蛋白(extensive neurite growth co-expressed multiple neuronal-specific proteins)(图2 A-E)。进一步实验发现,当延长神经元诱导时间至18天,Tau-EGFP阳性细胞会共表达 vGLUT1蛋白(效率为80%),共表达 GABA蛋白(效率为5%),因此可以证明Tau-EGFP阳性细胞会进一步成熟为兴奋性谷氨酸能神经元和抑制性GABA能神经元(图2 F-G)。
诱导产生的神经元样细胞的成熟及功能特性
为探究诱导产生的神经元的电生理特性,研究人员采用了全细胞膜片钳技术(whole-cell patch-clamp),在电流钳模式中,通过对细胞膜进行除极,12+12天诱导产生的Tau-EGFP阳性神经元产生了动作电位。在电压钳模式中,伴随着电压依赖性的钠、钾通道的开启,Tau-EGFP阳性神经元产生了快速内向及外向的电流。以上实验证明,胚外内胚层样细胞可被诱导成为功能性神经元细胞。
为进一步促进诱导产生的神经元样细胞的成熟,研究人员采用了与星形胶质细胞共培养的策略[7],共培养后的神经元样细胞展现了更为复杂的神经元形态,同时细胞膜电生理特性被进一步提升(图2 I-K),而且自发性兴奋性突触后电流(EPSCs)也能被检测到。令人激动的是,80%的Tau-EGFP阳性神经元同时表达了成熟神经元标志蛋白NEUN(图2 H)。此外,诱导产生的神经元的功能亚型也能被聚焦应用100mM谷氨酸引起的内向电流所确证(图2 M)。
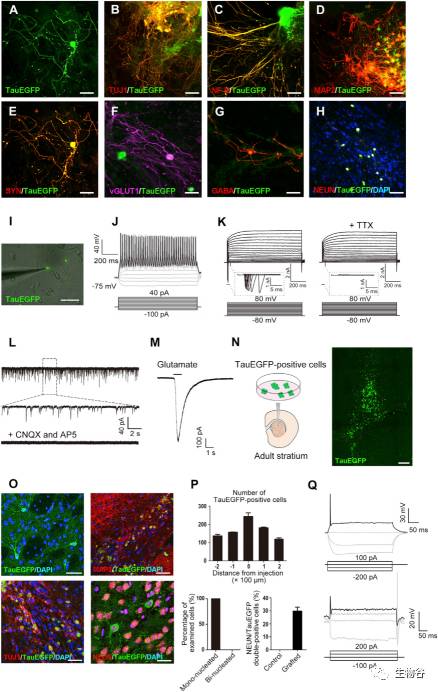
图2诱导产生神经元的特征分析
A-E.Tau-EGFP阳性神经元共表达泛神经元标志物 [TUJ1 (B),NF-H (C),MAP2 (D) 和SYN (E)];
F-H.Tau-EGFP阳性神经元共表达神经元功能亚型及成熟标志物 [vGLUT1 (F),GABA (G) 和 NEUN (H)];
I. Tau-EGFP阳性神经元与星形胶质细胞共培养后的膜片钳记录;
J. Tau-EGFP阳性神经元动作电位的发放;
K. 电压膜片钳记录了细胞的内向电流,且该电流可被河豚毒素所阻断;
L. Tau-EGFP阳性神经元与星形胶质细胞共培养后可出现自发性兴奋性突触后电流;
M. 焦点应用100mM谷氨酸触发内向膜电流;
N. 将Tau-EGFP阳性神经元向小鼠脑内移植的示意图;
O-Q. 移植后的Tau-EGFP阳性神经元能够存活并逐渐成熟,均为单核细胞,且能检测到动作电位的发放.





