编者按
器质性心脏病室速的消融一直是当前室性心律失常治疗的热点,基质消融作为前景最为光明的一类消融策略,正引起电生理界同行们的高度关注和重视。作为多项国际多中心研究尤其是室速相关研究的组织者及重要参与者之一,来自美国纽约Montefiore电生理中心的Luigi教授及其团队对器质性室速的基质消融策略相关进展做了荟萃分析和归纳总结,文章发表在2017年
Card Electrophysiol Clin
(临床心电生理)杂志上,层次清晰,内容详尽,我们第一时间将其翻译并分为上、下篇分享给广大电生理同行。
引 言
室性心律失常(ventricular arrhythmias,VAs)是缺血性心肌病(ischemic cardiomyopathy,ICM)最常见的死因之一。通过植入埋藏式除颤器(implantable cardioverter-defibrillator,ICD)可以降低这部分患者的死亡风险,但这仍有局限之处,因为目前尚无证据证实ICD可以充分保护患者免于致命性室速(ventricular tachycardia,VT)的威胁。即便ICD延长了患者存活率,频繁的放电也会降低其生活质量、使其再次住院并增加死亡率。
导管消融(catheter ablation,CA)及抗心律失常药物(antiarrhythmic drugs,AADs)可以减少ICD放电次数,改善VT患者的生存率。不过临床数据证实,AADs并未表现出生存率方面的获益,因而在减少ICD放电方面仅为次选。近期发表的VANISH(Ventricular Tachycadia Ablation versus Escalation of Antiarrhythmic Drugs)研究结果证明,对于因ICM植入ICD后反复发作VT的患者,与ADDs保守治疗相比,导管消融可显著降低死亡复合终点、VT电风暴、ICD不恰当放电的发生率,充分体现了VT导管消融的重要性。不过VT消融治疗尚处于不断发展阶段,通常需要1次以上的手术才能提高成功率。
因此近年来随着更为先进的心脏标测系统的出现,在传统消融(standard ablation)方法的基础之上,基质消融(substrate-based ablation)已逐渐成为更好的方案选择之一。尽管基质消融的理念已广为接受,但不同临床研究所关注的异常电位特征也不尽相同,导致不同基质定义在实现消融目标上出现殊途同归的局面。因此有必要对VT的不同基质定义及相应消融策略进行归纳总结。
基质标测及室速消融
指导VT消融的标测技术取决于VT的机制及其基质特征。由既往心梗引起的疤痕相关性折返是持续性VT最常见的心律失常基质。非缺血性心肌病(non-ischemic cardiomyopathy,NICM)、致心律失常右室心肌病(arrhythmogenic right ventricular cardiomyopathy,ARVC)、结节病(sarcoidosis)、扩张型心肌病(dilated cardiomyopathy,DCM)及其他病因则相对少见。疤痕相关的折返环通常很大、很复杂,并涉及多种心肌参与。导管消融的靶点正是这些折返环,其典型组成包括入口、出口及峡部(图1)。
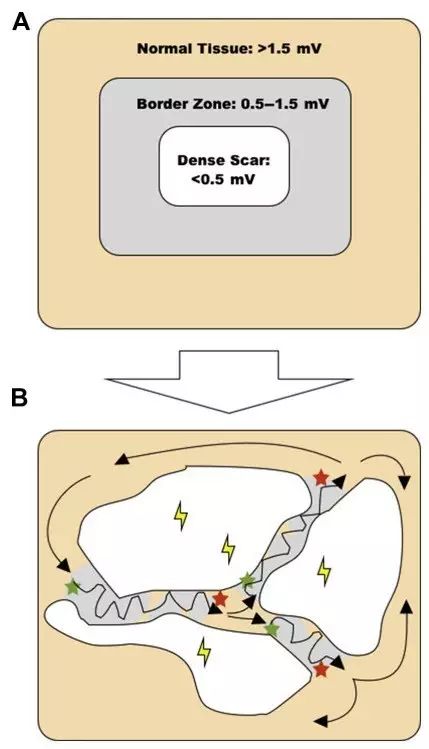
图1. A图为组织电压的定义。在心内膜面,正常电压大于1.5 mV,致密疤痕组织电压小于0.5 mV,而疤痕移行区(border zone)双极电压为0.5~1.5 mV(4 mm头端电极、1 mm极间距导管,滤波10~400 Hz)。B图为疤痕折返环示意图,绿色星号为入口(entrance),灰色区域为峡部(isthmus),红色星号为出口(exit)。该区域通常较大较复杂,涉及不同心肌参与。另外,临床证据表明,仅消融疤痕通道(channels)的疗效并不及广泛消融(extensive ablation),因为通道之间通常存在可以导致VT的电活动(闪电符号)。基质消融应以这些异常电位为靶点
简单来说,初始标测应重点识别那些致心律失常作用的心肌组织,这主要基于2种策略(图2):1. 识别窦律下或起搏时的异常电位(基质标测);2. VT发作时的激动标测及拖带标测,用来确定折返环峡部及出口(常规标测)。我们通常需要将基质标测与激动标测及拖带标测相结合。近期研究显示,基质消融前的VT诱发及标测会延长手术时间,增加射线暴露,且往往需要电复律,而且这与单纯基质消融相比,并不提高急性期及远期成功率。
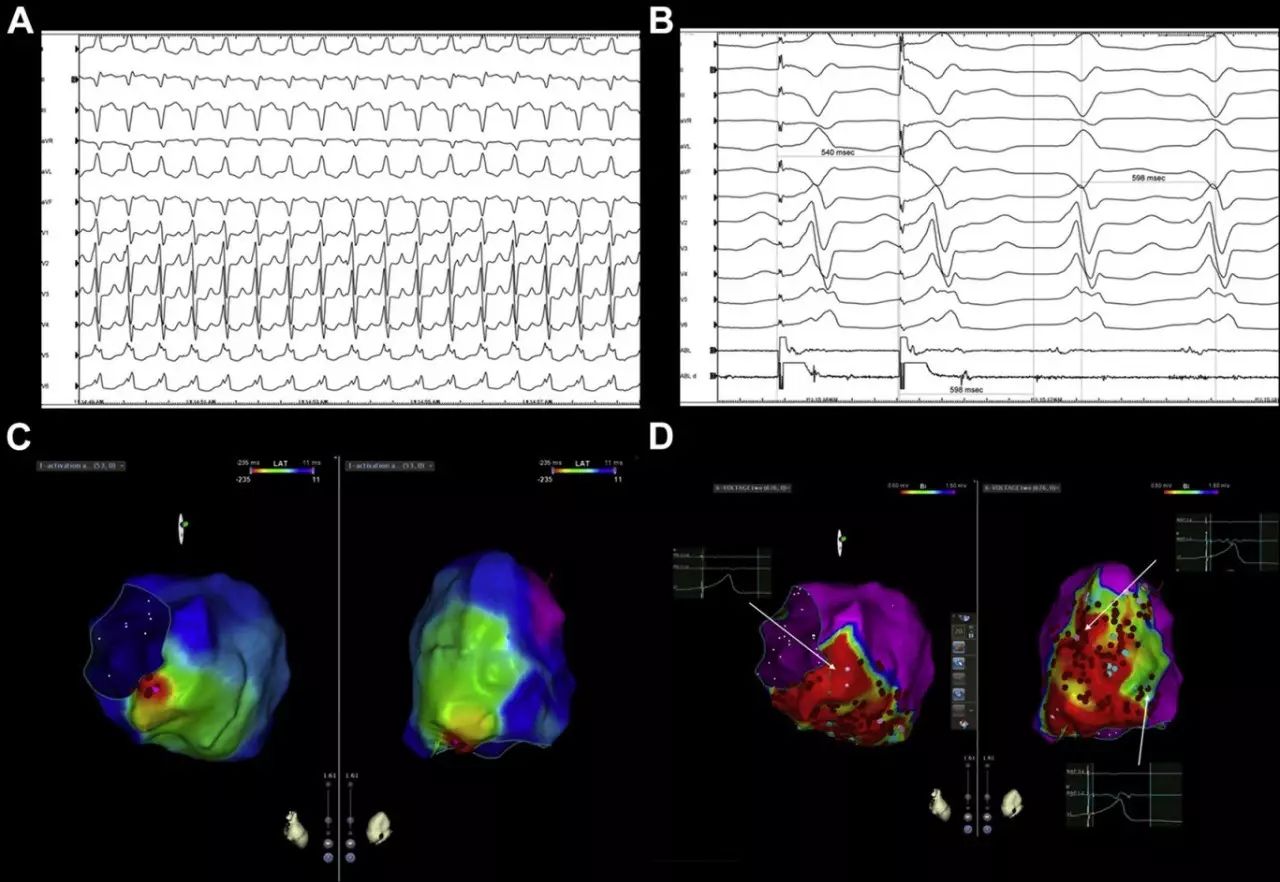
图2. 常规消融与基质消融(均质化)在同一患者中的对比。注意两种消融策略中消融点的区别。A图为临床VT的12导联心电图(胸前导联RS形,电轴偏左上),提示其起源为后间隔基底部。B图为临床VT的隐匿性拖带,起搏后间期(PPI,598 ms)与VT周长一致。C图为VT是心内膜激动标测,红色为内膜面最早激动点,紫色为心动周期中最晚激动点。红色点为消融点,跨越隐匿性拖带的峡部区域。D图为窦律下左室(LV)内膜面电压图。左侧小图箭头所指区域为没有异常电位的疤痕区,因此该处未行消融。右侧小图箭头所指处有异常电位,因此在该处消融。红色区域代表疤痕区(双极电压<0.5 mV),紫色区域代表正常心肌(双极电压>1.5 mV),其他颜色代表可能存在疤痕的异常心肌区域(双极电压在0.5~1.5 mV之间)。红色点为存在异常电位区域的消融点
基质标测的目的就是定位那些电解剖疤痕基质,即基于组织电压定量的心肌疤痕,此概念最早由宾夕法尼亚大学的Marchlinski教授等在2000年提出(图1)。心内膜面,正常电压大于1.5 mV,疤痕电压小于0.5 mV,疤痕移行区电压为0.5至1.5 mV(使用4 mm头端电极、1 mm极间距的导管,滤波10~400 Hz)。而心外膜标测时,参数设置则有所不同,通常双极信号振幅小于1.0 mV的区域定义为低电压区。在特殊情况下,内膜单极标测也有帮助,尤其是预测外膜心律失常基质时,如扩张型心肌病患者中,LV正常组织电压通常≥8.27 mV,而ARVC患者右室正常组织电压常≥5.5 mV。
VT基质消融最早的先驱之作要追溯到1970年代的Josephson及其同事,其通过基于内膜下切除的外科方法,可使反复发作的VT达到80%的远期治愈率。随后,正如前面所说,随着技术的不断改进,基质消融越来越被广泛接受。自此的几项研究均证实,VT的基质消融优于常规消融。
为进一步证实基质消融的优越性,Luigi教授对结构性心脏病(structural heart disease,SHD)患者VT基质消融与常规消融对比的数项研究进行了荟萃分析。该分析共入选6项研究(共396名患者),平均随访24±15个月,评估其VA复发、全因死亡及其复合终点(图3)。结果提示,基质消融可较常规消融减少VA复发/全因死亡(
RR
0.57,95%
CI
:0.40~0.81)。在血流动力学稳定性VT患者中,单独分析VA复发或全因死亡时,尽管未得到显著差异,但趋势有利于基质消融(VA复发
RR
0.68,95%
CI
:0.40~1.15;全因死亡RR间期
RR
0.56,95%
CI
:0.29~1.09)。这些初步研究结果均提示了基质消融的优越性。
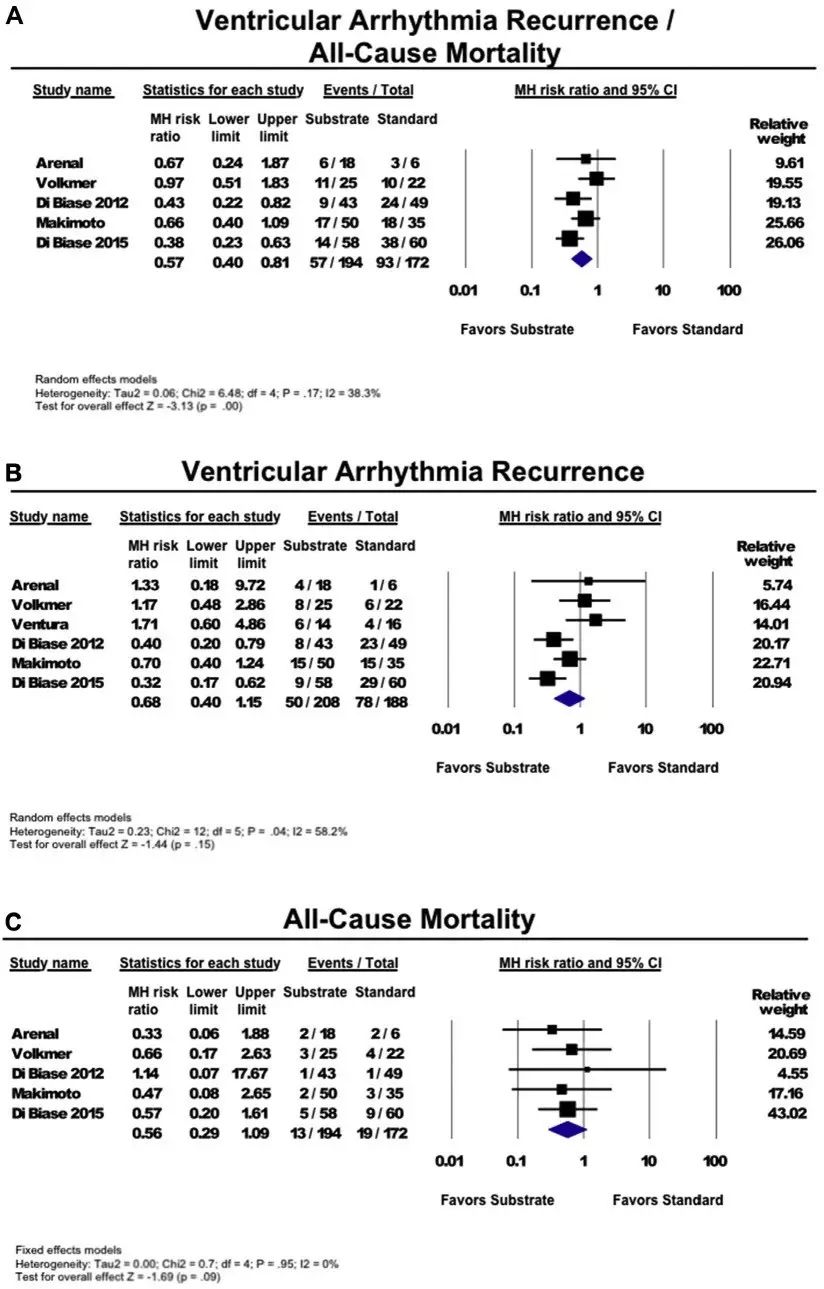
图3. SHD患者VT基质消融对比常规消融的荟萃分析。A图为VA复发/全因死亡的复合终点;B图为VA复发,C图为全因死亡。(SHD,结构性心脏病;VA,室性心律失常;CI,可信区间)

Card Electrophysiol Clin, 2017 Mar, 9(1):81-91.
编译:杜先锋、方任远
未完待续

to be continued
《书心剑律》

门诊新视野






