
ACE2/Apelin
信号在心血管系统中的调控作用及相关靶向治疗药物
程玉文
1,2
,张振洲
1,2
,
余俊贤
1,2
,钟久昌
1,2
*
(1. 上海交通大学医学院附属瑞金医院医学基因组学国家重点实验室,上海 200025;2. 上海市高血压研究所高血压重点实验室,上海 200025)
[
摘要]
高血压等心血管疾病已成为人类死亡的首要病因。研究表明ACE2/apelin 信号发挥重要的心血管保护作用,其参与心血管增殖、凋亡、分化、炎症、氧化应激及血压调控,主要依赖于3 条路径:ACE2-Ang-(1-9)-AT
2
轴、ACE2-Ang-(1-7)-Mas 轴及apelin-APJ 轴。ACE2/apelin 信号活性和表达异常是促进高血压、冠心病、心力衰竭等心血管疾病发生、发展的重要因素。综述ACE2/apelin 信号在心血管系统中的调控作用及其作为潜在药物靶点的研究新进展。
[
关键词]
血管紧张素转换酶2;apelin;高血压;心力衰竭;肾素-血管紧张素-醛固酮系统
肾素
-
血管紧张素
-
醛固酮系统(
renin-angiotensinaldosteronesystem
,
RAAS
) 和
apelin/APJ
受体系统是调控心血管生理功能的重要内分泌系统,其活性异常参与高血压、动脉粥样硬化及心力衰竭等心血管疾病的发生、发展。
2000
年,血管紧张素转换酶
2
(
angiotensin-converting enzyme 2
,
ACE2
) 的发现为
RAAS
研究注入了新的活力,开辟了
RAAS
相关药物靶点研究的新方向。作为
RAAS
的关键酶,
ACE2
可通过调节血管紧张素Ⅱ(
angiotensin II
,
Ang II
)和
apelin
的生成维持心血管功能稳态。
ACE2
和
apelin-APJ
轴均可拮抗
Ang II/Ang I
型受体(
angiotensin type I receptor
,
AT
1
)的作用。
ACE2/Apelin
信号不仅维持生理条件下心血管系统的正常发育,还可在病理条件下发挥重要的心血管保护作用。本文就近年
ACE2/apelin
信号在心血管系统中的调控作用及其潜在药物靶点作一综述,旨在为相关药物开发提供新的方向和理论依据。
1
肾素- 血管紧张素- 醛固酮系统
作为
RAAS
的最主要成员,
Ang II
对心血管细胞增殖、凋亡、分化及水盐代谢等具有重要的调控作用。
Ang II
通过分布于不同组织上的相应受体介导多种生物学功能,其主要受体包括
AT
1
和
AT
2
,均属于
7
次跨膜的
G
蛋白偶联受体,且在体内的分布呈组织特异性。
AT
1
受体主要分布于成人的心血管组织,
AT
2
受体在胚胎发育时高表达,出生后表达下降,但两者在脑、肾和肾上腺均有表达。
AT
1
受体主要介导血管收缩、血管生成、基质合成、醛固酮的合成和释放;
AT
2
受体约
有
34%
的氨基酸序列与
AT
1
受体一致,其绝对表达受到
Ang II
和一些生长因子的调控。
ACE2
是一种单羧基肽酶,在心脏、肾脏、睾丸、胃肠道及肺脏等组织均有表达。
ACE2
与
ACE
具有
42%
的同源性,与
Ang II
的亲和力显著高于
Ang I
,约为后者的
400
倍。在新的
RAAS
系统中,
ACE2
可竞争性地作用于
Ang I
,使之催化产生
Ang-(1-9)
并经
AT
2
受体发挥作用,
Ang-(1-9)
经中性内肽酶或
ACE
作用进一步催化生成
Ang-(1-7)
;
ACE2
还可特异性催化
Ang II
转化为
Ang-(1-7)
,后者可通过其特异性受体
Mas
负性调控
RAAS
的作用(见图
1
)。
RAAS
系统中的经典路径
ACE-Ang II-AT
1
轴可导致血管收缩、水钠潴留、炎症反应、氧化应激及心血管重构形成,而
ACE2-Ang-(1-7)-Mas
轴通过对抗前一路径,发挥其血管舒张、抗炎、抗氧化应激及抗心血管重构的功效。既往大部分的
RAAS
药物靶点研究集中于
ACE-Ang II-AT
1
受体轴。本文主要介绍新近发现的
ACE2
相关信号轴:
ACE2-Ang-(1-9)-AT
2
受体轴和
ACE2-Ang-(1-7)-Mas
受体轴,这些信号轴为心血管新药的研发提供了新方向。
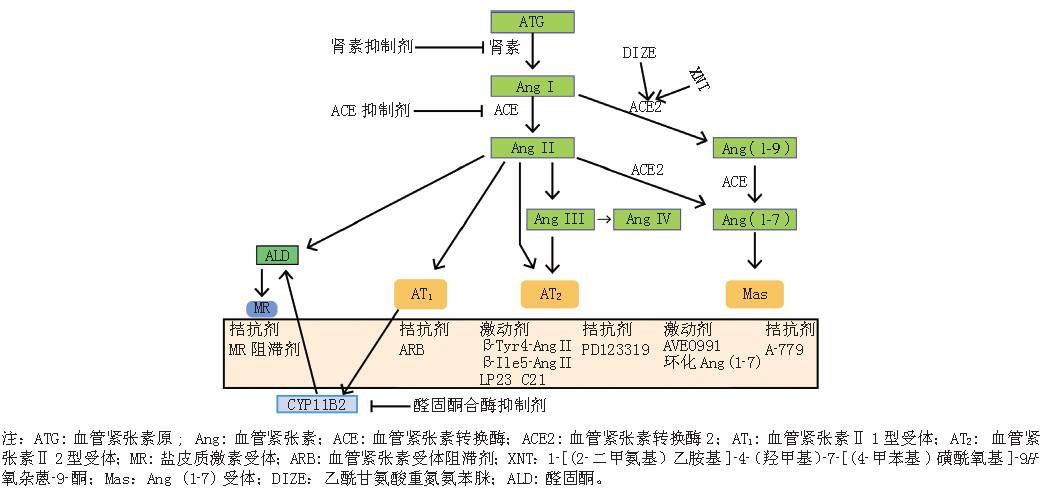
1.1ACE2-Ang-(1-9)-AT
2
受体轴
ACE2
在心血管疾病防治和器官保护方面发挥有益作用,通过各种新途径来调控
ACE2
的活性是目前心血管药理学研究的热点。研究发现,
ACE2
基因缺失会促进促炎症因子的表达增加,加重血管炎症和动脉粥样硬化进程;而
ACE2
过表达可降低高血压大鼠血压水平并改善血管内皮功能。
ACE2
水平
/
活性提升导致了
ACE2-Ang-(1-9)-AT
2
受体轴和
ACE2-Ang-(1-7)-Mas
受体轴的激活,发挥其心血管和肾脏保护作用。研究表明
AT
2
受体敲除小鼠的压力感受性反射敏感性和血压均升高,心脏和血管中
AT
1
受体的表达上调。部分
AT
2
受体敲除小鼠出现基础血压和心率升高及行为异常,而心脏中特异性
AT
2
受体过表达小鼠对
AT
1
介导的升压反应敏感性下降,且
Ang II
介导的升压效应明显减弱。
ACE2-Ang-(1-9)-AT
2
受体轴主要拮抗
ACE-Ang IIAT
1
受体轴介导的作用,发挥抗心血管组织细胞增殖、抗炎和血管舒张等功效。近年来,对
ACE2-Ang-(1-9)-AT
2
受体轴的研究正成为新的热门方向,并且已经开发出了新的
AT
2
受体激动剂。目前已开发出
4
种靶向
AT
2
受体的候选药物,分别是肽类激动剂
β
-tyr4-AngII
、
β
-Ile5-Ang II
、
LP2-3
及非多肽类特异性激动剂复合物
21
(
compoud 21
,
C21
)。
β
-tyr4-Ang II
、
β
-Ile5-Ang II
是
Ang II
类似物,由于
Ang II
中的
α-
氨基酸残基
tyr4
和
Ile5
被
β-
氨基酸残基所替代,其对
AT
1
受体的亲和力几乎完全消失,而对
AT
2
受体的亲和力仅有轻度下调。
β
-tyr4-Ang II
和
β
-Ile5-Ang II
可通过一氧化氮(
nitric oxide
,
NO
)依赖的机制引起小鼠动脉血管轻度舒张。
LP2-3
是环化
Ang
(
1-7
),后者可部分激动
AT
2
受体,在肺发育不全动物模型中,
LP2-3
可抑制肺、心脏及血管的病理性重构。
C21
可通过激活
AT
2
受体介导血管舒张,发挥其抗纤维化和抗炎功效。
C21
治疗可显著减小心肌梗死小鼠的梗死面积及降低心脏炎症反应。此外,
C21
还对外周血管疾病和高血压肾脏损伤等具有治疗作用。
ACE2-Ang-(1-9)-AT
2
受体轴参与调控心肌细胞增殖、心血管纤维化及血管反应等多重作用。开发
ACE2-Ang-(1-9)- AT
2
受体轴的激动剂可成为心血管疾病早期干预策略,因此尚需更多基础和临床研究来阐明其在体内的作用机制。
1.2ACE2-Ang-(1-7)-Mas
受体轴
ACE2-Ang-(1-7)-Mas
受体轴的发现是近年来在高血压等心血管疾病防治新靶点研究中的一个重大突破。重组人
ACE2
(
recombinant human ACE2
,
rhACE2
)可有效激活
ACE2-Ang(1-7)-Mas
轴并调节
Ang II/Ang-(1-7)
的生成。笔者所在课题组研究发现
rhACE2
干预后可显著降低高血压小鼠的收缩压水平,伴有心血管重构、炎症及氧化应激水平减轻。Ⅰ期临床试验结果显示,健康人体对
rhACE2
耐受性良好,各种血管紧张素多肽的浓度发生了显著变化,但其在心血管系统中的具体作用及其机制目前尚未完全阐明。新近的Ⅰ期临床试验研究表明,在高血压合并急性心衰患者或慢性心衰状态下,体内血浆中的
ACE2
水平降低,伴有
Ang II
上调和
Ang-(1-7)
水平下降;采用
rhACE2
治疗高血压合并心衰与单纯心衰患者后血浆中
Ang II
下调,
Ang-(1-7)
水平和
Ang-(1-7)/Ang II
比值升高,提示
rhACE2
在高血压治疗中有重要的临床应用价值。
2008
年,研究人员发现了具有一定降压和心血管保护功效的
ACE2
激动剂
——XNT
(
1
)。另一种
ACE2
激动剂
DIZE
(
2
)在体内出现“脱靶”效应。在
DIZE
作用下,体内
ACE2
的活性明显提高。经
DIZE
干预治疗后,心血管组织炎症因子表达下降,血管反应性和心脏功能得到明显改善。此外,
DIZE
的降压作用还可能与
Mas
受体激活和
NO
生成增加有关。值得注意的是,
XNT
与
DIZE
还可通过非
ACE2/Ang(1-7)
信号发挥作用。
ACE2
激动剂的心血管保护特性为这些化合物的临床应用提供了可能,目前这
2
种激动剂仍处于临床前研究。
Ang-(1-7)
作用主要来源于
ACE2
对
Ang II
的降解,通过结合
Mas
受体拮抗
AT
1
受体所介导的效应。
Mas
受体是一种广泛表达于心血管系统的
G
蛋白偶联受体,
Ang (1-7)
是其内源性配体。现已证实,
Ang-(1-7)
通过结合
Mas
受体发挥一定的心血管保护作用,如促尿钠排泄、抗血栓形成、抗纤维化、抗炎、抗心律失常、抑制粥样斑块形成、减轻心血管功能紊乱等。因此通过激活
ACE2-Ang(1-7)-Mas
信号的途径仍可能成为有效的心血管疾病防治新策略。
除了
rhACE2
和
ACE2
激动剂外,现已开发出多种可延缓
Ang(1-7)
分解的合成药物如
Ang-(1-7)
激动剂,包括低聚糖胶囊包裹的
Ang-(1-7)
、环化
Ang-(1-7)
、
NorLeu- Ang-(1-7)
、
CGEN856S
(肽类)和
AVE0991
(非肽类)(
3
)。
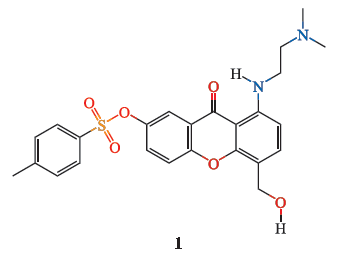
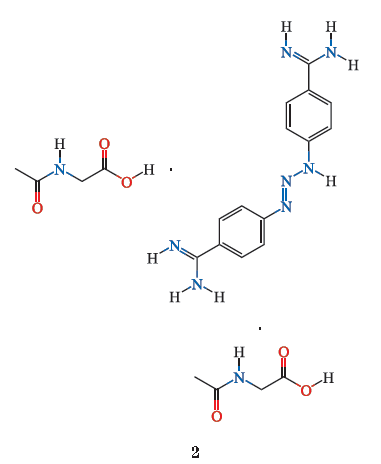
1.3
其他RAAS 家族成员
血管保护素(
angioprotectin
)是内源性
Ang II
样八肽,在一级结构上与
Ang II
的前
2
位氨基酸残基不同。有趣的是,血管保护素通过激活
Mas
受体拮抗
Ang II
介导的血管收缩作用,且其与
Mas
受体的亲和力要高于
Ang(1-7)
,后者为
ACE2
的主要产物。
Ang A
是
RAAS
家族的新成员,在蛋白质一级结构上与
AngII
相似,两者的区别仅是第
1
位上的氨基酸种类不同。研究发现,
Ang A
对
AT
1
和
AT
2
受体的亲和力相似,向正常大鼠体内注射
Ang A
可导致剂量依赖性降压反应,且该效应能被
AT
1
受体阻滞剂抑制,但不被
AT
2
受体阻滞剂抑制。在大鼠体内,
Ang A
和
Ang II
可引起相似的剂量依赖性升压效应。总体来说,
Ang A
通过激活
AT
1
受体负性调控心血管和肾脏功能。
RAAS
家族成员还包括很多来源于
Ang I/Ang II
的短肽,
Ang-(3-4)
(缬氨酸
-
酪氨酸)是
RAAS
成员中重要的短肽之一,最近因其在体内重要的生理作用而引起关注。
Ang-(3-4)
在血浆中来源于
Ang III
,并且在局部和系统
RAAS
中均有表达,在抗心血管组织增殖、促血管舒张及维持心血管功能稳态中发挥着重要作用。
Ang-(3-4)
口服仍然有效,Ⅰ期临床试验结果表明,口服
Ang-(3-4)
能够降低高血压患者血浆中
Ang II
和醛固酮水平,并具有明显的降压效果。提示作为局部和系统
Ang II
重要的拮抗因子,
Ang-(3-4)
具有很大的心血管药物开发潜力和广阔的临床应用前景。
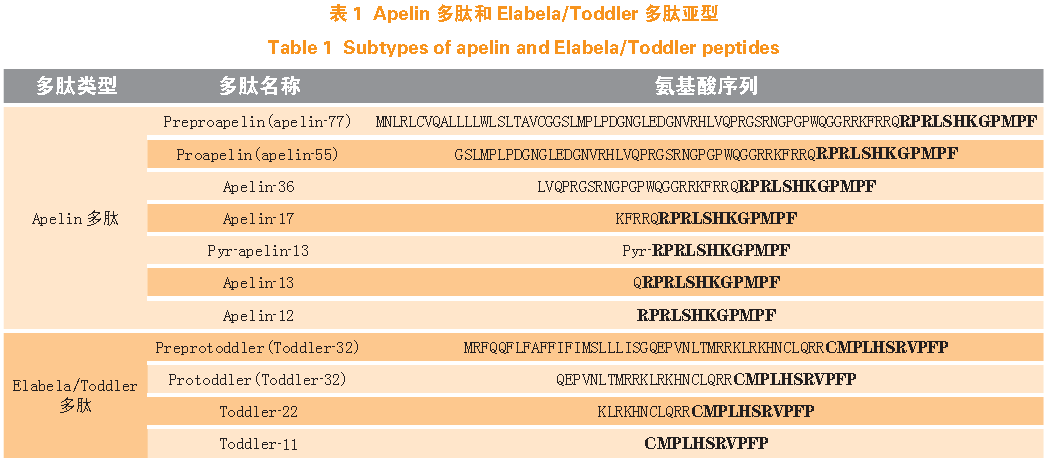
2Apelin-APJ
系统
2.1Apelin-APJ
系统概述
Apelin
基因位于
X
染色体上,其编码的
Pre-proapelin
是由
77
个氨基酸残基组成的
apelin
前体。
Prepro-apelin
在肽链内切酶的作用下裂解为多种
apelin
亚型,其中由
12 ~ 36
个氨基酸组成的亚型是具有活性的
apelin
,长度小于
12
个氨基酸的片段无生物活性(见表
1
)。
Apelin
各亚型
C
端的
12
个氨基酸是结合并激活
APJ
受体的必需片段,
N
端序列主要调控
apelin
与
APJ
受体的相互作用。近期,
2
个研究小组分别独立发现了一种由
Apela
基因编码的多肽,命名为
Elabela
(也称为
Toddler
),
Elabela
为
apelin
类似物,由
32
个氨基酸组成,是迄今为止发现的
G
蛋白偶联受体
APJ
的第
2
种配体,可结合并激活
apelin
的受体
APJ
。
血浆中的
apelin
亚型以
pyr-apelin-13
、
apelin-13
和
apelin-17
为主,
apelin-36
主要分布于肺部、睾丸、尿道和初乳中。
Pyr-apelin-13
不仅与
APJ
受体亲和力最高,且是人类心脏中最主要的亚型。由于血浆中蛋白酶的降解,
apelin-13
和
apelin-36
在血浆中的半衰期仅为
5 ~ 8 min
。研究发现,
ACE2
可以调节心血管组织
apelin
水平及其作用。
ACE2
通过裂解
apelin C
端的苯丙氨酸残基使其无法有效激活
APJ
受体;而
ACE2
基因缺失状态下
apelin
的降压作用明显加强。此结果说明,体内
ACE2
是
apelin
的负性调控因子。
Apelin
基因敲除小鼠体内
ACE2
的表达下调,而
apelin
治疗后小鼠心脏中
ACE2
的表达水平和活性均明显提高,提示体内
apelin
是
ACE2
的正性调控因子。由此可见,
apelin
与
ACE2
在体内形成一种负反馈机制,
apelin
活性增加后上调
ACE2
的表达,
ACE2
又反过来降低
apelin
的水平。近期有研究发现,脑啡肽酶(
neprilysin
,
NEP
)也可水解
apelin C
端的氨基酸残基使其降解或失活。
2.2Apelin-APJ
信号的心血管保护功效
Apelin-APJ
系统具有一定的心脏血管保护功效。原发性高血压患者血浆
apelin
水平降低,且低水平的
apelin
与左室舒缩功能障碍相关,提示
apelin
可作为预测高血压和心力衰竭发生的标记物。
Apelin
基因缺失小鼠在基础条件下心脏收缩功能中度降低,运动功能明显减弱。
Pyr-apelin-13
治疗伴心衰的高血压大鼠后其心脏的舒缩功能显著改善,伴有心肌组织炎症因子表达的下调。心肌缺血
/
再灌注模型小鼠经
apelin-13
治疗后,心肌梗死面积明显减小,心肌凋亡水平下降,线粒体损伤明显减轻,同时心肌
PI3K/Akt
、胞外调节蛋白激酶
1/2
及内皮源性一氧化氮合酶(
endothlial nitricoxidesynthase
,
eNOS
)磷酸化水平提高。此外,
apelin
治疗后可通过上调
SIRT3
的表达促进糖尿病小鼠心肌血管生成,最终减轻糖尿病心肌损伤。
Apelin
可促进动静脉血管的舒张,向心力衰竭患者体内快速输入
apelin
可引起外周和冠状动脉血管舒张,心输出量增加,这些变化与
eNOS
活性和表达的上调有关。
Apelin-13
通过
NO
依赖机制抑制
Ang II
诱导的血管收缩从而导致血压下降,而向大鼠侧脑室注射
apelin-13
可引起平均动脉压升高,提示
apelin
在外周和中枢系统的作用不同。研究发现,人体动脉粥样硬化血管组织中的
apelin
表达降低,而稳定型心绞痛病人冠脉侧支循环的建立与血浆中高浓度的
apelin
相关。
Apelin
可通过上调血管中
NO
的表达和减少泡沫细胞中的脂质沉积拮抗
Ang II
诱发的动脉粥样硬化和动脉瘤形成。临床上肺动脉高压(
pulmonary arterialhypertension
,
PAH
)可促进右心室肥厚和心力衰竭的发生,
PAH
病人循环血及肺动脉、微血管内皮中
apelin
水平降低,提示
apelin
与
PAH
的发生有关。
Apelin
基因缺失可降低腺苷酸活化蛋白激酶和
eNOS
的激活,进而加重血管重塑和
PAH
。低氧条件下,外源性
apelin
治疗可通过激活
PI3K/Akt/mTOR
信号调控肺动脉血管平滑肌细胞的自噬、增殖和迁移。
Apelin-APJ
信号在维持心血管稳态方面具有多样化功能,故以
apelin
信号为靶点开展药物研究可能为心血管疾病的治疗提供新的思路。
2.3
靶向Apelin-APJ 信号的药物研究
Apelin C
端的保守区域包含其发挥生理作用的重要氨基酸残基,同时也是蛋白酶降解的关键区域。因此在设计
apelin
类似物时需同时满足
2
个条件,一是增强其与APJ 受体的结合并有效激活胞内下游信号;二是提高其对蛋白水解作用的稳定性。稳定的apelin类似物首先需能够抵抗ACE2 对其的降解才可能成为有效的治疗药物。目前已合成了一种可抵抗ACE2 降解的apelin 类似物
——Nle11-apelin
,与原始的
pyr-apelin-13
相比,
Nle11-apelin
的降压效果和对心肌损伤的保护作用更强、更长效。另有研究者将apelin 肽链上可被ACE2 水解的区域完全去除,以延长apelin 的半衰期,虽然该合成的产物功效与原始
pyr-apelin-13
相当,但其在血浆中的稳定性反而明显降低,这说明apelin 多肽链上仍存在可被其他蛋白酶水解的区域。近期研究发现,NEP 可水解apelin N 端的氨基酸残基使其降解或失活。因此,理想的apelin 类似物不仅需能抵抗ACE2 对apelin C 端的降解,还要能抵抗NEP 对其N端的水解作用。
新近研究发现,通过对
apelin-13 N
端和C 端残基等部位进行化学修饰,合成了具有中高效作用的APJ受体激动剂,该类激动剂在纳摩尔水平上即可有效激活APJ 受体,为探索apelin 信号的治疗潜力提供了新的药理学工具。对apelin 多肽氨基酸主链或侧链的环化修饰已成为化学合成APJ 受体激动剂的常用策略,尽管该类环化化合物的亲和力不强,半衰期较短且缺乏关键的生理学功能,但仍有部分药物成功应用于临床试验,如环化
MM07
在多种剂量下均可有效促进病人血管舒张。现已有研究者将apelin 多肽与高分子聚乙二醇或脂肪酸结合以改善apelin 多肽的药动学性质。
Elabela/APJ
系统可能参与调控循环系统和胚胎发育,还可通过剂量依赖方式诱导血管生成,降低动脉血压,该作用机制与apelin 不同。由于体内apelin 降解过快且药理学特性不稳定,而Elabela 可直接激活APJ 受体及其下游信号,因此人工合成Elabela 类似物可能成为心血管疾病防治的新药物,具有广阔的临床应用前景。
3
展望
ACE2
和
apelin/APJ
轴既存在交互作用又各自具备独立的基础性与多样化心血管调控作用,两者皆可拮抗
Ang II/AT
1
受体信号的作用。通过各种手段调节
ACE2/apelin
信号的活性或表达很可能成为高血压及心血管疾病治疗的新途径。经典的
RAAS
干预药已在心血管疾病治疗中得到广泛应用,阐明
RAAS
新成员
ACE2/Ang-
(
1-7
)
的分子作用机制,可为以
ACE2/apelin
信号为干预靶点的新型药物的开发和应用提供科学和理论依据,具有重要的临床价值和治疗意义。
[
专家介绍]
 钟久昌:
医学博士,教授
/
研究员,博士生导师。现为上海交通大学医学院附属瑞金医院、教育部国家重点学科上海市高血压研究所学术带头人、研究室主任。现任国家心血管病中心高血压专
家委员会委员、中国高血压联盟理事、中华心血管病学分会高血压病学组全国委员、国际心脏协会中国转化医学委员会委员、中国病理生理学会心血管专业委员会及国际心脏协会中国分会青
年委员。研究方向为
ACE2/apelin
信号与心血管药物靶点研究。主持国家重大研究计划、国家自然科学基金、加拿大国际合作项目、国家重点基础研究发展计划项目及上海市科委等
10
余项科研立项。在国际心血管权威杂志
Circulation
、
Circ Res
、
Hypertension
等上发表论文
60
余篇;主编和参编专著
5
部。先后入选北美中华心脏协会青年学者、加拿大
AHFMR
青年学者、上海市浦江人才、上海市教育委员会
/
上海交通大学医学院高峰学科建设计划及上海交通大学
SMC
晨星青年学者。
钟久昌:
医学博士,教授
/
研究员,博士生导师。现为上海交通大学医学院附属瑞金医院、教育部国家重点学科上海市高血压研究所学术带头人、研究室主任。现任国家心血管病中心高血压专
家委员会委员、中国高血压联盟理事、中华心血管病学分会高血压病学组全国委员、国际心脏协会中国转化医学委员会委员、中国病理生理学会心血管专业委员会及国际心脏协会中国分会青
年委员。研究方向为
ACE2/apelin
信号与心血管药物靶点研究。主持国家重大研究计划、国家自然科学基金、加拿大国际合作项目、国家重点基础研究发展计划项目及上海市科委等
10
余项科研立项。在国际心血管权威杂志
Circulation
、
Circ Res
、
Hypertension
等上发表论文
60
余篇;主编和参编专著
5
部。先后入选北美中华心脏协会青年学者、加拿大
AHFMR
青年学者、上海市浦江人才、上海市教育委员会
/
上海交通大学医学院高峰学科建设计划及上海交通大学
SMC
晨星青年学者。
●
感谢您阅读《药学进展》微信平台原创好文,也欢迎各位读者转载、引用。本文选自《药学进展》2017年第7期。
●
《药学进展》是一本专注于医药领域前沿动态的专业媒体,月刊,铜版纸全彩印刷,全年360元,欢迎订阅!编辑部官网:www.cpupps.cn;电话:025-83271227。






