问题:
怎样才能让我的工作学习更有效率呢??
答案:
只需要点击图片上边蓝字
一药一世界
即可!

全文内容提要:
一、FDA在新药申报现场审计及其他GMP审计中发现的实验室控制缺陷:
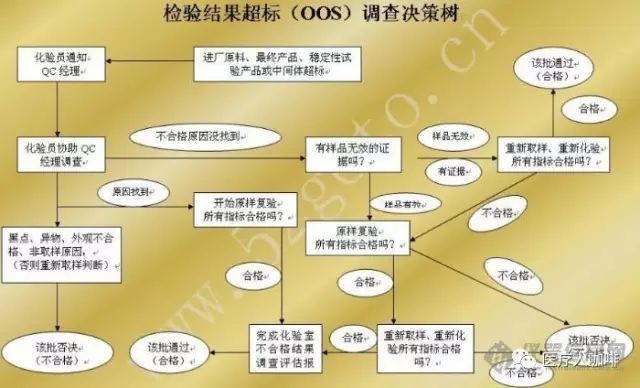
二、实验室检验超标事件OOS调查程序
一、FDA在新药申报现场审计及其他GMP审计中,发现的主要实验室控制缺陷:
1、没有建立科学可靠和适当的标准,以确保药物符合鉴别、含量、质量及纯度标准。
2、没有验证分析方法的准确度、灵敏度、专属性和重现性等。新药申报中的分析方法必须进行验证并有相关文件记录验证结果。
3、建立的规范、标准、取样计划、测试程序或实验室控制程序没有被很好的执行或在执行时没有记录。
一种情况是企业在执行的过程中使用已申报的测试方法没有达到预期的结果,于是重新更改了这个方法,但没有重新申报。另一种情况是分析员在做实验的时候自己做了变化而没有任何纪录。
4、没有按照已经制定的书面程序中所规定的合适频率对仪器进行较正,或当仪器准确度或精确度超标时,没有采取适当的纠正措施。如果仪器校正的结果超标,非常重要的一步就是要调查用这个仪器测试的产品会不会存在质量的隐患,会不会有不准确的结果。
5、对于质量控制部门的职责或程序没有成文,或者没有被执行。典型的质量控制部门的职责就是批准标准、程序,并对任何异常事件进行调查。
6、在不合格批调查方面,对预料之外的偏差/ 某些批次产品或其组分不符合标准的情况的调查没有覆盖与该异常事件相关的同一产品的其它批次或其他品种。即使结果认可被拒绝,对超标事件进行调查还是很有价值的,可以判断是不是影响到其它的相关批次。
如果结果超标了,就要确定它的根本原因。这个原因有助于评价相关批次,即使这些相关批次结果都是在这个标准范围之内,但还是得重新评价结果是否可信。
7、药品出厂前的测试和释放没有适当的实验室判定程序,以确保药品能最终满足产品质量标准。
二、实验室检验超标事件( OOS)调查程序
虽然FDA 一直在强调实验室超标情况调查的问题,但是在这个问题上还是有很多缺陷项目。FDA对此问题的警告信主要是因为企业出现了超标事件以后没有通过调查找到超标的根本原因而否定了该结果,而且报告时选择性地挑选数据,而不是把完整实际的结果报告出来。
必须对实验室异常事件或超标结果进行调查以确定其原因。调查行为应以书面形式如调查报告进行记录。理想的报告应该是包括完整的调查,如结论、预防和整改措施,以防事件再次发生。因此要求企业的实验室都要有完整的OOS调查程序,包括如何调查超标结果以及如何拒绝超标结果。
实验室超标结果的定义是产品质量指标测试中超出已经建立的可接受标准的单个或一系列结果。任何一个实验室必须要有一个批准的程序来对实验室超标结果进行调查。在丢掉这个实验溶液之前要进行初始调查来评估数据的准确性。具体调查内容包括回顾程序、设备、人员、操作过程以及任何文件记录和测试的证据(如移液管、烧瓶等等),也就是实验所用到的东西都要放在原处,不要毁坏这些证据。