
生物极客导读:
RNA引导的核酸内切酶
Cpf1
是真核细胞基因组编辑工具中非常有前途的工具。然而,常用的Acidaminococcus sp. BV3L6 Cpf1(
AsCpf1
)和Lachnospiraceae
bacterium
ND2006 Cpf1(
LbCpf1
)受到其在DNA底物中的TTTV原始相邻基序(PAM)的要求的限制。为了解决这个限制,张峰进行了一个
结
构引
导诱变筛选
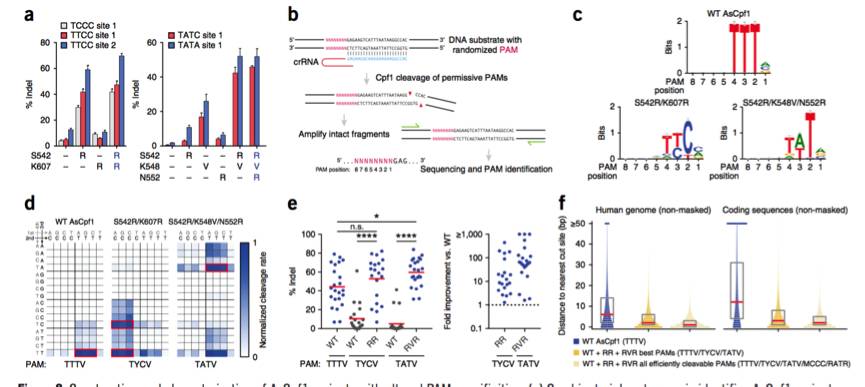
,以增加Cpf1的靶向范围。科学家们设计了携带突变S542R / K607R和S542R / K548V / N552R的两个AsCpf1变体,
其分别识别
TYCV
和
TATV PAM
,具有增
强
的体外和人
细
胞活性。
使用BLISS方法进行全基因组脱靶活性的评估表明,这些变体保持高DNA靶向特异性,通过引入额外的非PAM相互作用突变进一步改善高保真性。在LbCpf1的相应位置引入鉴定的PAM相互作用突变,同样改变了其PAM特异性。
这
些
变
体将
Cpf1
的靶向范
围
在人
编码
序列中增加
约
三倍至每个
〜
11bp
的一个切割位点。
来自第2类微生物CRISPR-Cas系统的可编程内切核酸酶已经在真核基因组编辑中有广泛的应用。最近的研究表明,除广泛使用的II-A型Cas9外,V-A型Cpf1可以介导有效的基因组编辑。与Cas9相比,Cpf1有几个优点:例如,它具有
低
错
配耐受性
,
不需要反式激活
crRNA
,并且可以
将其自身的
CRISPR RNA
(
crRNA
)
阵
列加工成成熟的
crRNA
,以促进
同
时
靶向多个基因。
以前的工作已经表明,
Cas9
的
PAM
偏好可以通
过
PAM DNA duplex
附近残基的突
变
来改
变
。
科学家们试图研究Cpf1的PAM偏好是否也可以被修改。尽管其在不同直系同源物上的强烈进化保守性。于AsCpf1与crRNA和靶DNA复合物的晶体结构,
科学家
们
在
PAM
双
链
体接近的
AsCpf1
中
选择
了
60
个残基用于靶向
诱变
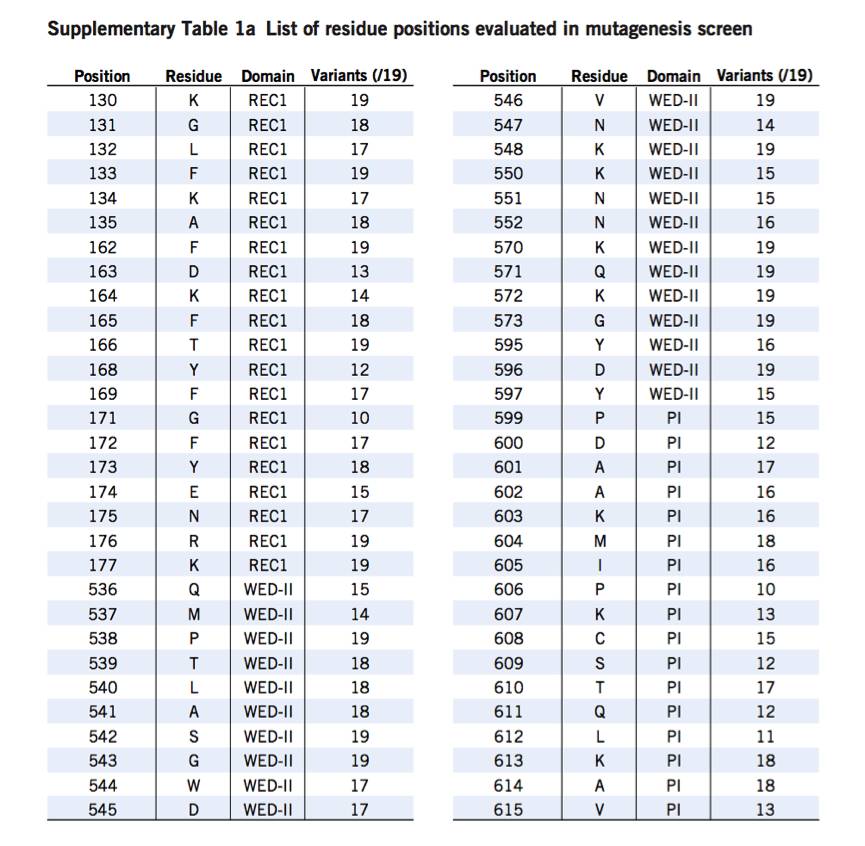
通过使用诱变将每个位置的密码子随机化,科学家们构建了在这些残基处编码大多数单个氨基酸取代的AsCpf1变体的质粒文库。密码子随机化的使用使得科学家们够获得比易错PCR更大的突变覆盖率,因为它可以防止由模板序列引起的偏差。为了在非标准PAM中鉴定相关的突变,
科学家们在大肠杆菌中使用基于质粒干扰的负向筛选
。
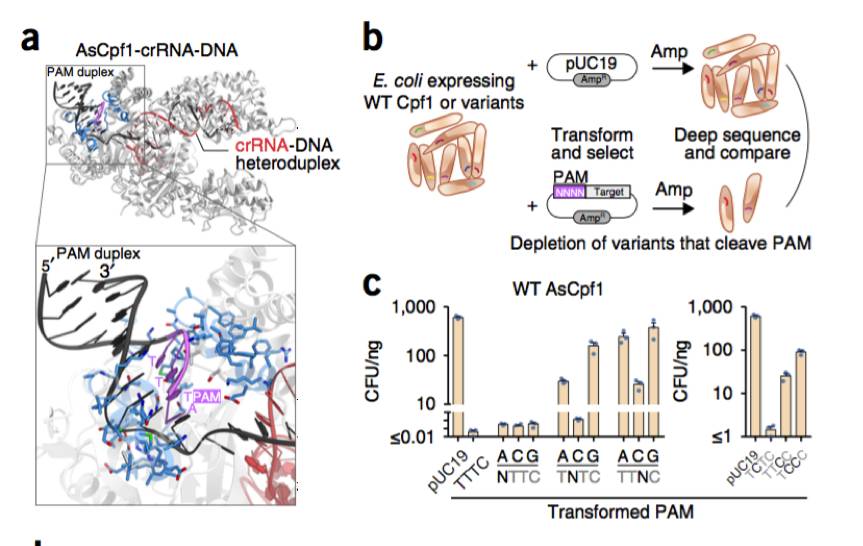
在我们的修饰测定中,用携带氨苄青霉素抗性基因和携带突变PAM的靶位点的质粒转化大肠杆菌文库,每个细菌表达crRNA和来自用氯霉素维持的质粒的Cpf1变体。在氨苄青霉素选择培养基上生长时,第二个质粒的成功切割导致氨苄青霉素抗性的丧失和随后的细胞死亡。通过将原始文库的序列与存活细菌中携带携带Cpf1的质粒DNA的序列进行比较,我们确定了由于其突变的PAM的新的切割活性而耗尽的变体。
为了有效地使用这种方法来区分来自野生型(WT)AsCpf1的非典型PAM活性的变体,我们首先确定WT AsCpf1具有最小活性的PAM序列。我们评估了WT AsCpf1在PAM中的替代突变的耐受性。专注于具有单核苷酸取代的PAM(即NTTV,TNTV和TTNV,其中V被任意选择为C)。
当用NTTC和TCTC PAM转化时,表达WT AsCpf1的大肠杆菌在氨苄青霉素培养基上具有可忽略的存活,表明这些PAM序列支持AsCpf1介导的DNA质粒切割,并且不能用于筛选变体文库。相比之下,其他五个具有单突变的PAM(TATC,TGTC,TTAC,TTCC和TTGC)具有显着的生存率。我们随后筛选了这五个PAM的活性变体文库,以及另外一个具有双突变(PCCC)的PAM。
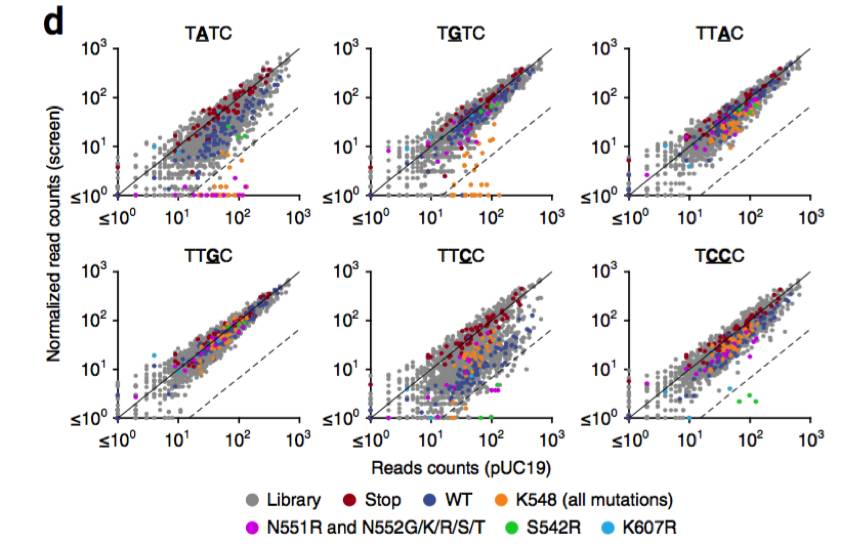
对于TATC,TGTC,TTCC和TCCC PAM,文库中至少有一种AsCpf1变体高度消耗。对于TATC和TGTC,许多耗尽的变体是Lys548,与PAM双链体形成氢键的保守残基。还观察到TTCC和TCCC的一些命中,最显着的是在Ser542(一种非保守残基)的精氨酸取代。
总结:
总的说来,尽管进化保守,Cpf1家族内切核酸酶的PAM偏好可以通过对
靠近
PAM
双
链
体的残基的适当突
变
而改
变
。使用
结
构引
导诱变筛选
,科学家们设计了两个变体RR和RVR,它们可以分别用哺乳动物细胞中的
TYCV
和
TATV PAM
稳定地切割靶位点。科学家们扩展了这种方法,以类似地修改第二个
Cpf1
同源基因。
最后,引入了增加Cpf1特异性的额外突变。总的来说,这些工程改造的人源编码序列中每个〜11 bp的Cpf1靶向范围增加到一个切割位点,并为CRISPR-Cas基因组工程箱提供了有用的添加。






