
无法控制的不可压迫性出血和创伤性感染是平民和军人死亡和致残的主要原因。一种用于临床控制不可压迫性出血和预防创伤性感染的敷料代表着迫切的医疗需求。
近日,
来自中国广东佛山市第一人民医院骨科陈杨/陆军军医大学(第三军医大学)西南医院烧伤研究所罗高兴&于云龙等人
联合开发了一种新型自凝胶海绵OHN@ε-pL,其整合了N-琥珀酰亚胺酯氧化透明质酸(OHN)和ε-聚-L-赖氨酸(ε-pL)。应用于伤口部位时,海绵可以迅速吸收界面液体并经历从海绵到凝胶的相变。转变后的凝胶通过在海绵相中富集凝血因子并在凝胶相中提供屏障作用来促进牢固的组织粘附并实现协同止血。在大鼠肝脏、股静脉和尾部截断出血模型中得到了证实,同时OHN@ε-pL海绵在加速伤口闭合和金黄色葡萄球菌感染伤口愈合方面表现出色(方案1)。
相关研究成果以
“A self-hygroscopic, rapidly self-gelling polysaccharide-based sponge with robust wet adhesion for non-compressible hemorrhage control and infected wounds healing”
为题于2024年12月25日发表在
《Bioactive Materials》
上。
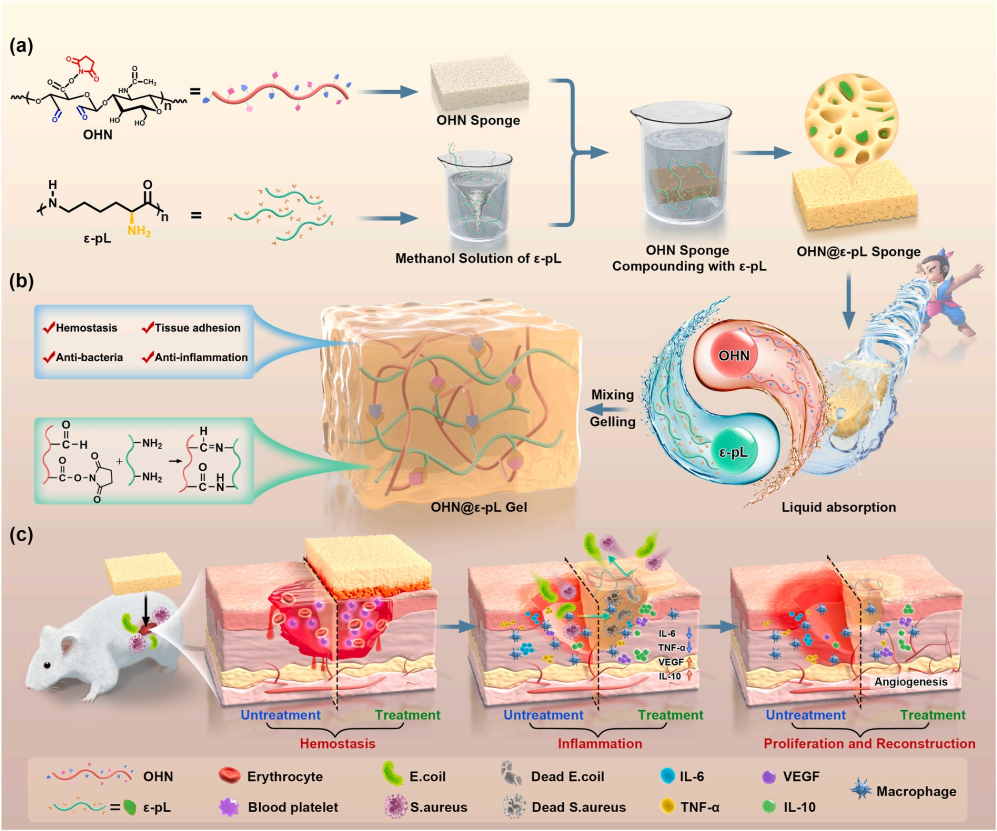
方案1 自凝胶OHN@ε-pL海绵的制备和用于止血和感染伤口愈合的应用示意图
1.OHN@ε-pL海绵的制备及性质
OHN@ε-pL海绵的制备过程如图1a所示,其制备过程中的中间体OHA、OHN和成品OHN@ε-pL海绵的宏观图像展示在图1b中。该海绵是由席夫碱和酰胺反应制得引发海绵向凝胶的相变。然而,未复合ε-pL的OHN海绵在接触水时未能凝胶化(图1c和d)。流变测试表明OHN@ε-pL海绵在溶解过程中内部发生了交联反应,最终形成的是凝胶而非溶液,并且较高的ε-pL浓度可产生更致密的交联网络和更稳定的凝胶结构(图1f-g)此外,OHN@ε-pL海绵的液体吸收能力取决于OHN浓度,后续实验中选择含有5 wt% OHN的海绵进行进一步研究(图1h)。
此外,作者通过流变和宏观测试验证了海绵的自修复能力(图1i-j);SEM表明的海绵具有典型的三维多孔特征,ε-pL成功复合(图1k);降解速率在10 h后急剧下降,在50 h后趋于稳定;此后,随着pH值为7.4时形成稳定的酰亚胺键交联,降解速度减慢,交联密度的增加进一步降低了降解速度(图1l)。图1m 展示了海绵与血液接触时的自凝胶化过程,形成稳定的凝胶后就会表现出粘合性能。此外,作者比较了OHN@ε-pL海绵与市售止血产品(例如纱布、云南白药粉和明胶海绵)在水、PBS和血液中的液体吸收率(图1n),均明显高于市售止血产品。此外,OHN@ε-pL海绵由于其疏松多孔的结构,表现出优异的液体吸收和自膨胀能力。它的膨胀率达到了350.2±15.85%,明显高于市售止血海绵的133.0±9.14%(图1o)。
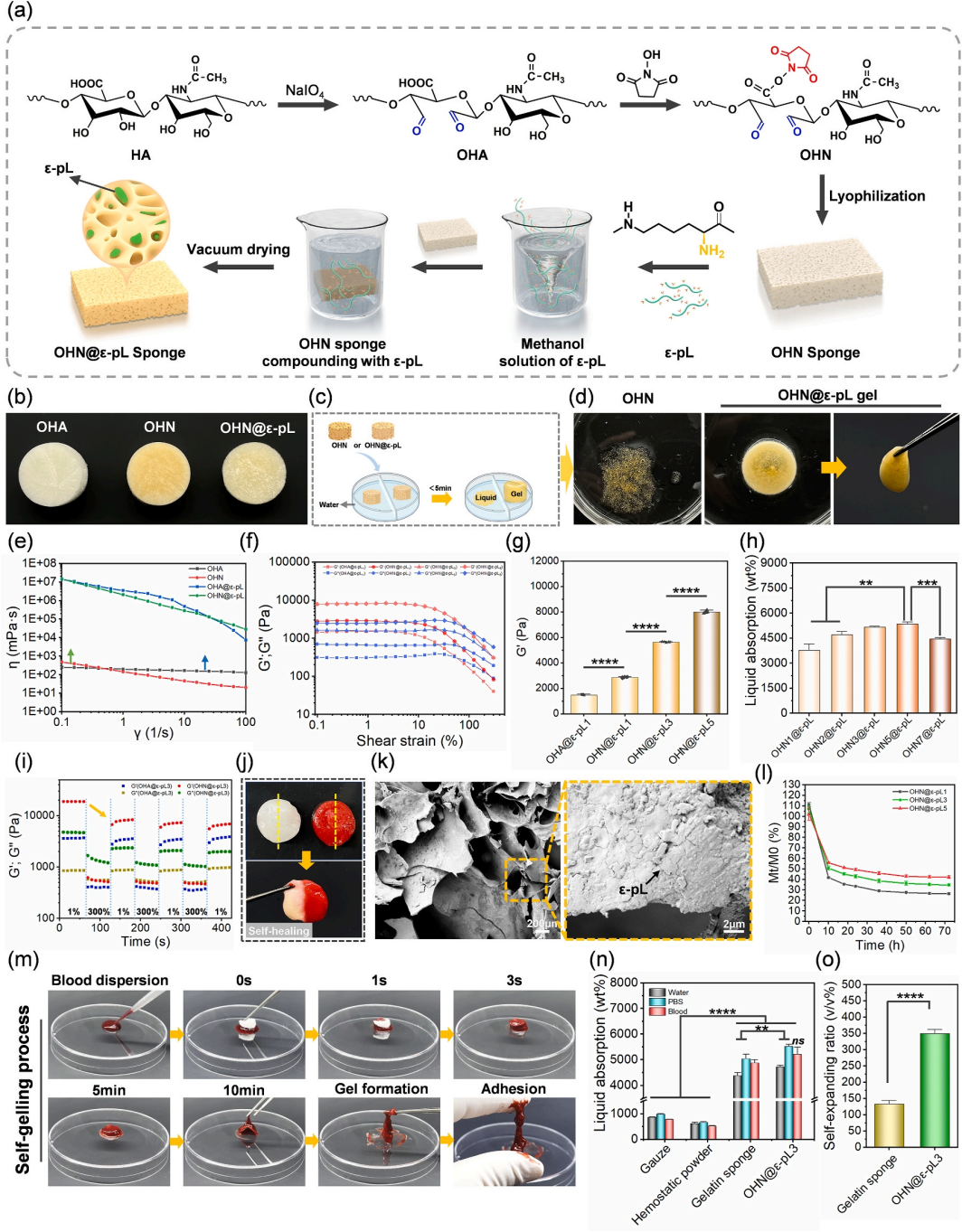
图1 OHN@ε-pL海绵的基本特性
2.OHN@ε-pL海绵自凝胶后的黏附、密封及爆破压力性能
随后,作者研究了OHN@ε-pL海绵在湿组织之间的自凝胶化和粘附性(图2a)。图2b显示了OHN@ε-pL海绵吸收液体至完全凝胶后的形貌。当用手指摆弄或粘附在手指关节上并保持关节活动时,凝胶结构保持完整,表现出优异的黏附性和可变形性。为了评估OHN@ε-pL凝胶的形状适应性和机械柔韧性,将其涂抹在猪皮上,并进行拉伸、挤压和扭曲以观察是否有任何脱落(图2c)。凝胶能很好地适应猪皮的变形,不会脱落或失去完整性。图2d表明,OHN@ε-pL海绵在猪皮上完全凝胶化后,用水冲洗不会使凝胶脱落。SEM图像显示凝胶和猪皮之间没有明显的边界,表明粘附是由化学反应而不是简单的物理吸附引起的。此外,凝胶一旦牢固地粘附在dSIS上,就可以容纳超过50克的水而不会泄漏。用自制装置测得的OHN@ε-pL3凝胶的最大破裂强度为144.9±7.24 mmHg,明显高于正常受试者的纤维蛋白胶、和正常收缩压(图2f-h)。OHN@ε-pL3凝胶湿组织粘附的机制似乎主要归因于凝胶中的活性醛和N-琥珀酰亚胺酯基团与组织表面的氨基反应产生的共价键。除了共价键之外,氢键、静电相互作用和疏水相互作用可能在凝胶基质内及其与组织或其他基质界面建立稳固的网络方面发挥重要作用,从而增强粘附强度(图2i)。
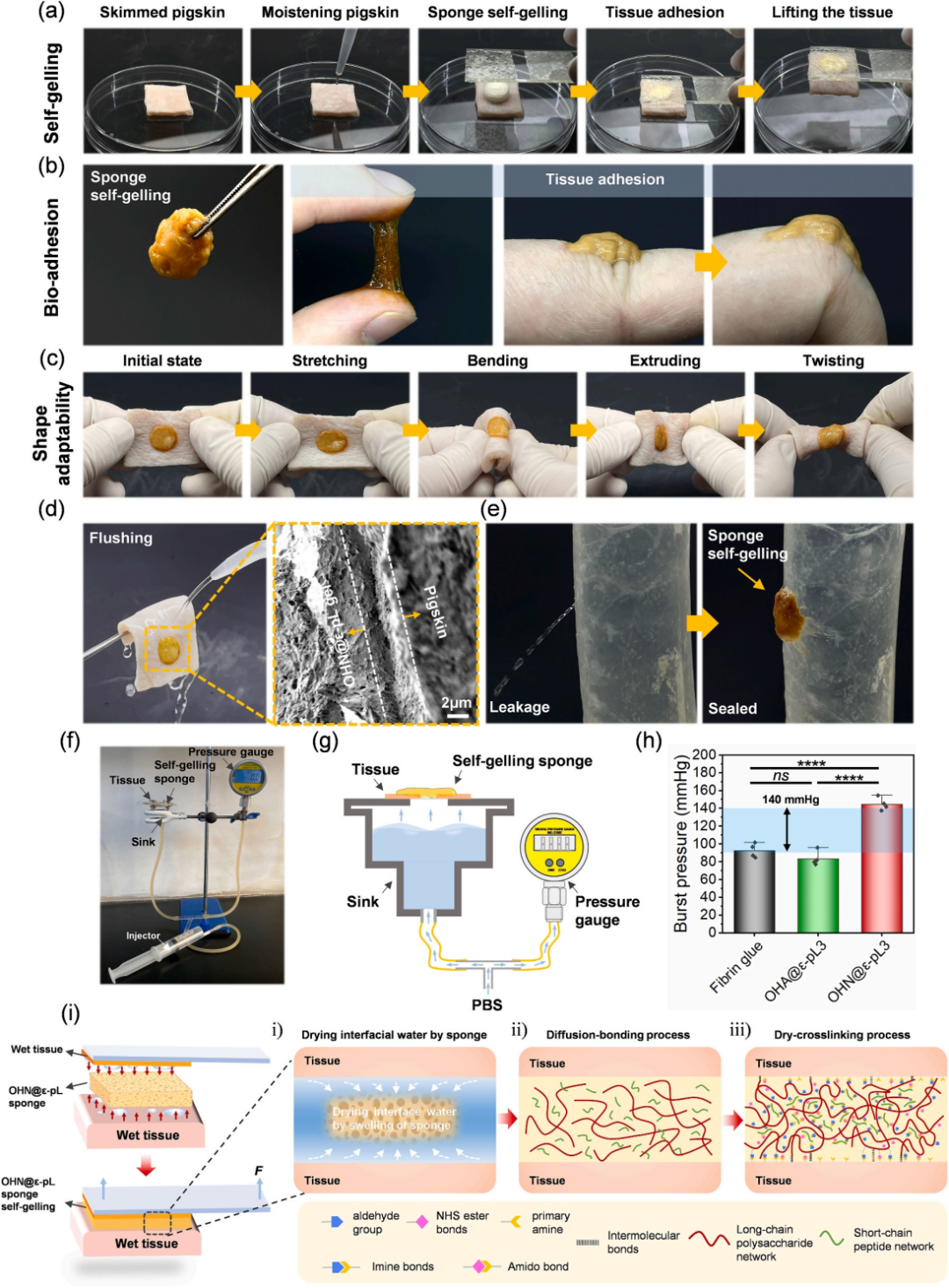
图2 OHN@ε-pL海绵的自凝胶化及凝胶化后的黏附和形状适应性
3.粘合性能和粘合强度
接着对OHN@ε-pL凝胶在湿组织上的粘附能力进行了评估。粘附测试表明,OHN@ε-pL凝胶在接触湿的新鲜器官(心脏、肝脏、脾脏、肺和肾脏)后立即粘附,并能够支撑其重量(图3a)。同时,该凝胶还可以牢固地粘附在玻璃、塑料、乳胶、木材和钢材等各种表面上(图3b)。按照ASTM标准,作者对OHN@ε-pL凝胶进行搭接剪切、拉伸和T型剥离试验,以评估其在两块湿组织之间的粘附性能,选择纤维蛋白胶作为对照。搭接剪切试验显示,OHN@ε-pL凝胶的剪切强度明显高于纤维蛋白胶的(图3c-e)。在拉伸试验中,OHN@ε-pL凝胶的抗粘连拉伸强度是纤维蛋白胶的5.4倍(图3f-h)。同样,在T剥离试验中,OHN@ε-pL凝胶的界面韧性是纤维蛋白胶的7.5倍(图3i–k)。
因此,OHN@ε-pL海绵与临床纤维蛋白胶凝胶化后相比表现出更优异的机械性能,表明其作为海绵-凝胶双相敷料具有良好的临床应用前景。
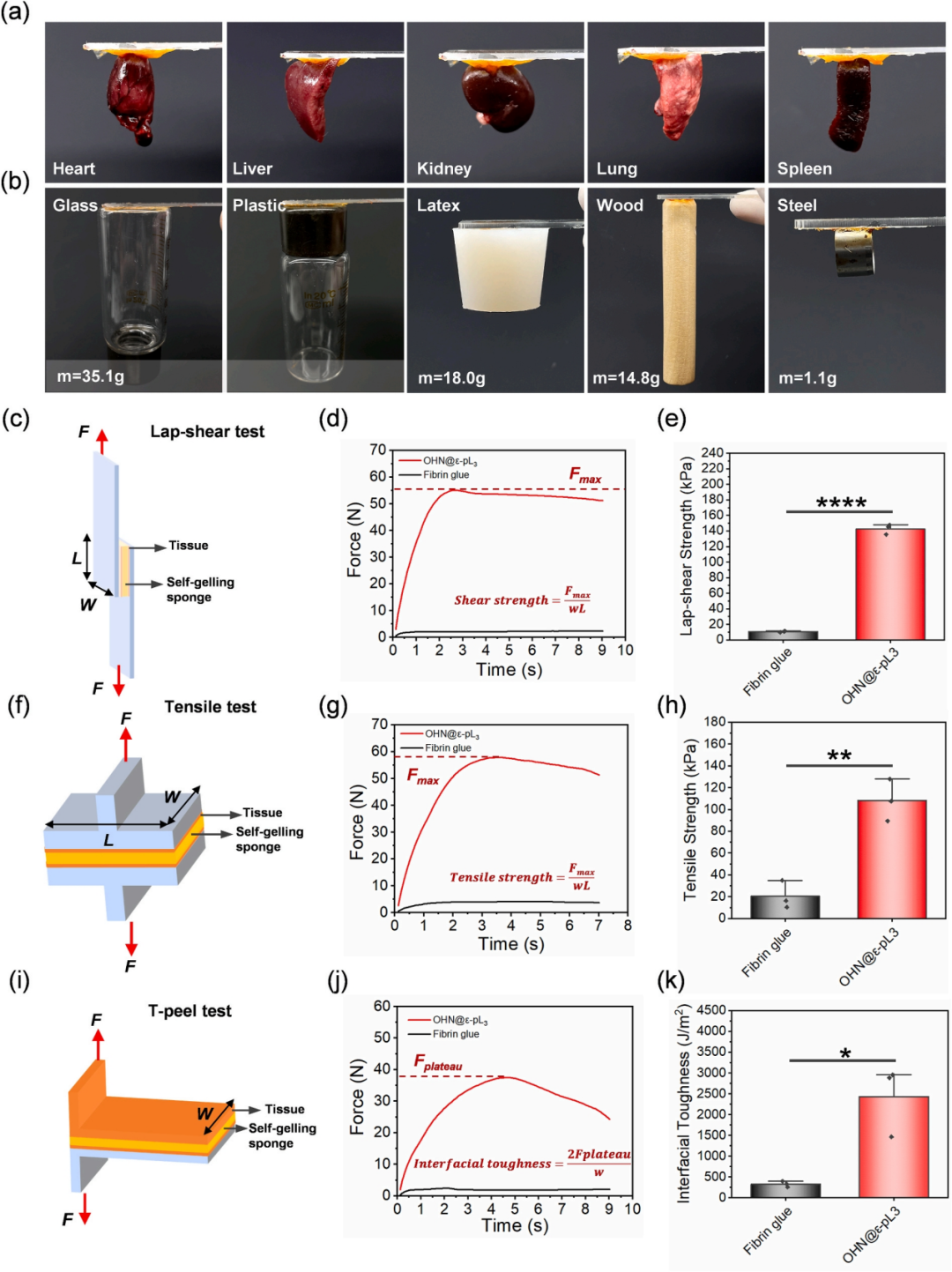
图3 OHN@ε-pL凝胶的粘合性能和粘合强度
4.OHN@ε-pL海绵的生物相容性
止血材料的生物相容性是其未来临床应用的基本前提。因此,作者对OHN@ε-pL海绵的生物相容性进行了研究。CCK-8表明它们没有明显的细胞毒性(图4a),活/死染色表明细胞存活率高(图4b)。此外,还用相同方法评估了提取物在HSF细胞中的细胞相容性。图4c显示所有提取物组中HSF细胞的存活率均超过80 %,且随着ε-pL浓度的增加而降低。总体而言,提取物中的HSF细胞增殖与NIH-3T3细胞略有不同。同样,HSF细胞的活/死染色显示所有组中的大多数细胞都是活的(图4d)。OHN@ε-pL海绵的细胞相容性评估表明,ε-pL浓度对不同来源的成纤维细胞活力、增殖和凋亡的影响相似。ε-pL溶解导致的 pH值和电荷效应改变可能是导致细胞生理活性的主要因素。血液相容性表明OHN@ε-pL海绵具有良好的血液相容性(图4e);皮下植入进一步说明OHN@ε-pL海绵具有良好的生物相容性,且在体内降解速度适宜,不会引起额外的炎症反应。
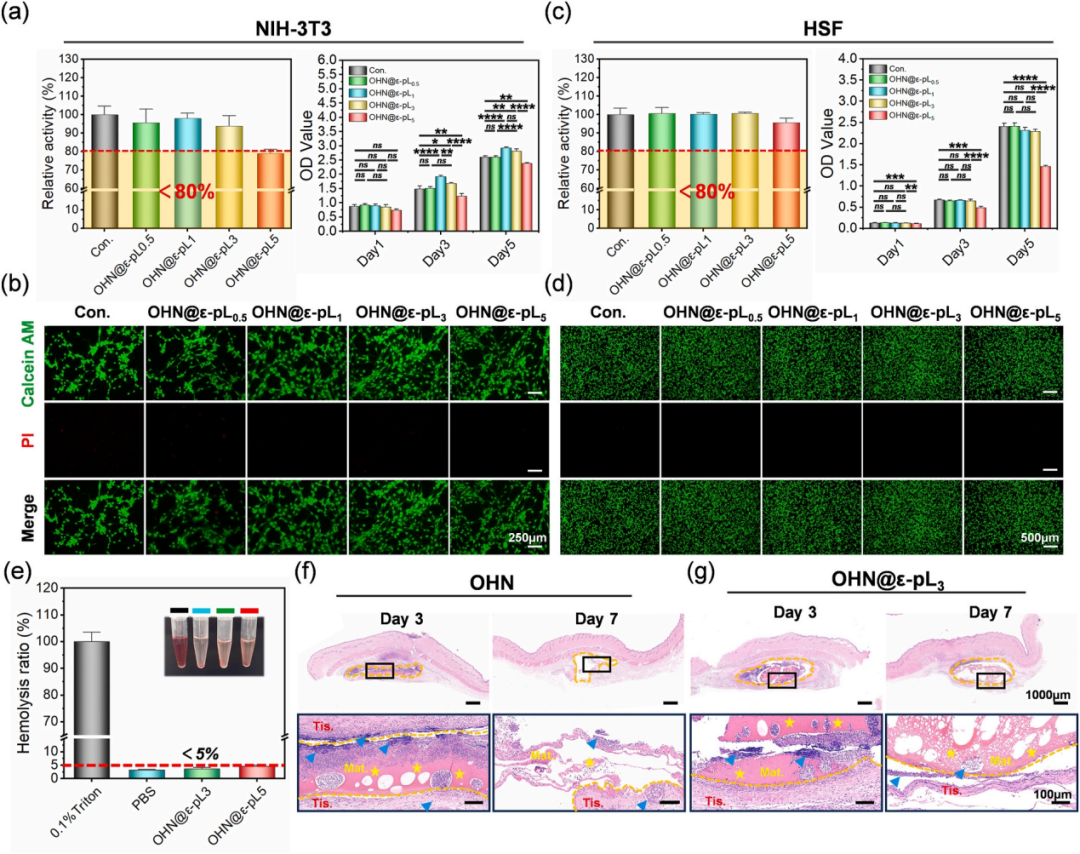
图4 OHN@ε-pL海绵的生物相容性
5.OHN@ε-pL海绵的体内止血性能
本研究采用标准化大鼠肝脏关键切口、大鼠尾部截断、大鼠股静脉切口及大鼠心包切口出血模型评估OHN@ε-pL海绵的止血效果(图5)。通过出血持续时间、失血量和止血时间的对比均表明了海绵材料优异的止血能力。
根据在各种出血模型中观察到的止血效果,OHN@ε-pL海绵与目前市售的止血剂相比表现出更优异的止血能力。OHN@ε-pL海绵的多孔结构使其能够快速吸收血液并吸引凝血因子来帮助凝血。其自吸湿性将界面流体转化为溶剂,溶剂溶解海绵并暴露其反应基团。反应基团相互作用或与组织和血液成分相互作用形成凝胶或粘附,形成强大的止血屏障。此外,海绵中带正电荷的ε-pL可以吸引血细胞、血小板和血浆纤连蛋白,通过静电相互作用促进血液凝固。
因此,OHN@ε-pL海绵的多种机制协同作用大大增强了其止血效果,使其适用于各种出血情况。
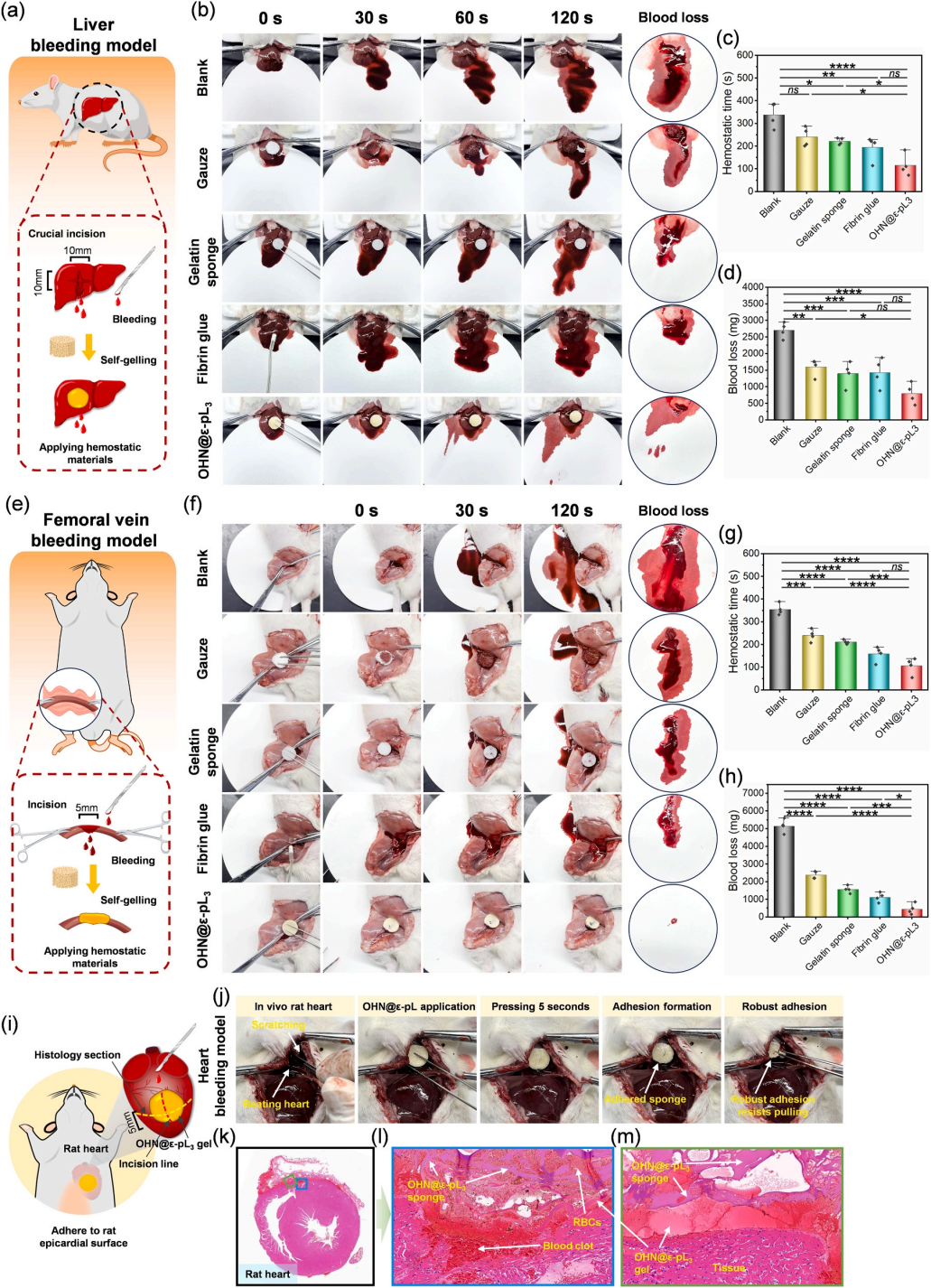
图5 OHN@ε-pL在大鼠模型中的体内止血效果
6.OHN@ε-pL海绵的体外凝血活性及止血机制
本文通过体外凝血试验探究了OHN@ε-pL海绵对凝血因子的激活作用。图6a展示了OHN@ε-pL海绵在大鼠肝出血模型中的凝血机制。对肝脏出血部位的SEM检测显示,OHN@ε-pL凝胶紧密粘附在肝脏上,凝胶内存在致密的红细胞,可能是受凝胶自吸湿性质的吸引在转变前形成的(图6b)。对凝胶内部的高倍SEM图像显示,红细胞分布密集,其表面被来自激活的凝血途径的纤维蛋白丝网络覆盖(图6c)。SEM可以看出,大量红细胞聚集在凝胶表面,各组之间的红细胞密度没有显著差异(图6d)。与纱布、明胶海绵和纤维蛋白胶组相比,OHN@ε-pL组的血小板聚集率增加,形状发生明显变化,从不规则的圆盘状变为梭形或多边形,表面覆盖有纵横交错的纤维蛋白。综合来看,
海绵的止血性能可能依赖于其多孔结构、静电效应以及从海绵到凝胶的转变过程中与细胞膜的相互作用,有助于募集红细胞和血小板并激活凝血途径,发挥止血作用(图6e)
。作者还证明了海绵的体外凝血活性及止血机制研究表明,其快速止血效果可能归因于快速吸收血液、自凝胶特性和促进内源性凝血途径激活的协同作用(图6f-k)。
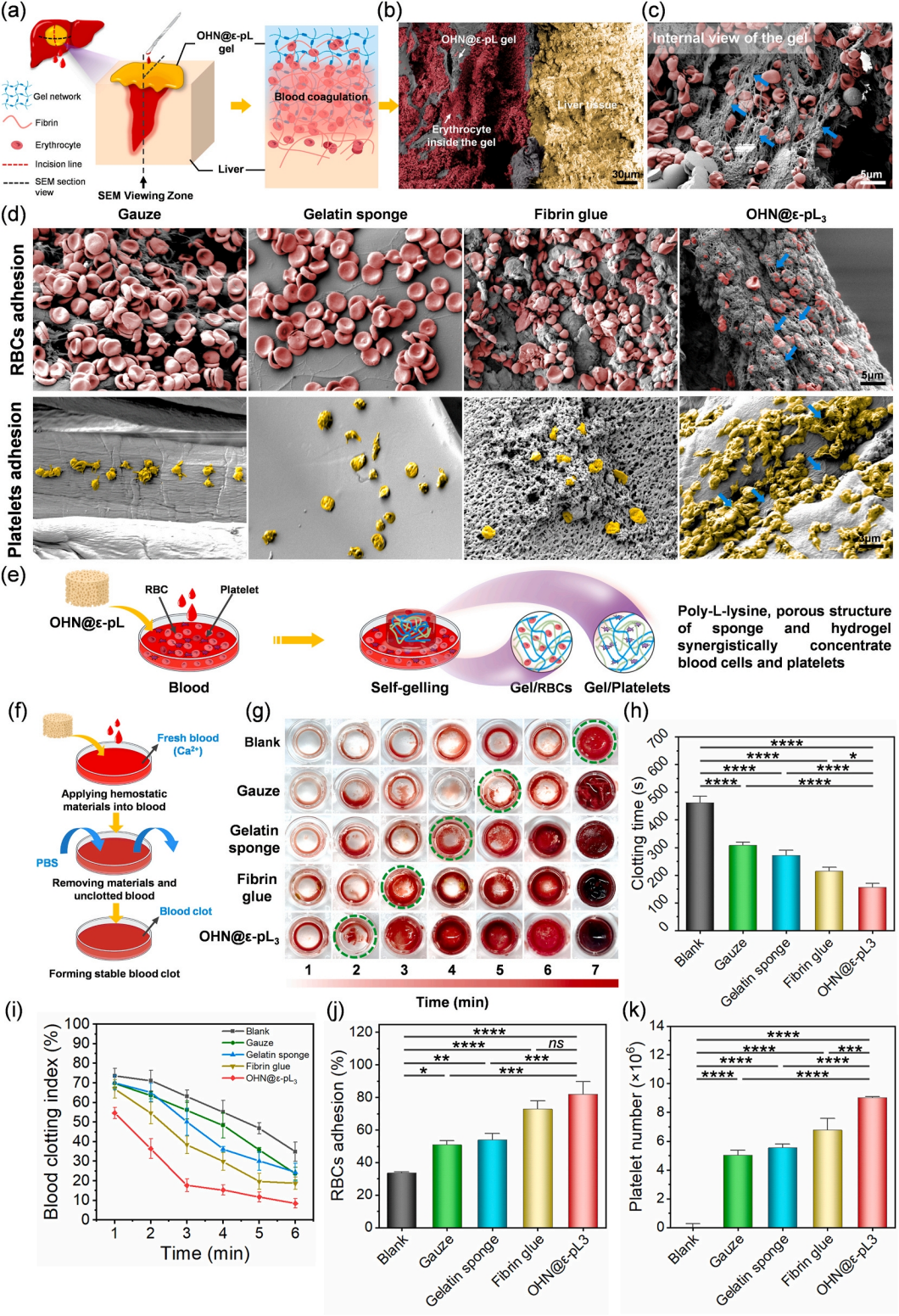
图6 OHN@ε-pL海绵的体外凝血特性
7.OHN@ε-pL海绵的伤口闭合能力
通过在大鼠背部构建全层皮肤切口评估其在体粘附和伤口闭合能力(图7)。宏观观察以及组织染色表明海绵材料可以有效促进伤口愈合。基于其良好的普通伤口愈合能力,作者进一步对海绵用于感染性皮肤伤口的愈合作用作了实验(图8)。
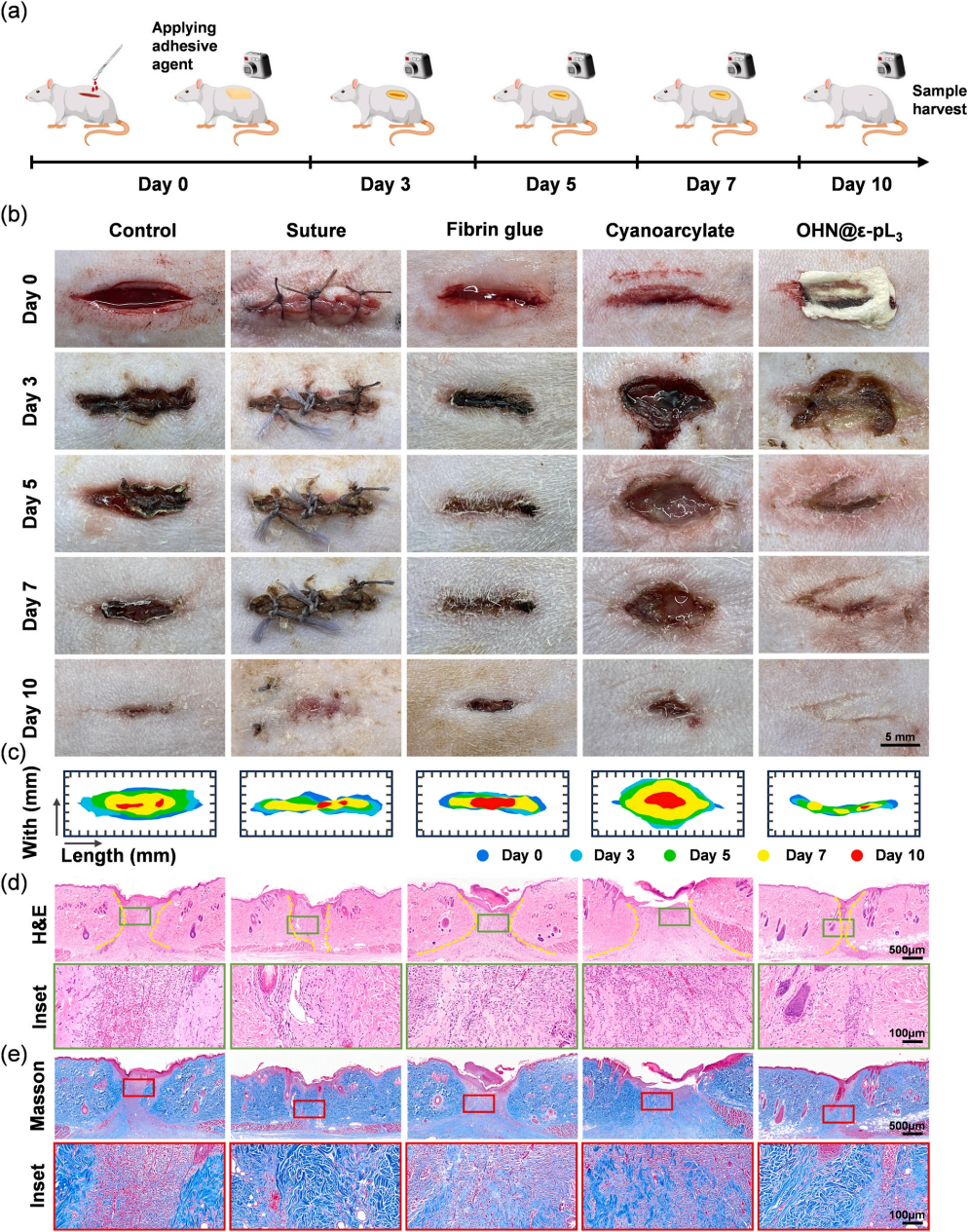
图7 体内粘附及伤口闭合性能
首先,体外抗菌实验(菌落计数、染色、平板法)表明海绵材料具有优异的抗菌性能(图8a-e)。基于此,作者建立了小鼠背部全层皮肤伤口感染金黄色葡萄球菌的模型(图8f)。接种金黄色葡萄球菌后第2天(记为第0天),白色细菌生物膜覆盖所有伤口表面,证实感染模型建立成功(图8g)。肉眼可观察到材料组具有最好的修复效率,可以有效加速伤口愈合(图g-h)。H&E和Masson染色对感染伤口组织进行组织学分析表明材料组有最好的胶原沉积效果(图8j-k)。同时,利用CD31免疫荧光染色证实了血管的进一步生成。
综合说明,该海绵材料通过促进肉芽组织再生、血管生成和胶原沉积加速了小鼠全层皮肤伤口感染伤口的愈合过程。
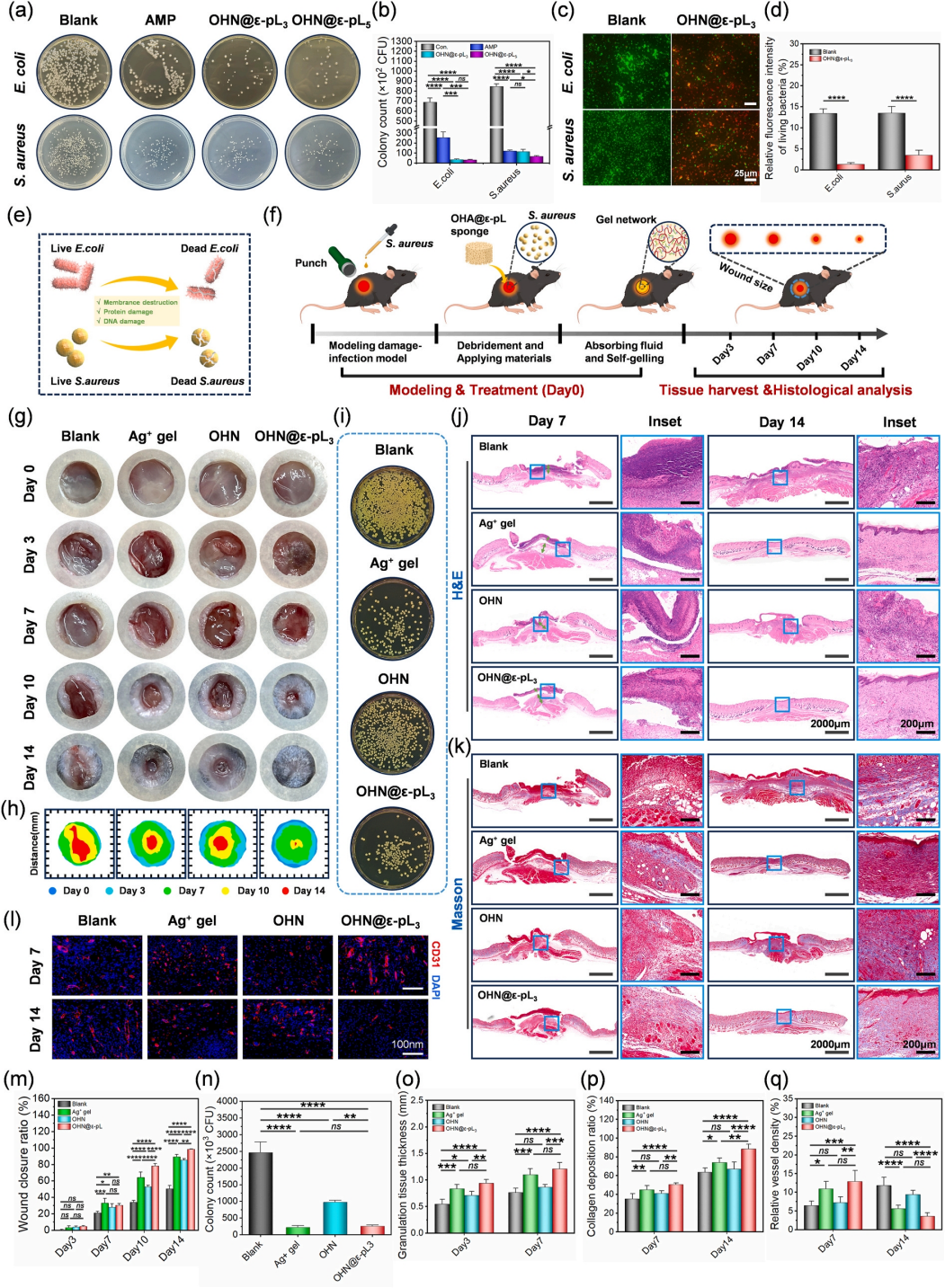
图8 OHN@ε-pL海绵的体内/体外抗菌和伤口愈合性能
此外,进一步的染色结果表明海绵材料可以通过抑制炎症因子过度表达有效抑制金黄色葡萄球菌感染伤口的炎症并加速愈合过程(图9)
。实验结果表明,海绵敷料通过快速止血、减少炎症、增强胶原沉积和血管生成,有效调节伤口的各个阶段——止血、炎症、增生和重塑,从而加速上皮化和皮肤愈合(图9f)。这些发现强调了海绵在临床应用方面的巨大潜力。
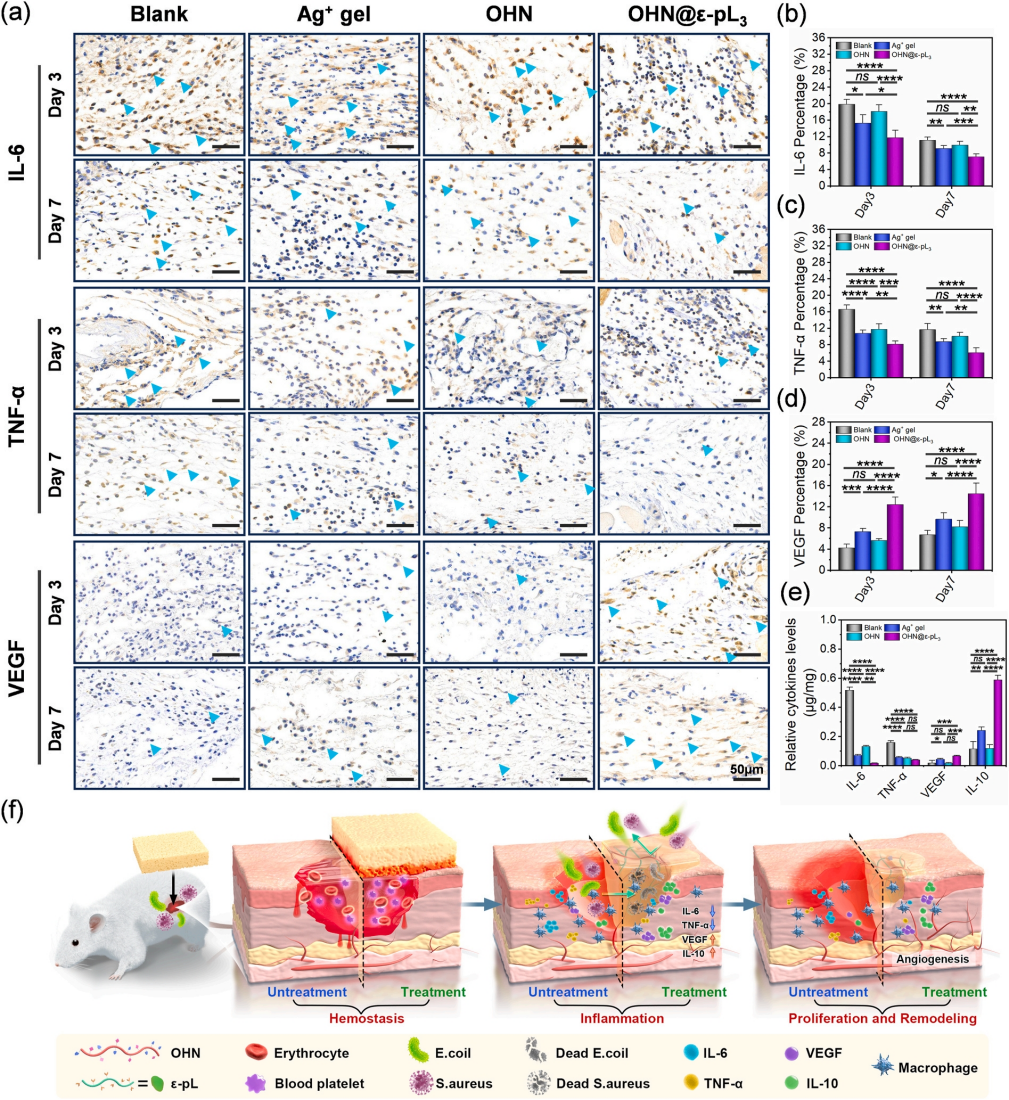
图9 第3天和第7天的伤口肉芽组织的免疫组织化学染色
综上,本文设计了一种基于多糖的海绵(OHN@ε-pL),它具有自吸湿性能、快速自凝胶能力和强湿粘附性。凝胶中的阳离子ε-pL促进红细胞和血小板的聚集和粘附,激活内在凝血途径。OHN@ε-pL海绵的自凝胶和湿粘附特性与内在凝血途径激活协同作用,显著改善止血功能。此外,OHN@ε-pL海绵具有优异的生物相容性和抗菌性能。在感染金黄色葡萄球菌的小鼠全层皮肤缺损模型中,OHN@ε-pL凝胶表现出优异的抗菌活性,显著减轻感染伤口的炎症,增强胶原沉积、血管生成和上皮化,加速伤口愈合过程。总之,OHN@ε-pL海绵是治疗临床急性和/或不可压迫性出血、预防感染和加速伤口愈合的止血敷料的最佳候选材料。
参考资料:
https://doi.org/10.1016/j.bioactmat.2024.12.016
来源:
EngineeringForLife
声明:仅代表作者个人观点,作者水平有限,如有不科学之处,请在下方留言指正!






