前言
12月18日,国家药监局发布公告,批准1类创新药罗沙司他胶囊(商品名:爱瑞卓)上市,该药品目前尚未在其他任何国家上市。这一举动是中国药品审批史的重大里程碑,中国从此真正被认为具有首创新药的审批能力。
罗沙司他(Roxadustat)是肾性贫血领域绝对的重磅药物,其真正的研发者是躺在医药巨头安斯泰来(Astellas)和阿斯利康(AstraZeneca)后的FibroGen, Inc. (FGEN)。都说伟大男人背后有一位伟大的女人,那么,国际医药巨头背后的FGEN公司是否也是潜力满满?
本报告共分上下两个部分,上篇介绍了公司的整体情况与重磅产品Roxadustat;下篇分析了公司另外两个产品Pamrevlumab与FG-5200。
投资要点
公司的产品增值动力包括:
Roxadustat研发推进。
Phase III – PYRENEES是Roxadustat与ESA发生头对头比较的临床III期试验,预计Now - 02/28/19发布Topline数据,该结果预计大概率和现有的分析一致。Now - 06/30/19将提交Roxadustat的NDA。
Pamrevlumab用于IPF治疗的研发推进,用于胰腺癌治疗的研发推进。
FG-5200在中国的研发推进。公司的这三款产品研发确定性较高,预计在低位入手风险低。
FibroGen最值钱的三条产品线价值:
Roxadustat产品价值合理估计为22.3亿美元,乐观估计为31.5亿美元,Roxadustat项目估值内容包括了里程碑费用;Pamrevlumab产品当前价值为6.4亿美元;FG-5200当前价值为3.94亿美元。
公司当前产品总价值合理估计为32.6亿美元,乐观估计为41.8亿美元,公司当前的现金资产约7亿美元。基于此,比较合理地估计FGEN的公司价值约为35-40亿美元,乐观估计45-49亿美元。
公司介绍
FibroGen是美国的一家处于临床研究阶段的生物医药公司。FGEN目前进入临床研究阶段的产品主要为:
Roxadustat。为口服的低氧诱导因子(HIF) prolyl羟化酶(PH)抑制剂。抑制这种羟化酶可以稳定HIF, HIF参与红细胞生成,包括内源性EPO的诱导、铁储备的动员和利用,以及抑制炎症细胞因子对红细胞生成的抑制作用。产品目前用于三大适应症:透析依赖的慢性肾衰(DD-CRF)性贫血、无需透析的慢性肾衰(DI-CRF)性贫血和肿瘤化疗导致的贫血。Roxadustat的研究均已进入临床III期。
Pamrevlumab。是一种全人单克隆抗体,可抑制结缔组织生长因子(CTGF)的活性。CTGF是慢性纤维化和增殖性疾病的常见因素,其特征是持续和过度的组织纤维化,可导致器官功能障碍和衰竭,在癌症中则会促进肿瘤生长。Pamrevlumab目前用于特发性肺纤维化(IPF)、胰腺癌和杜氏肌营养不良(DMD),目前均处于临床II期。
FG-5200,作为重组胶原形成的高度浓缩的纤维基质,可作为一种人造角膜,改变当前角膜移植依赖器官捐献的状况。目前正在中国进行临床试验。
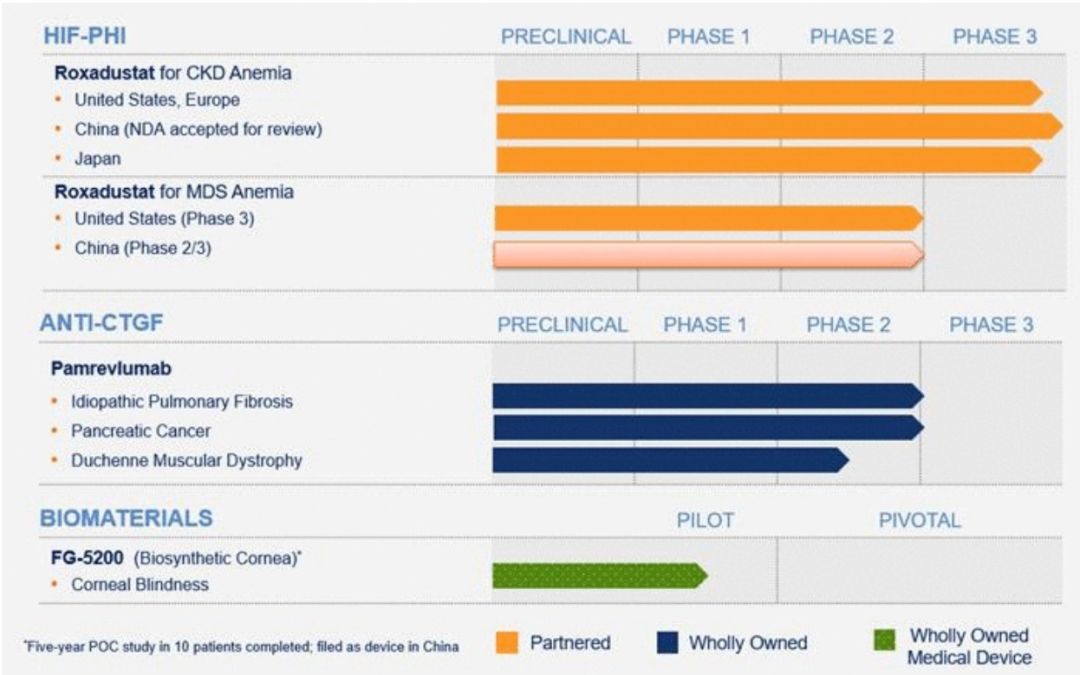
Roxadustat市场分析
疾病介绍:
贫血是一种疾病,患者表现为红细胞不足,血红蛋白(Hb)水平低。Hb为红细胞中的一种蛋白质,能将氧气输送到全身的细胞中。贫血与住院风险增加、心血管并发症、需要输血、其他严重疾病恶化和死亡有关。血红蛋白水平越低,贫血越严重,对患者的健康影响越大。
贫血在慢性肾衰竭(CKD)患者中尤为普遍,CKD是美国和欧洲的一个严重医疗问题,最常见的原因是糖尿病和高血压。CKD影响了全球2亿多人,并显著增加了这些患者的医疗成本。通过测量肾脏的过滤功能(GFR),将CKD分为五个阶段。
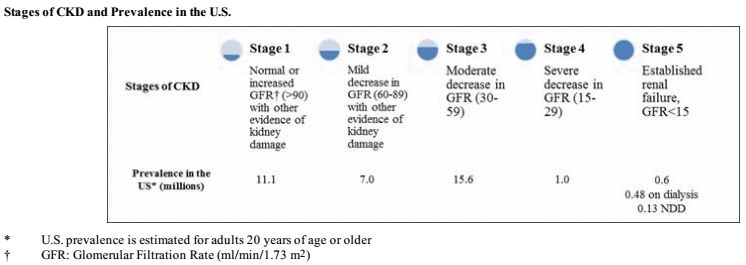
而在美国,CKD的五个阶段中贫血发生概率如下表。
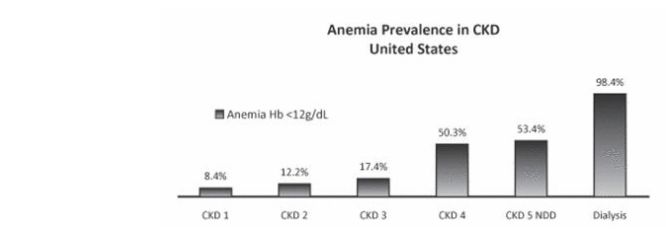
另一导致贫血的重大原因是化疗。癌症的放化疗过程导致骨髓抑制进而导致骨髓干细胞不能正常增殖和分化,进而导致血细胞减少。
疾病治疗
目前治疗CKD贫血的疗法包括可注射的红细胞生成素(ESAs)、静脉输注铁、口服铁和输血。ESAs可直接作用于促红细胞生成素受体,具强有效地提高血红蛋白水平。1989年首个ESA的上市被认为是CKD贫血治疗方面的重大进展,因为它显著降低了输血需求。但是2006年至2009年期间发表的研究表明,使用更高剂量的ESA达到Hb目标水平(13 - 15克/分升)的安全性风险,促使医生在严重的安全性问题与ESAs的有效性之间进行权衡。在这些研究中观察到的注射用ESAs的安全性问题包括心血管不良事件和死亡的风险增加。随后,FDA对于ESAs在临床中的应用做出了诸多限制。保险支付机构对于ESAs的开出也降低了支持力度。
癌症治疗中的贫血目前主要是静脉输注铁、口服铁及输血。ESAs也曾被用于该适应症的治疗,但2006-2009年的研究表明,ESAs能导致癌症患者肿瘤复发的可能性增加。2007年FDA对于ESAs用于该适应症的治疗发布了黑框警告,该警告是FDA对于处方药发出的最高级别的警告。
已获批竞争药物:
目前已获批用于DD-CRF(透析依赖的慢性肾衰)、DI-CRF(不依赖透析的慢性肾衰)和Anemia Due to Oncology Treatment的药物均为ESAs或铁剂(注射或口服)。
|
DD-CRF
|
DI-CRF
|
Anemia Due to Oncology Treatment
|
|
Approved in US
|
8
|
8
|
3
|
|
Approved in Europe
|
4
|
3
|
4
|
|
Approved in other than U.S./E.U.
|
3
|
2
|
2
|
|
Withdrawn from Market
|
1
|
0
|
0
|
与现有获批的竞争药物相比(仅比较适应症DI-CRF)
|
药物类型
|
ESAs
|
铁剂
|
HIF-PH抑制剂
|
|
作用机制
|
EPOR
|
补铁
|
HIF-PH
|
|
药品名称
|
Mircera
|
Feraheme
|
Roxadustat
|
|
入组标准
|
不设定Hb范围
|
>9.0 g/dL且 ≤11.5 g/dL
|
Hb≤10.0 g/dL,CKD stage3/4
|
|
响应比例
|
97.5%,28周
|
48.7%,起效周期内
|
欧美研究试验目前仅披露与安慰剂组相比p<0.05,而在中国进行的临床试验,18周该值能达到72.1%。27周高于10g/dL的比例为86%。
|
注:“响应比例”定义为治疗后Hb水平提高1g/dL以上
单从有效性考虑,ESAs>HIF-PH抑制剂>铁剂。
贫血用药/疗法的市场定位(综合信息进行的总结,非官方来源):
|
CKD stage 1/2
|
CKD stage 3/4
|
CKD stage 5
|
Anemia due to oncology treatment
|
|
ESAs
|
N/A
|
N/A
|
√(主要用于透析病人)
|
N/A
|
|
铁剂
|
√
|
√
|
√
|
√
|
|
输血
|
N/A
|
N/A
|
√(限严重病人)
|
√
|
|
HIF-PH抑制剂
|
N/A
|
√
|
√
|
√
|
因此,HIF-PH未来主要的用途包括
1.用于CKDStage 5病人中ESAs治疗稳定后的ESAs药物取代
2.用于CKD stage 5病人中当前未透析但存在严重贫血,现有药物无法满足其需求
3.取代部分CKDStage3/4病人中铁剂市场
4.肿瘤化疗贫血病人中,取代部分输血治疗
临床中的HIF-PH竞争药物:
|
产品名称
|
公司
|
所处阶段
|
适应症
|
|
GSK1278863
|
GSK
|
III
|
DDCRF/
DI-CRF
|
|
Molidustat
|
BAYRY
|
III
|
DDCRF/
DI-CRF
|
|
Roxadustat
|
ANZ,FGEN,Astellas
|
III
|
DDCRF/
DI-CRF/
Anemia due to oncology treatment
|
|
Vadadustat
|
AKBA
|
III
|
DDCRF/
DI-CRF
|
|
FG-2216
|
FGEN
|
II
|
DDCRF/
DI-CRF
|
|
JTZ-951
|
Torii Pharmaceutical Co., Ltd. (4551:JP)
|
I
|
DDCRF
|
GSK1278863,10/25/2018发布的DDCRF-III期数据显示,治疗前受试者Hb平均水平为9.10 g/dL,有82%的受试者第24周Hb水平达到10-12 g/dL。01/01/20 - 12/31/20将发布中期数据。
Molidustat于06/23/2018启动DDCRF的III期临床,DI-CRF的II期临床试验中,Hb水平提高0.46g/dL,而对照药ESA(Darbepoetin)仅提高0.18g/dL.
Vadadustat,10/25/2018发布的DDCRF的III期临床高剂量组第6周提高Hb水平by 0.41 g/dL, 01/01/19 - 12/31/19将发布中期数据。DICRF的II期试验中,第20周提高Hb水平by 54.9 %,III期数据将于01/01/19- 12/31/19发布。
FG-2216上次数据更新时间为2005年,估计试验已暂停。
JTZ-951 2013年启动I期后,一直无数据公布。
DDCRF/DI-CRF治疗领域内,Roxadustat、Molidustat、Vadadustat和GSK1278863未来可能瓜分HIF-PH抑制剂市场。Roxadustat为最早获批,可能也是best-in-class,因此市场占有率最保守估计为25%,比较可能的市场占有率为33%。





















