今天是2017年8月25日
农历七月初四
医麦客:为肺癌治疗翻开新篇章
2017年8月25日/医麦客 eMedClub/--现如今,免疫治疗的飞速进展已经彻底改变了我们沿袭多年的非小细胞肺癌(NSCLC)治疗模式,其中以PD-1/PD-L1代表的检查点抑制剂更是非常重要的新治疗选择。
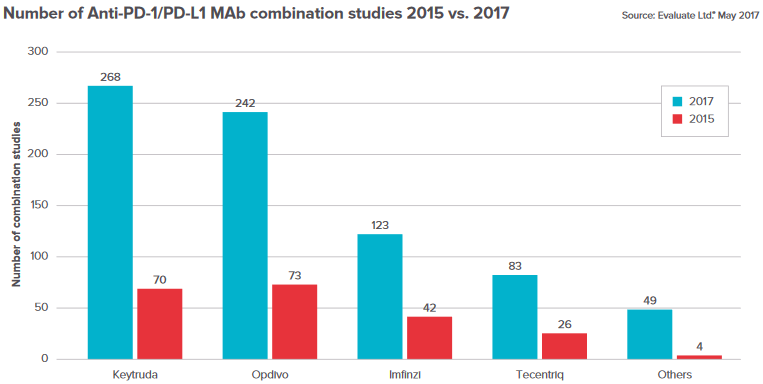
Keytruda火力全开(图片来源 EP Vantage)
2017年5月,默沙东宣布,FDA加速批准Keytruda(pembrolizumab)联合化疗(培美曲塞+卡铂)一线治疗转移性非鳞状非小细胞肺癌。而且不需要考虑PD-L1表达水平,Keytruda均可作为一线药物使用,自此,Keytruda在肺癌领域取得压倒性胜利!
而此次批准更是将早前处于二线治疗的肺癌免疫治疗推向了振奋人心的一线,为肺癌治疗翻开了崭新的一页。
针对NSCLC的一线/二线免疫治疗的最新试验进展如何?
哪些患者会从中获益?
潜在的组合疗法有哪些?
一线治疗NSCLC
2016年10月,FDA批准Keytruda(pembrolizumab)用于一线治疗PD-L1表达水平≥50%且没有EGFR或ALK基因突变的转移性非小细胞肺癌(NSCLC)。用法为固定剂量200mg每3周1次,直至疾病进展、出现不可耐受毒性或24个月疾病无进展。
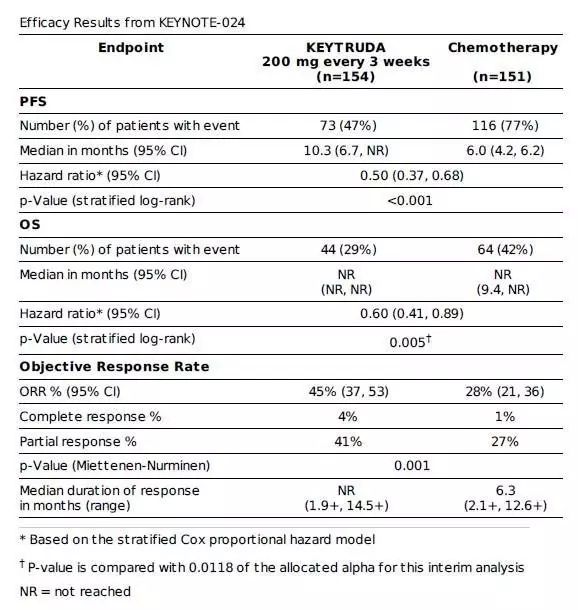 KEYNOTE-024(图片来源 MSD)
KEYNOTE-024(图片来源 MSD)
FDA此次批准主要基于一项代号为KEYNOTE-024的关键性III期临床研究的积极数据,结果显示,对于PD-L1高表达(TPS≥50%)的晚期NSCLC患者,Keytruda单药使用作为一线疗法相比标准化疗(包括紫杉醇+卡铂、培美曲塞+卡铂、培美曲塞+顺铂、吉西他滨+卡铂、吉西他滨+顺铂)可以更明显地改善PFS和OS。
2017年5月10日,默沙东宣布,FDA加速批准Keytruda(pembrolizumab)联合化疗(培美曲塞+卡铂)一线治疗转移性非鳞状非小细胞肺癌。
至此,对于非鳞状NSCLC患者(约占NSCLC的70%),再也不用考虑PD-L1表达水平了,Keytruda均可作为一线药物使用。
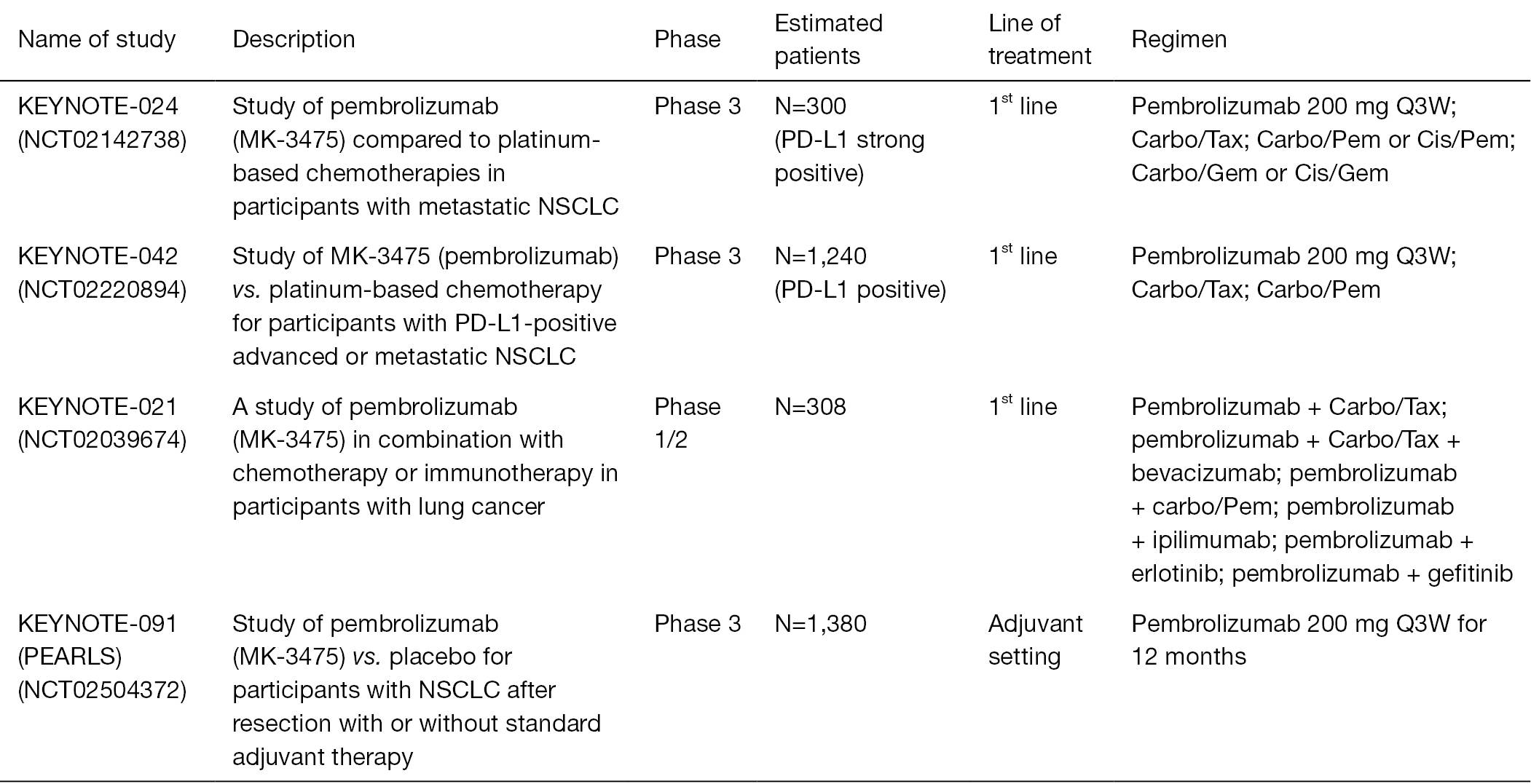
Keytruda临床试验(图片来源 atm)
而此次FDA加速批准Keytruda肺癌新适应症主要基于KEYNOTE-021研究中队列G1的数据。在123名未接受过治疗且不携带EGFR或ALK突变的的转移性非鳞状NSCLC患者(不考虑PD-L1表达水平)中,患者随机接受Keytruda200mg+培美曲塞500mg/m2 + 卡铂 AUC 5mg/mL/min 或者培美曲塞500mg/m2 + 卡铂AUC 5 mg/mL/min每三周一次治疗。
Keytruda治疗组与化疗组相比,ORR(客观缓解率)分别为55%vs29%、 PFS分别为13.0 vs 8.9个月。Keytruda治疗组和化疗组应答持续期不少于6个月的患者比例分别为93%和81%。
另外,KEYNOTE-001的临床数据也表明了显著的生存获益,不考虑PD-L1表达水平,接受Keytruda单药治疗的16%的NSCLC患者,在第5年仍然存活。而这与标准疗法相相比,存活率提高了四倍。

除了临床试验数据外,美国肿瘤治疗指南(NCCN)还建议医生对患者首先使用最有效的治疗方法,而这对默沙东来说则是一个机会,因为并非所有的患者都有机会接受二线治疗。
此外,预计明年将有更新的III期临床数据以支持Keytruda 联合化疗用药的组合,并进一步加强其一线治疗的地位。而这将在BMS(百时美)、AstraZeneca(阿斯利康)和Roche / Genentech(罗氏/基因泰克)的潜在单药治疗和组合批准之前取得重要进展。
二线治疗NSCLC
目前,在二线治疗中,研究人员并未发现PD-1抗体和PD-L1抗体的疗效有什么不同。此外,研究表明PD-L1在二线治疗中似乎并不是一个很好的生物标志物,即使对于PD-L1抗体,Tecentriq也是如此。
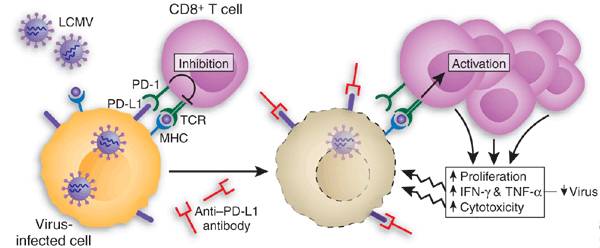
PD-1/PD-L1(图片来源 Nature)
安全性差异很小:由于PD-1抗体和PD-L1抗体之间的疗效差异无从界定,所以研究人员对其安全性差异作了讨论。而这可能与PD-L1相关,例如轻度降低自身免疫事件的风险,重要的是,据报道10-15%的患者会出现自身免疫性疾病的并发症。
针对这些患者,医生正在考虑如何对其使用免疫治疗。与此同时,美国FDA表示,具有自身免疫性疾病的患者,在接受了PD-1 /PD-L1抗体之后,只有9%的患者经历了其潜在病症的恶化,3%经历了3-4级的不良反应事件。因此在短期内,这些数据可能有助于减轻对其安全性的担忧。
PD-L1抗体的便利性:综上,二线治疗NSCLC的免疫疗法的安全性和疗效并没有明确区别,但便利性似乎是PD-1 / PD-L1抗体选择的关键驱动因素。是否需要进行活检,以及病人是否愿意每隔两周就去诊所,而不是三周。出于这个原因, Tecentriq(PD-L1)正在从Opdivo那里获得市场份额。
免疫治疗中涉及的预测性生物标志物
目前NSCLC 获益人群还不确定,PD-L1 状态应作为一线治疗新的疗效预测标志物,要求在治疗前检测。如果免疫治疗成为多数 NSCLC 的标准一线治疗,则需研究获得性耐药机制及局部治疗联合免疫治疗的有效性。
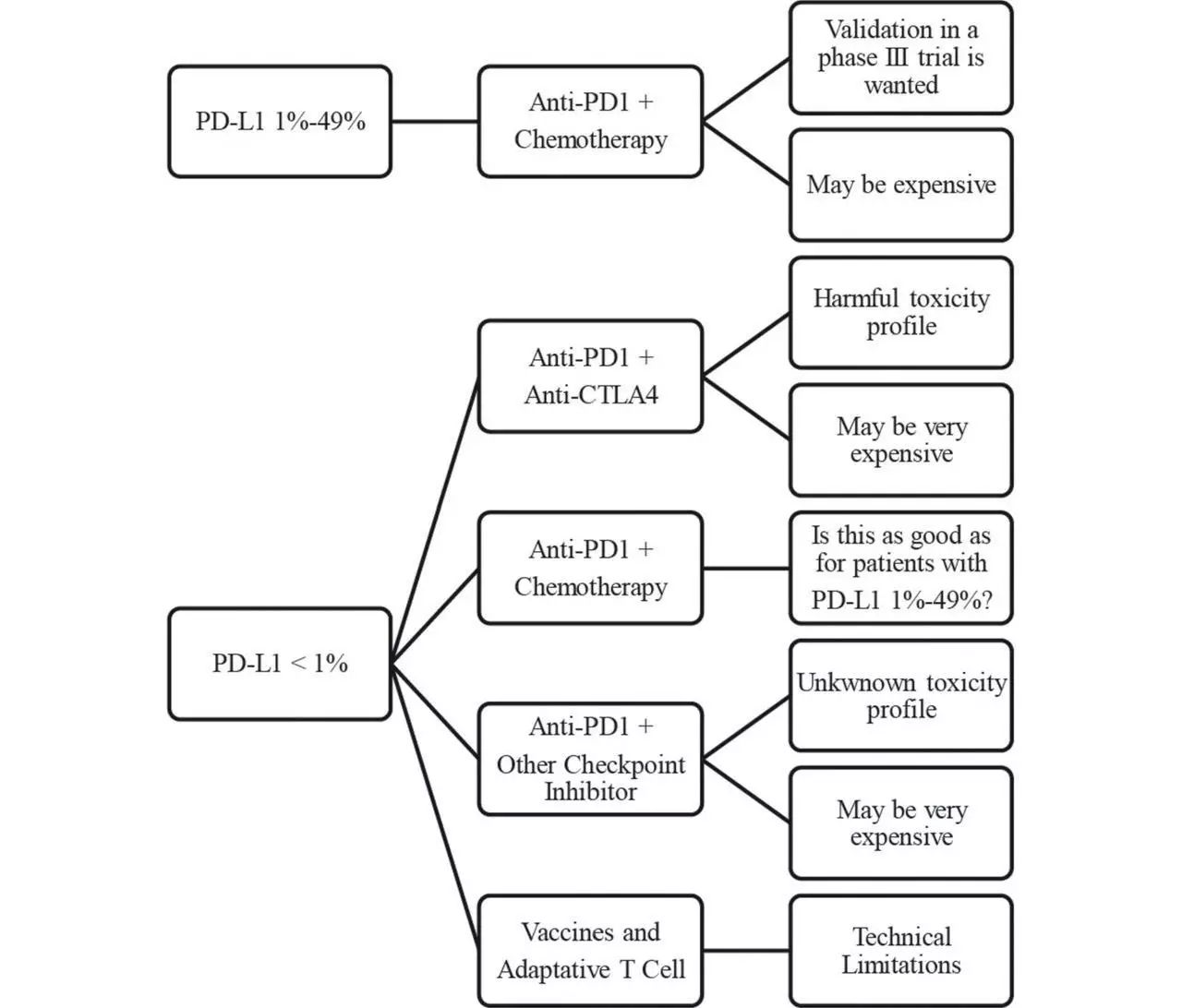
根据PD-L1表达水平选择治疗方式(图片来源 BMJ)
而确立PD-L1的表达作为预测性生物标志物的最初的努力也产生了多种结果。PD-L1表达的升高明确地预示着从PD-1/PD-L1抑制剂中获益的可能性增加,但也存在少数PD-L1阴性患者也会从这些药物中获益。
虽然PD-1/PD-L1抗体为晚期NSCLC免疫治疗带来希望。但是由于其缺少可定义的生物标志物,介于免疫治疗毒性和临床获益率低的考虑,用药的选择具有挑战。
因为用组织PD-L1表达来筛选患者做治疗,情况是比较复杂的。所以需要进一步研究免疫检查点蛋白表达、基因特征、新抗原模型及T细胞相关反应等。以更好地理解药物机制,预测治疗反应,更好的预测标志物以帮助筛选出优势患者群体。
随着研究人员对生物学的进一步了解,复合生物标志物可能是筛选符合免疫治疗策略的患者的新方向。目前,许多制药企业正在朝着这个概念迈进。
PD-1/PD-L1抗体联合疗法进展
IDO抑制剂:在2017 ASCO年会上,报道了Keytruda可以作为携带TRK融合基因突变的的抗癌广谱药,而Epacadostat(IDO抑制剂)可以提高Keytruda 17%的有效率,可以作为大显奇效的辅助用药。
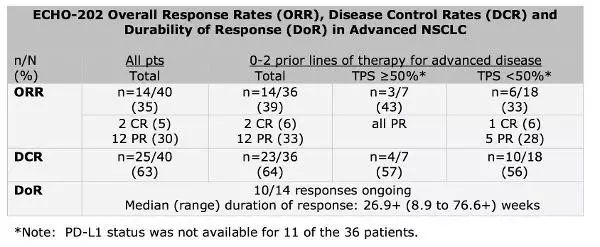
IDO抑制剂联合Keytruda(图片来源thestreet.com)
研究显示,接受联合用药的40例晚期非小细胞肺癌患者中的总体反应率(ORR)为35%。其中2例患者完全缓解(CR),12例患者部分缓解(PR);11例疾病稳定(SD),疾病控制率(DCR)达63%.
抗GITR:研究表明,OX40(又称CD137,属于TNF受体家族)活性增强剂与PD-1抗体联合应用可提高机体的抗肿瘤免疫功能。
PD-1联合疗法(图片来源 incyte)
相似地,协同刺激分子受体激素诱导性TNFR相关蛋白(GITR)可以活化T细胞,并促进其增殖和细胞因子的产生。PD-1抗体/GITR 抗体联合应用,可增强机体的免疫功能,结果显示,联合用药组较对照组有更好的抗肿瘤反应。同时在此联合疗法的基础上再联合化疗药(顺铂和紫杉醇)可进一步延长患者的无瘤生存期。
抗ICOS:与PD-1抗体联合使用,初始数据表明没有额外的安全性问题。目前,研究队列正在进一步扩大,以招募具有高ICOS表达的患者,其中也包括NSCLC患者。
抗CD27:在2017 ASCO年会上,公布了Celldex公司的以CD27为靶点的单克隆抗体varlilumab与PD-1抗体Opdivo联用治疗多种实体瘤的临床研究结果。
34位患者中,经过治疗后,3位患者出现部分缓解,其中1位肿瘤病灶直径缩小了94%,无进展生存期超过19个月;11位患者保持病情稳定。此外,该临床试验证明了这种联合用药方法安全性好、耐受度高,免疫反应明显。
CAR-T:事实上,PD-1抗体对大部分晚期肿瘤患者的有效率仅有20%,且在治疗的过程中出现了耐药的情况。同时CAR-T疗法在实体瘤方面也面临着肿瘤浸润和肿瘤微环境的挑战。
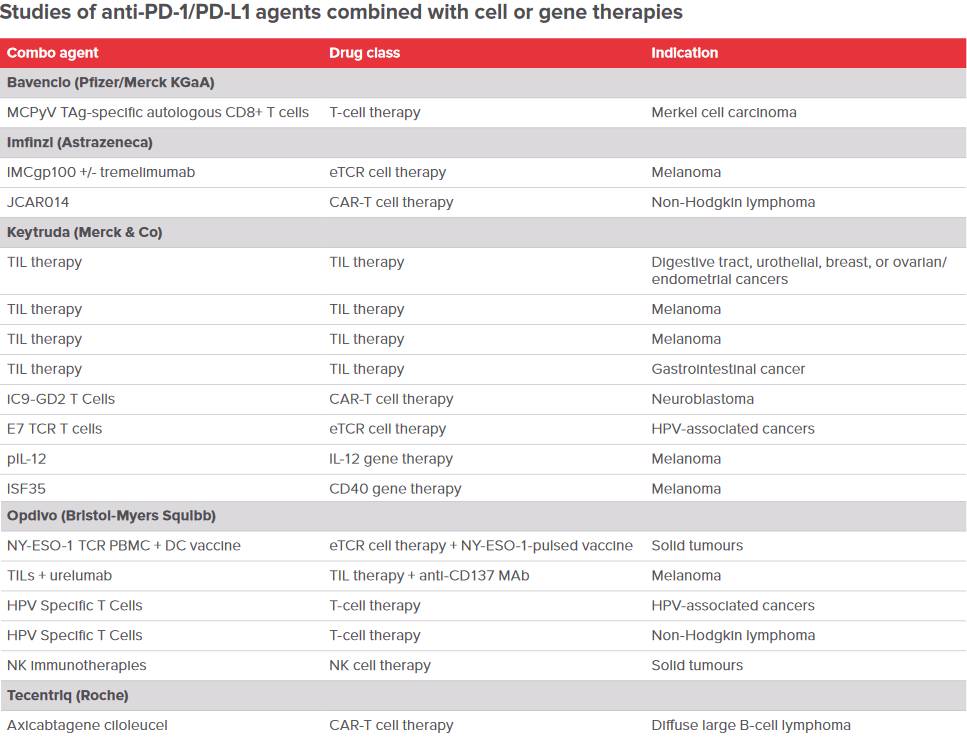
PD-1/PD-L1抗体联合细胞疗法(图片来源 EP Vantage)
所以如何提高疗效和避免部分有效的患者产生耐药,同时也弥补CAR-T治疗实体瘤方面的缺陷性,这给CAR-T的临床研究者提出了挑战。
而近年来,免疫疗法和其他疗法组合的思路逐渐盛行,其中包含联合化疗、放疗和靶向治疗。当然其中还包括了早前的报道,罗氏的PD-L1抗体与Kite的CAR-T疗法联姻等。
预期新数据
以下所有研究的数据预计将在明年公布:

阿斯利康(AZ):其PD-L1抗体durvalumab(Imfinzi)与CTLA-4抗体tremelimumab联合用药的名为Mystic的III期临床。
2017年7月,公司公布了这项III期临床的中期分析结果,然而结果表明这个组合的首要终点PFS未达预期,并且已有数据显示durvalumab单药治疗改善PFS的机会也很小。不过公司表示,试验的另一个首要终点是OS,而这个数据要到明年才能出来。
目前,阿斯利康拒绝透露中期分析的OS趋势,受此消息影响,该公司股票一度暴跌17%,100多亿市值瞬间蒸发。

罗氏/基因泰克(Roche/Genentech): 其PD-L1抗体Tecentriq联合化疗在治疗非鳞状NSCLC中的临床表现中也不如默沙东的Keytruda。
该项名为IMpower 150的研究评估Tecentriq联合化疗以及Avastin(贝伐珠单抗)的数据预计在今年年底之前公布。
百时美(BMS): 2016年8月,BMS公司宣布Opdivo一线治疗非小细胞肺癌(PD-L1阳性表达患者)的一项代号为CheckMate-026的III期试验失败。
研究结果表明,在PD-L1表达≥5的患者中,Opdivo和铂类标准化疗组合相比,中位PFS分别为4.2vs5.9个月。总生存期为14.4vs13.2 个月。显而易见,与化疗相比Opdivo并没有什么优势!
除此之外,另一项名为CheckMate-227的研究内容包括Opdivo作为一种单一疗法、或与Yervoy(CTLA-4)抗体联合治疗。目前,正在研究Yervoy 1mg/kg的低剂量预计将会在保留药效的同时减少毒性,预计会在明年公布研究结果。
总而言之,投资者和生物技术公司仍然继续保持着对肿瘤免疫疗法开发的热情。我们期待着更多的临床数据可以证明组合疗法的协同作用,以帮助更多患者从中获益。医麦客也会继续关注更多正在进行中的临床实验,提供有价值的后续报道。
行业新洞察
肿瘤免疫疗法的发展趋势将是联合治疗。随着多种新型抗肿瘤疗法的发现,人们已经意识到单凭一种疗法是无法攻克肿瘤这一顽疾。只有通过不同机制的抗肿瘤联合治疗,如抗肿瘤疫苗与PD-L1联用、CAR-T疗法与PD-L1联用,以及肿瘤免疫疗法与基因疗法联用等。靶向药物和免疫抗肿瘤药物的联合治疗必将得以广泛应用。
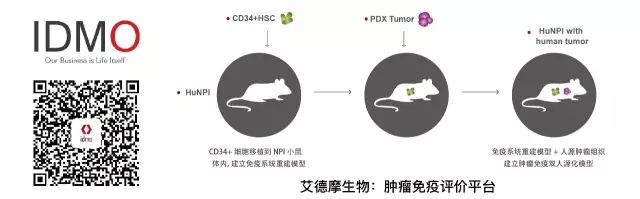
艾德摩生物技术有限公司首席执行官彭思颖博士介绍,我们构建了一种“肿瘤免疫双人源化小鼠”,并以该模型为基础建立肿瘤免疫疗法评价平台——IdealImmune。该模型的的构建过程有两个关键:人源免疫系统的重建和患者来源肿瘤组织的异种移植。我们以自主构建的重度免疫缺陷NPI小鼠为原型,将人的造血干细胞(HSCs)移植到小鼠体内,使其重建人免疫系统并在此基础上移植人源的肿瘤组织,最终获得肿瘤免疫双人源化模型。
这几年的研究表明,包括PD-1/PD-L1抗体和CTLA4抗体等在内的检查点抑制剂具有非常卓越的抗癌能力。然而,作为免疫疗法的一种,检查点抑制剂无法在常规的肿瘤疗法的研发及评价平台上进行验证,这意味着需要构建一套针对肿瘤免疫疗法特有的临床前评价方法。
为了验证艾徳摩IdealImmune平台是否能够很好地模拟抗癌药物在肿瘤微环境中本应发挥的作用(例如CD8+T细胞的激活、细胞因子的释放等),我们以非小细胞肺癌和胰腺癌为肿瘤模型,使用PD-1抗体对小鼠进行治疗。
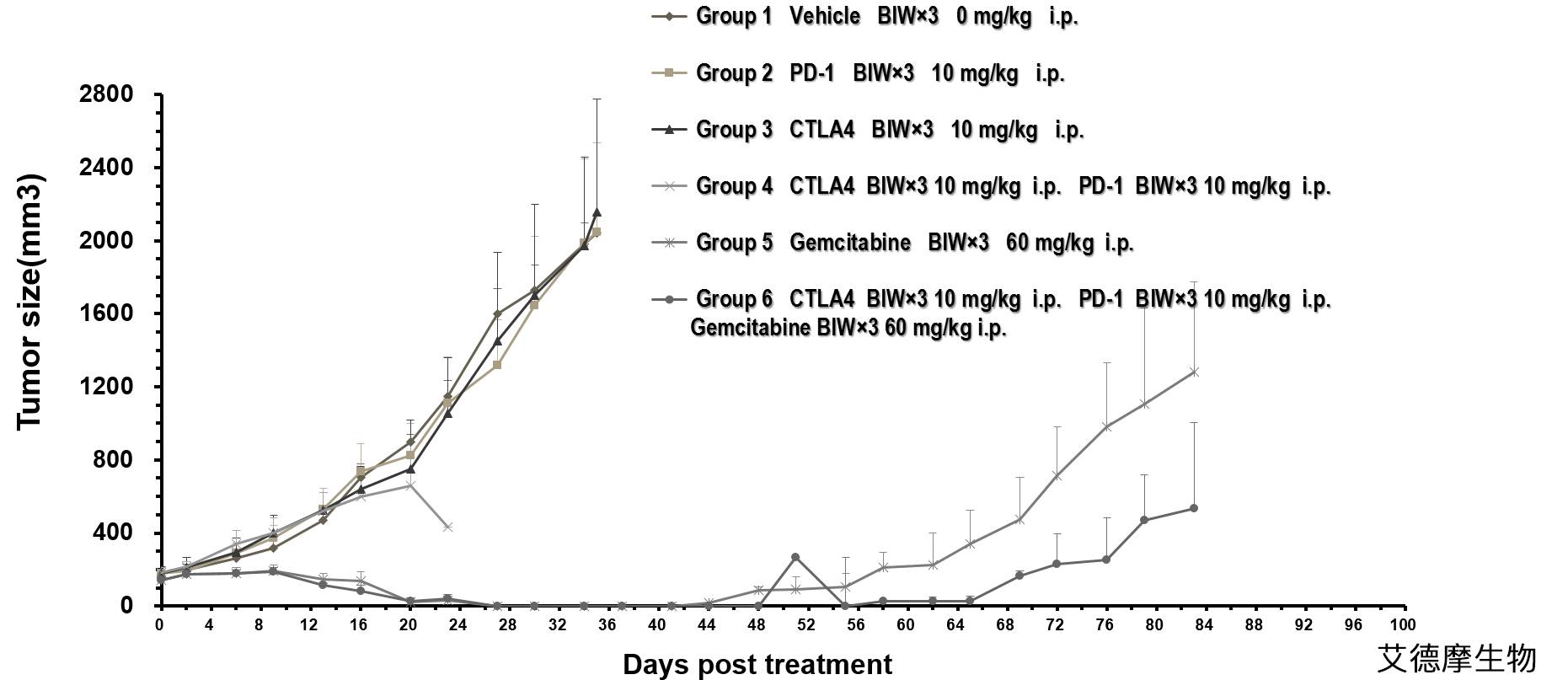
联合治疗方案的评价(Collaboration with Crownbio)
结果显示,相比于对照组,用药组小鼠肿瘤组织中浸润的CD8+T细胞数量明显增加,通过流式分析能够观察到相应免疫检查点被抑制,而且能够检测到其释放的细胞因子。这意味着,在肿瘤免疫双人源化小鼠模型中,免疫检查点抑制剂能够有效地激活具有杀伤能力的CD8+T细胞。
参考出处:
http://deep-dive.pharmaphorum.com/deep-dive-future-pharma-july-2017#!/evolving-immunotherapy-strategies-in-nsclc
http://ascopubs.org/doi/abs/10.1200/JCO.2017.35.15_suppl.1103
http://info.evaluategroup.com/rs/607-YGS-364/images/epv-pdct17.pdf
医麦客 丨推荐
为生物医药发声的专业媒体人
转载请联系:[email protected]
☟ 阅读原文 免费加入「个人会员」

















