敬请关注接下来同写意的论坛活动
第91期—夯实新药中美双报的审评科学与技术基础
(北京,5.18-5.20)
第92期—高品质复杂注射剂研发与产业化发展(待定)
第93期
—
2019中美医疗投资论坛和路演(纽约,6.14-15)
第94期
—
仿制药研发立项--策略与方法(上海,6.28-30)
第95期
—
创新药项目的综合评估(苏州,7.6-7)
靶向治疗不仅提高了患者生存率,也降低了药物副作用,可谓一举两得。然而,由于各种原因,很多靶点并不具备成药性。蛋白裂解靶向嵌合体(PROTAC)技术利用细胞自身的蛋白质降解机制来降解那些不具成药的靶点,有望解决成药性难题。
近几年,专注于蛋白降解技术的美国生物制药公司Arvinas就已获得基因泰克、默克、辉瑞等巨头支持。上月,该公司研发的靶向雄激素受体(AR)的ARV-110一期临床试验的招募,开启了PROTAC技术的新时代。
未来3-5年,预计PROTAC技术将大放异彩,攻克一个个不能成药的靶点,最终为人类健康带来福祉。

药物靶点和成药性

人类发展的历史也是一部和疾病对抗的历史。从对疾病束手无策到慢慢摸清它们的脾气,找到症状,对症入药。特别是随着近代医学和生物学的发展,我们终于了解什么才是导致疾病的主要原因。很多时候,是维持我们身体机能的某些蛋白质出了问题。而这些蛋白质,就可能是治疗疾病的靶点。
有了靶点,我们就可以开启靶向治疗。与化疗和放疗不同,靶向治疗能够更精准地治疗疾病,并呈现出更少的副作用。阻断靶点功能有几种:小分子靶向药、生物大分子药和基因编辑技术。
小分子药物通过与靶点结合,阻断靶点向下的信号传递,从而抑制其在细胞内发挥功能,达到治疗疾病的目的。《我不是药神》里治疗慢性白血病的格列卫就是小分子靶向药的典型代表。
近年来,大分子生物药发展可谓如火如荼,特别在肿瘤治疗领域大放异彩。大分子生物药包括多肽、蛋白和抗体等。最近异常火爆的PD1/PD-L1抗体市场就足够说明这一切。在中国市场,已经有四家药企上市了该类产品,包括两家外企和两家本土企业,价格战打得也是精彩纷呈。
学过生物学的都知道:蛋白质是由RNA翻译而来的。因此,如果要抑制蛋白质的功能,可以从源头上“掐死”—直接抑制编码的RNA。全球首款干扰RNA(siRNA)也于2018年顺利上市。近年来更加“高大上”的基因编辑技术如CRISPR的诞生有可能带来更大的变革。
大部分传统小分子药物以及抗体药物都是靶向蛋白质类的靶点。但实际上我们目前能够通过药物干预的这些靶点只占人体内蛋白的很小一部分,大约有80%-90%的蛋白是传统的药物研发手段无法进行有效干预的
【1】
。
主要原因是很多这类蛋白靶点缺乏能够直接参与蛋白功能调节的结合腔。而siRNA和CRISPR技术则由于药物递送和脱靶效应,也不能很好地达到抑制靶蛋白的功能。
巧妇难为无米之炊,找到了靶点却束手无策,这是对人类智商的极大考验。就在此刻,人们想起了体内蛋白的一种降解机制:泛素化降解。
泛素—蛋白酶体系统
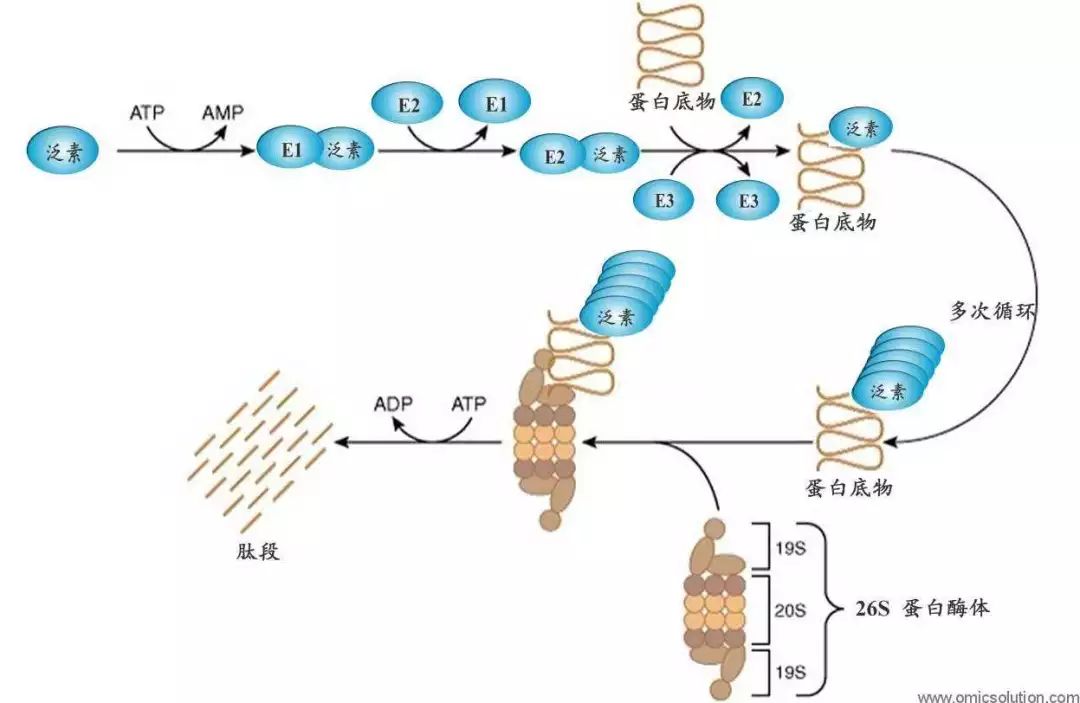
想了解泛素化降解,就必须知道什么是泛素。其实泛素就是真核细胞(动植物等)内的一类小分子蛋白质。泛素在细胞体内扮演着重要的角色,对维持蛋白质稳定和活性至关重要
【2】
。
泛素化就像一个标签,一旦一个蛋白质被贴上了这样一个标签,就等于告诉细胞这个蛋白质需要处理。于是,被贴上标签的蛋白质就运送到蛋白酶体—一种降解蛋白质的细胞器。
2004年,阿龙·切哈诺沃、阿夫拉姆·赫什科、欧文·罗斯因发现了泛素调解的蛋白质降解过程而获得了诺贝尔化学奖。
那么,就有必要了解一下泛素化的基本过程。如上图所示,泛素化就像一条流水线。泛素分子先经过第一个装配工E1(泛素激活酶),随后传递给第二个装配工E2(泛素结合酶),最后第三个装配工E3(泛素连接酶)把泛素和靶蛋白装配一起,送往蛋白酶体,“肢解”成肽段。
既然泛素降解这么有奇效,我们是不是可以脑洞大开:把不可成药的靶点贴上泛素化的标签,然后被拉到蛋白酶体进行降解,一切问题解决!
PROTAC技术的诞生
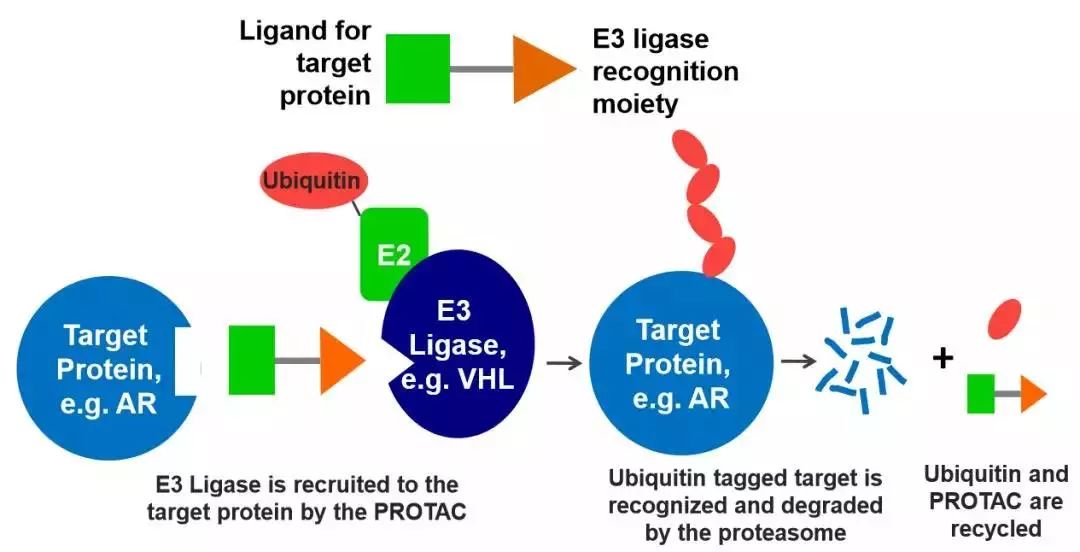
1999年Proteinix公司首次递交了PROTAC的专利申请。两年后,耶鲁大学的Craig Crews博士和加州理工学院的Raymond Deshaies博士发表了一篇论文:诱导针对2型蛋氨酸氨肽酶(METAP2)的PROTAC技术开发
【3】
。
随后Crews博士和他的同事不断对这种技术进行改良,并使其演变为一种医药模式。2013年,Crews博士创建了Arvinas公司。而当时在辉瑞肿瘤部的Ian Taylor博士在报纸上看到这则消息时,产生了浓厚的兴趣。如今Taylor博士成为了Arvinas公司的生物学高级副总裁,他将负责这一新兴治疗方式的第一项临床试验。
那么,一个完整的PROTAC包括什么?如上图所示,PROTAC主要包括三个部分:蛋白配体、linker和E3连接酶。配体能够和靶标蛋白结合,linker是连接配体和E3连接酶的部分。
配体就像胶水一样,一旦和靶标结合,就能把它拉向E3连接酶,被贴上标签,送往蛋白酶体,进行降解。靶标蛋白被降解后,PROTAC安然无损,整装待发,又可以去“祸害”下一个蛋白。
人体中有大约600种E3连接酶,它们有各自独特的活性和分布特征。募集到合适的连接酶与靶标蛋白结合是一个研发项目能否成功的关键之一。目前只有5到6种E3连接酶得到公开验证,可以被用在靶向降解剂中
【4】
。
PROTAC技术历经两代的发展,这两代技术的最大区别就是配体类型的不同。第一代配体用的是多肽,第二代用的是小分子。当然,linker和E3连接酶的选择对特异性降解靶标蛋白也至关重要。

























