来源:磁共振成像传媒
潘希敏, 胡美玉, 潘碧涛, 等.3D-T2-DRIVE联合3D TOFMRA诊断面听神经微血管压迫的意义探讨. 磁共振成像, 2016, 7(11): 831-836.

江波,中山大学附属第一医院放射科,医学博士,副主任医师
教育背景:
1992
年中山大学临床医学系六年制本科毕业;
1998
年~
2003
年攻读中山医科大学医学影像学和核医学专业研究生,
2001
年
6
月获硕士学位,
2003
年
6
月获博士学位。
2007
年~
2008
年,获国家留学基金资助在瑞典
Linkoping
大学
CMIV
学习功能
MRI
。
专业特长:
中枢神经系统疾病临床
MRI
诊断和骨软组织肿瘤影像学诊断
获得奖励或荣誉称号:
2000
年广东柯麟医学教育基金优秀研究生奖
研究方向:
脑肿瘤
MRI
诊断
社会兼职:
欧洲放射学会会员,
RSNA
会员
面听神经的微血管压迫可导致面肌痉挛、耳鸣和眩晕等症状,其中以细动脉压迫神经根区最为常见,微血管减压术是目前公认的最佳治疗手段[1-2]。术前准确了解面听神经与周围血管的解剖关系、明确责任血管,对指导手术方案的制定有重要意义[3-4]。利用三维时间飞跃法MRA(3D TOFMRA) 显示神经、动脉关系来诊断脑神经的动脉压迫,已有较多研究报道,但3D TOFMRA上脑神经与背景的对比度低以致清晰显示脑神经较
困难[5]。磁共振嵌驱动平衡射频重聚脉冲三维快速自旋回波序列(3D T2-weighted TSE with driven equilibrium radio frequency resetpulse,3D-T2-DRIVE),具有高对比度显示脑神经的优势[6-8]。联合应用3D-T2-DRIVE和3D TOFMRA,可实现同时高分辨显示脑神经和细动脉的效果,此类研究少见报道。本研究通过3D-T2-DRIVE和3D TOFMRA的等体素、各向同性成像,比较3D-T2-DRIVE、3D TOFMRA及3D-T2-DRIVE+3D TOFMRA三种方法检测面听神经微血管压迫的效能,以探讨3D-T2-DRIVE联合3D TOFMRA在面听神经微血管压迫性病变诊断中的实际作用。
1 材料与方法
1.1 病例资料
收集我院2009年1月至2015年6月间单侧面肌痉挛或不明原因耳鸣、眩晕患者的MRI与相关临床资料。所有患者中,19例基底动脉瘤、23例椎动脉重度迂曲扩张及11例桥小脑角区占位性病变被排除,余下36例纳入研究。男性11例,女性25例,年龄13~71岁,结果均经手术或临床追踪随访证实。
1.2 扫描及图像重组方法
采用PhilipsAchieva Nova Dual 1.5 T超导磁共振成像系统,相控阵头部8通道线圈。患者仰卧,头先进,以内听道为中心做横轴面扫描,于同一容积内依次行3D-T2-DRIVE与3D TOFMRA序列扫描。3D-T2-DRIVE 序列扫描参数: FOV 130 mm×130 mm,层面数60,层厚0.7mm,各向同性体素0.7×0.7×0.7,重建矩阵512×512,TR 1500 ms,TE 250 ms,反转角90°,平均采集次数为2次,扫描时间6min 15 s。3D TOFMRA序列扫描参数:FOV130 mm×130 mm, 层面数60,层厚0.7 mm,各向同性体素0.7×0.7×0.7,重建矩阵512×512,TR 25 ms,TE 4.6 ms,反转角(FA) 30°,平均采集次数2,扫描时间3 min 28 s。将原始图像发送至MR工作站行T2-3D-DRIVE与3D TOFMRA序列图像的叠加、最大信号强度投影(MIP)和多平面重组(MPR)处理。MPR沿面听神经方向行斜冠状面重组和垂直于面听神经行斜矢状面重组,获取任一观察层面T2-3D-DRIVE与3D TOFMRA的2组序列图像。
1.3 图像诊断质量比较
以显示患侧面听神经、责任血管(含细动脉、细静脉)为目标,根据轴位及MPR、MIP图的信噪比、对比度及辨识度,对3D-T2-DRIVE (A组)、3D TOFMRA(B组)及3D-T2-DRIVE+3D TOFMRA (C组) 三种方法进行综合评估并评分。评分标准:不能显示0分;显示模糊不能诊断1分;显示良好能基本满足诊断需要2分;显示非常清晰能满足诊断需要3分。神经血管关系的判断:选取3组中得分最高者,在清晰显示相关神经基础上,参考文献中的等级分法[9],确定是压迫移位、接触或是无接触,其中压迫移位、接触判为责任血管,无接触则判为非责任血管。由2名高年资影像诊断主治医师采用双盲法读片。
1.4 统计学分析
应用SPSS 17.0软件进行:(1) Kruskal-Wallis H检验统计分析,计算各组得分的秩次和平均秩次
(均秩),依次比较在显示面听神经和责任血管方面,三种方法之间均秩的差异,以P<0.01为差异有统计学意义。(2) 2名读片者评分结果的Kappa一致性检验。一致性水平定义如下:K<0.4,一致性较差;0.4<K<0.6,一致性一般;0.6<K<0.8,一致性良好;0.8<K<1.0,一致性很好。
2 结果
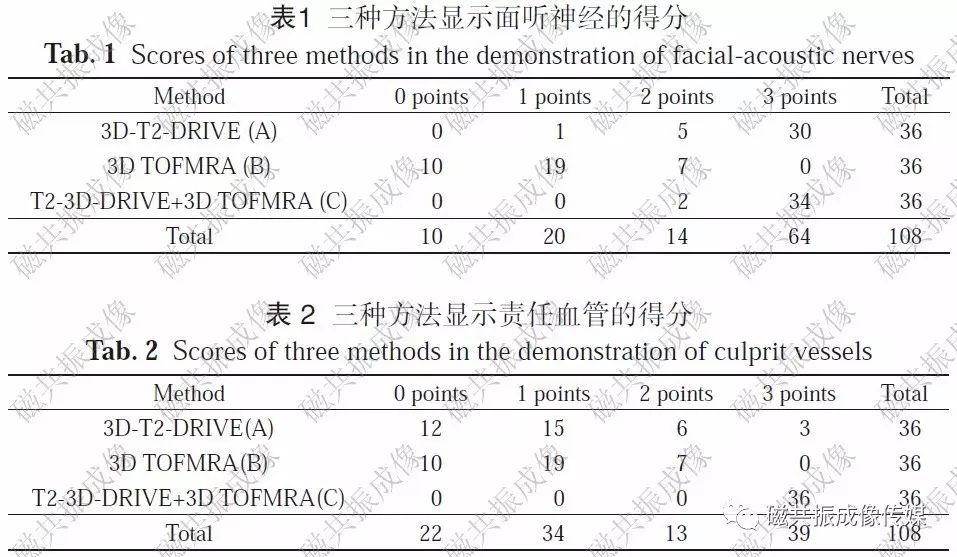
三种方法在显示面听神经方面的得分见表 1。A组均秩69.53,B组均秩19.64,C组均秩74.33,三组间差异有统计学意义(H=86.02,P=0.0000)。组间分析,A、C组间差异无统计学意义(H=2.28,P=0.1313);A、B组间(H=53.18,P=0.0000)及B、C组间差异有统计学意义(H=58.78,P=0.0000)。结果提示,在显示面听神经方面,3D-T2-DRIVE+3DTOFMRA、T2-3D-DRIVE优于3D TOFMRA。显示面听神经方面,2名读片者的评分分别为2.35±0.25和2.48±0.28,其一致性很好(K=0.85)。
三种方法在显示责任血管方面的得分见表 2。A组均秩38.21,B组均秩36.29,C组均秩89,三组间差异有统计学意义(H=11.045,P=0.0000)。组间分析,A、B组间(H=0.0083,P=0.9274)差异无统计学意义,A、C组间(H=54.12,P=0.0000)及B、C组间(H=62.42,P=0.0000)差异有统计学意义。结果提示,在显示责任血管方面,3D-T2-DRIVE+3D TOFMRA优于T2-3D-DRIVE和3DTOFMRA。显示责任血管方面,2名读片者的评分分别为1.79±0.15和1.88±0.21,其一致性很好(K=0.91)。
由表1、2可知,在显示面听神经和责任血管方面,3D-T2-DRIVE+3D TOFMRA 效果最佳。根据3D-T2-DRIVE+3D TOFMRA的轴位及MPR、MIP图像(图1~9),36例中检出面听神经根细动脉压迫阳性32例,阴性4例,均经手术或临床追踪证实。阳性32例中,面神经受压11例,听神经受压13例,面、听神经同时受压8例;责任血管源自小脑上动脉19例,小脑前下动脉8例及小脑后下动脉9例,未见责任静脉。阳性患者均经乙状窦后入路膜片隔离责任动脉与受累神经,术中所见证实了MRI所示面听神经根性细动脉压迫,未见假阳性或假阴性病例。术后耳鸣、眩晕、面肌抽搐症状消失。阴性4例,随访2~4年,症状均逐渐消失。3D-T2-DRIVE+3D TOFMRA 诊断面听神经细动脉压迫的灵敏度100%,特异度100%。