这篇文章一共有6张大图,可以分为4部分。
Fig1中提出了一个现象
,即Gabra3在乳腺癌中特异性高表达,这种高表达不仅仅和肿瘤发生有关,还和肿瘤转移有关。
Fig2-3做了基因功能研究
,采用了一正一反的方法:Fig.2过表达Gabra3促进乳腺癌转移;Fig.3沉默Gabra3表达抑制乳腺癌转移。这是功能研究的标准套路。
Fig4中提出了一个新的现象
,是关于机制的,发现Gabra3 A-to-I RNA编辑只存在于非侵袭性乳腺癌,转移性的乳腺癌会把这种现象丢失掉。
Fig5-6对机制进行深入的研究
,方法是人为的导入一种突变型载体。发现编辑后的Gabra3蛋白能影响乳腺癌的迁移、侵袭和转移;并且编辑后能降低膜上Gabra3的表达、抑制AKT磷酸化。
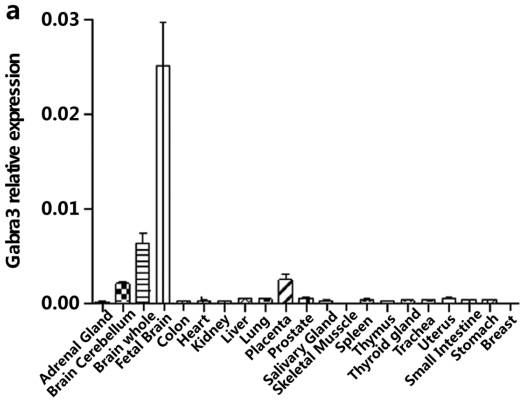
具体来看,在Fig1a中检验了Gabra3在人组织中分布的差异,发现其主要在脑组织表达,胎脑表达最高。
既然是研究乳腺癌当然要拿到肿瘤组织中去检测,发现在乳腺癌中存在一种特异性的表达。肿瘤细胞包括MDA-MB-231、MDA-MB-436、MDA-MB-453、SKBR3这几个细胞株中的表达度偏高些。而在人正常上皮细胞系,HMEL里就几乎检测不到。这也说明它和肿瘤的发生存在关系。
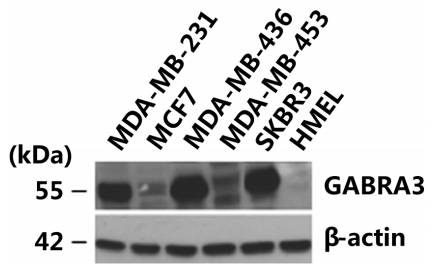
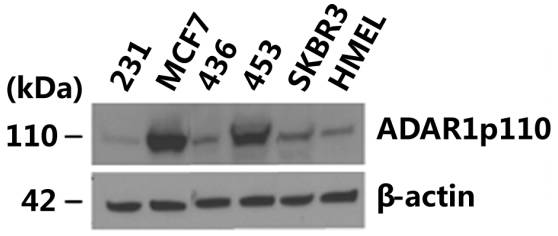
在后面的研究中,作者选择了MCF7,因为它低表达,所以做了过表达的实验;另一株选了MDA-MB-436,因为它表达最高,所以做了RNA的实验验证。这里通过WB的检测就把模型确定了下来。
除了在细胞株的检测外,还取了5对临床样本。虽然数量不多,但确是比较珍贵的配对组织中(原发灶和转移灶)的样本。做了qPCR的检测分析,发现在病人转移灶中其表达是特异性增高(Fig1c),最高80倍。
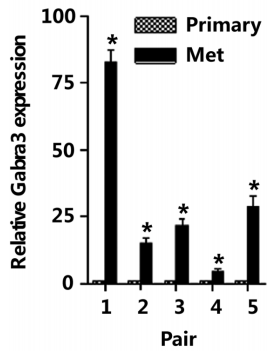
Fig1D是一个生存曲线,看Gabra3高表达和预后生存的关系,结果表明乳腺癌中Gabra3高表达预示着生存期更短。
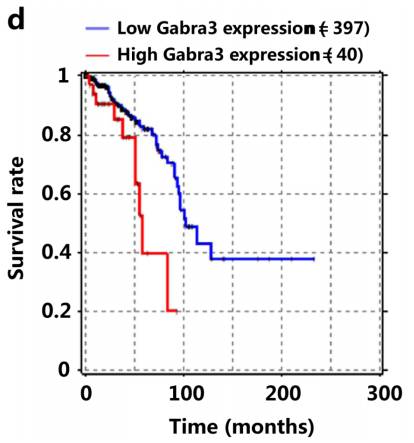
Fig2中对Gabra3人为的进行基因操作,使其高表达。
Fig2A发现MCF-7细胞过表达Gabra3后迁移能力显著增强。

Fig2b和Fig2a非常像,这个表明,
MCF-7细胞过表达Gabra3后侵袭能力显著增强。
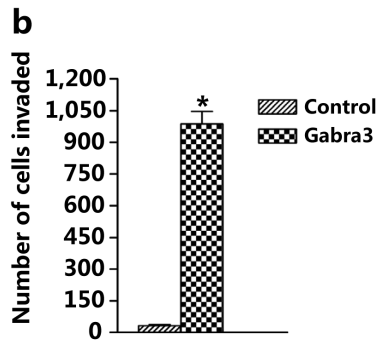
Fig2c进行了体内实验,MCF-7细胞过表达Gabra3促进裸鼠乳腺原位成瘤的肺转移。
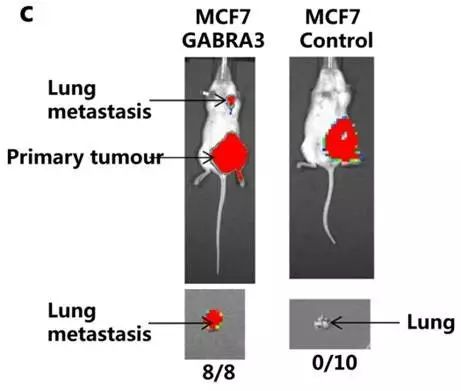
Fig2做了过表达,Fig3就反了过来做高表达细胞株的基因沉默实验,这里作者选择了MDA-MB-436细胞株,做法和Fig2一样。
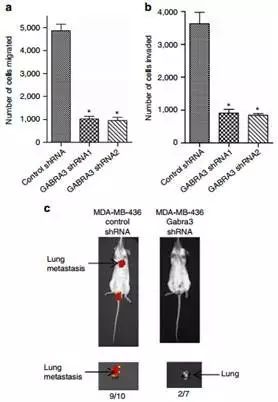
MDA-MB-436 细胞沉默Gabra3后细胞迁移能力降低,侵袭能力降低,抑制裸鼠乳腺原位成瘤的肺转移。
Fig4探讨了基因的进一步机制,这里先没有寻找Gabra3影响的通路,而是寻找其上游的调控机制。Fig4a-c 中的结果表明Gabra3 A-to-I 编辑与侵袭能力负相关。
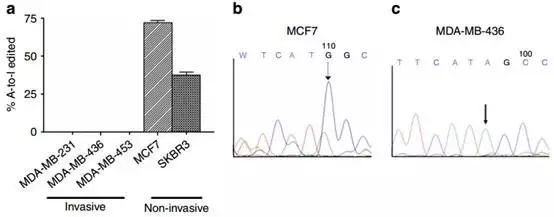
Fig4d用了之前5对乳腺癌的原发灶和转移灶,发现乳腺癌转移灶组织中Gabra3 A-to-I 编辑丢失。
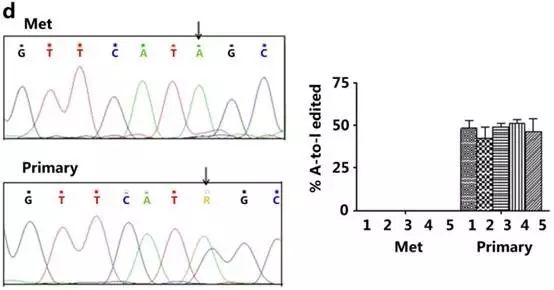
因为能够引起A-to-I编辑的主要是ADAR1蛋白,那到底是ADAR1p110还是ADAR1p150呢?答案是ADAR1p110参与乳腺癌中Gabra3的A-to-I 编辑。(ADAR1p150和ADAR2检测不到)
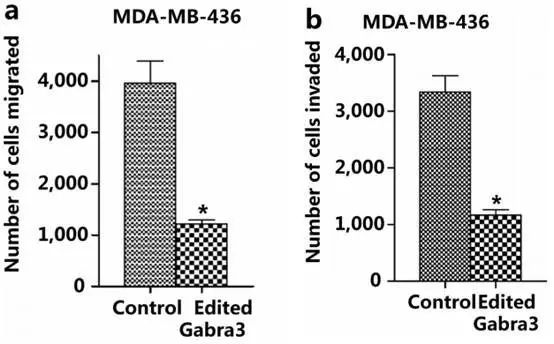
经过前面现象的提出,接下来就要人为调控A-to-I的编辑。Fig5发现通过A-to-I RNA编辑 可以抑制乳腺癌迁移、侵袭和转移。Fig5a、b中MDA-MB-436细胞导入编辑的Gabra3可抑制迁移和侵袭。
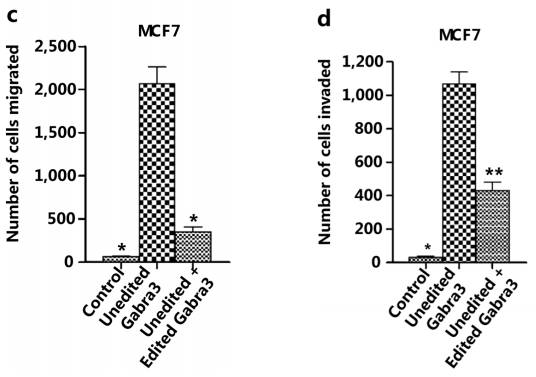
反过来在MCF-7细胞导入突变的未编辑Gabra3可显著增加迁移和侵袭(该表型可恢复)。
体外做完了,体内再重复一下,用的还是小鼠模型。MDA-MB-436细胞导入编辑的Gabra3可抑制乳腺癌肺转移。
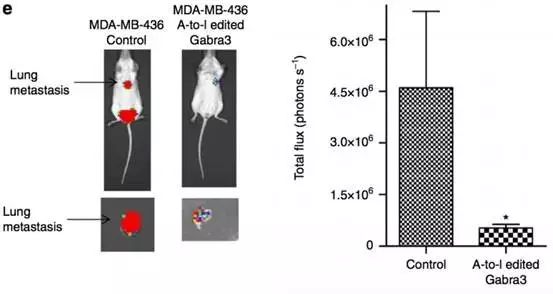
到了Fig6,开始搞下游信号通路。作者首先做了个流式分析,看看膜表面Gabra3的表达。
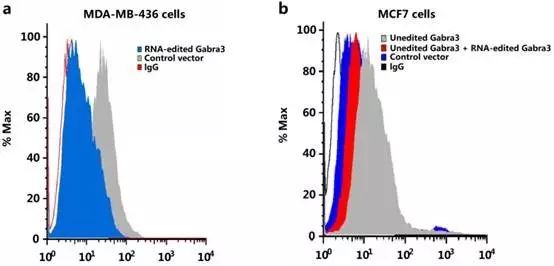
Fig6a:MDA-MB-436细胞导入编辑的Gabra3降低膜表面Gabra3表达
Fig6b:MCF-7细胞导入突变的未编辑Gabra3增加膜表面Gabra3表达
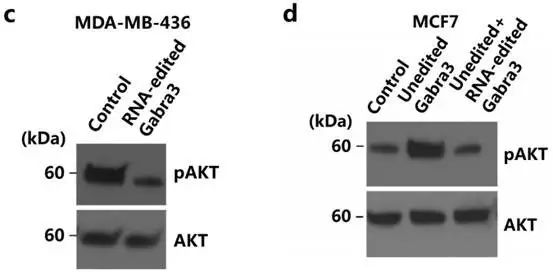
Fig6c:MDA-MB-436细胞导入编辑的Gabra3降低磷酸化AKT表达
Fig6d:MCF-7细胞导入突变的未编辑Gabra3增加磷酸化AKT表达






