癌症免疫治疗
通过激活患者自身免疫系统杀伤肿瘤细胞,但传统树突状细胞(DC)疗法依赖体外操作,存在成本高、细胞存活率低、归巢效率差等问题。此外,肿瘤微环境(TME)的免疫抑制特性进一步削弱了治疗效果。
现有递送方式(如静脉注射)易导致佐剂降解和脱靶效应,亟需开发
一种高效、稳定的原位递送系统
,直接调控DC活性并激活T细胞,以实现持久抗肿瘤免疫应答。

鉴于此,来自
印度理工学院孟买分校(IIT Bombay)的Prakriti Tayalia
团队开发了一种
基于聚乙二醇二丙烯酸酯(PEGDA)-聚赖氨酸(PLL)的宏孔支架
,用于原位递送肿瘤裂解物(抗原)和壳聚糖复合的聚肌胞苷酸(poly(I:C))佐剂,通过调控树突状细胞激活T细胞,显著抑制黑色素瘤生长。
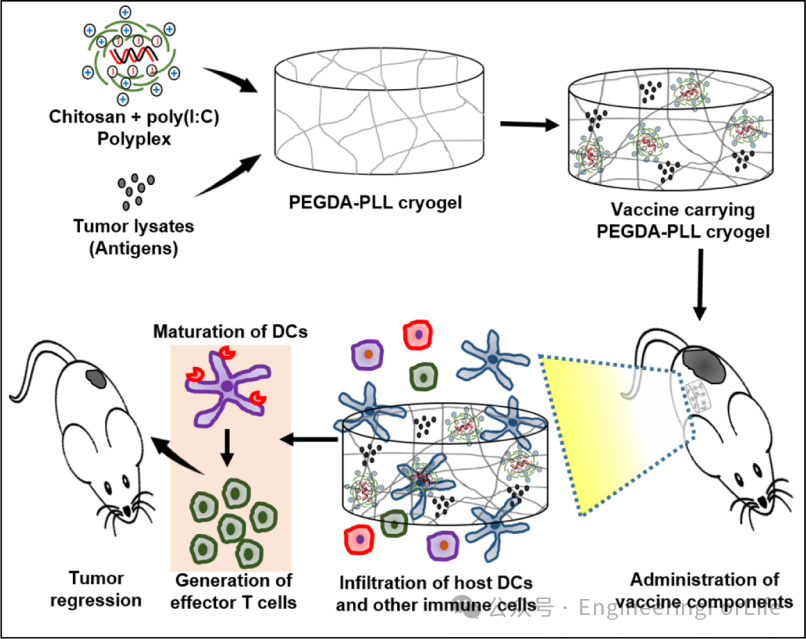
本文要点:
(1)壳聚糖复合佐剂——提升稳定性与靶向性:
研究采用壳聚糖包裹poly(I:C),形成带正电的纳米复合物(polyplex),有效抵抗核酸酶降解,并通过静电作用增强佐剂在DC内体的递送效率。实验表明,复合佐剂显著提高DC表面激活标志物CD86和迁移标志物CCR7的表达,促进T细胞活化,细胞毒性CD8+ T细胞比例提升2倍以上。
(2)宏孔支架设计——促进免疫细胞浸润与抗原滞留:
PEGDA-PLL支架通过低温凝胶化制备,孔径达54±19微米,支持宿主细胞高效浸润。表面修饰的聚赖氨酸通过静电作用延长肿瘤抗原的缓释时间(50%抗原保留超220小时),而裸支架80%抗原在数小时内释放。支架可通过18G针头注射植入,兼具可操作性与生物相容性。
(3)支架递送系统——增强原位免疫应答与肿瘤抑制:
动物实验显示,负载抗原和佐剂的支架植入黑色素瘤小鼠后,肿瘤体积较传统注射组减少60%,且加强剂量组效果更优。流式分析证实,支架组肿瘤中CD80+CCR7+ DC和CD8+CD44+ T细胞比例显著升高,血清IL-12和IFN-γ水平提升3倍,表明支架通过持续刺激DC-T细胞轴重塑抗肿瘤免疫微环境。
本研究通过材料工程与免疫调控的结合,开发了一种
高效、安全的原位癌症疫苗递送系统
。其创新性在于利用壳聚糖复合佐剂增强稳定性,宏孔支架优化免疫细胞互作,最终实现显著的肿瘤抑制效果。
未来
可进一步探索支架与其他免疫疗法
(如检查点抑制剂)的联用,或通过功能化修饰靶向特定免疫细胞亚群。此外,临床转化需评估支架在大型动物模型中的长期安全性和规模化制备工艺,为个性化癌症免疫治疗提供新策略。
参考资料
https://doi.org/10.1021/acsbiomaterials.4c02036
来源:
EngineeringForLife
声明:仅代表作者个人观点,用于研究用途,作者水平有限,如有不科学之处,请在下方留言指正!






