

百济神州PD-1单抗(BGB-A317)差异化开发策略

在当前的肿瘤治疗领域,以PD-1/PD-L1抗体为代表的肿瘤免疫疗法已经开启了免疫治疗的新时代,良好的临床效果也带来了丰厚的商业回报。2016年Opdivo和Keytruda的全球销售额分别达到了37.74和14.02亿美元,增速分别为278%和148%。PD-1/PD-L1为代表的免疫检查点抗体成为了抗体领域当之无愧的明星,诸多公司也蜂拥而至。目前国内至少已有恒瑞医药、信达生物、君实生物、百济神州和誉衡医药五家公司的PD-1抗体产品处于不同的临床研究阶段。为了在竞争中脱颖而出,各家公司也各显神通,挥舞着资本与技术,意图在临床和市场上一决高下。
本文将着重介绍百济神州的PD-1单抗-BGB-A317的研发历程和特点,希望能从中窥见BGB-A317的研发者为了能在这一领域胜出所采取的一些策略。
在BGB-A317开发过程中百济神州首先借助了恰当的合作伙伴的力量(勃林格殷格翰),弥补了自己抗体生产方面的短板。随后通过上市快速募集到资金用于产品的临床开发(不限于BGB-A317)。将经过临床1期验证的BGB-A317,迅速变为产蛋的金鸡。通过出售和置换部分权益,迅速回笼资金,充实自己的产品线,借助合作伙伴——新基的力量去开拓海外市场,保证公司的可持续的发展。
1.1
借助勃林格殷格翰生产高质量BGB-A317
2014年,百济神州公司与勃林格殷格翰公司达成战略合作协议,由勃林格殷格翰 BioXcellence™ 在中国为百济神州开发的生物制药产品提供面向全球市场的高品质产品供应以及相关服务。随后开始一直为 BGB-A317 的工艺开发和药品生产提供服务。
1.2 上市融资
2016年百济神州在纳达斯克证券交易所上市,共募集资金1.58亿美元,用于补足自己对资金的需求。通过融资,也使得百济神州有足够的资金支撑多个产品,包括BGB-A317的后续临床试验。
1.3 同新基公司战略合作
2017年7月,百济神州和新基公司宣布达成战略合作,共同开发和商业化BGB-A317,用于治疗实体肿瘤。百济神州仍然拥有BGB-A317用于治疗血液系统恶性肿瘤的开发和商业化全球授权,同时百济神州还将拥有在亚洲(日本除外)开发和商业化BGB-A317,用于治疗实体肿瘤的授权。作为回报,百济神州将拥有新基公司在中国获批产品的独家授权,包括ABRAXANE® 注射用紫杉醇(白蛋白结合型)、瑞复美® (来那度胺)和VIDAZA® 注射用阿扎胞苷。交易完成后,百济神州将获得约2.63亿美元的预付款以及1.5亿美金的股权投资,未来还可获得高达9.8亿美元的里程碑付款(包含研发、注册和销售)及新基销售BGB-A317的特许权费。这意味着如合作顺利完成,百济神州前后总共将获得13.93亿美元,超过恒瑞PD-1单克隆抗体SHR-1210的7.95亿美元售价,创下国内药企单品种收购的最高价格。
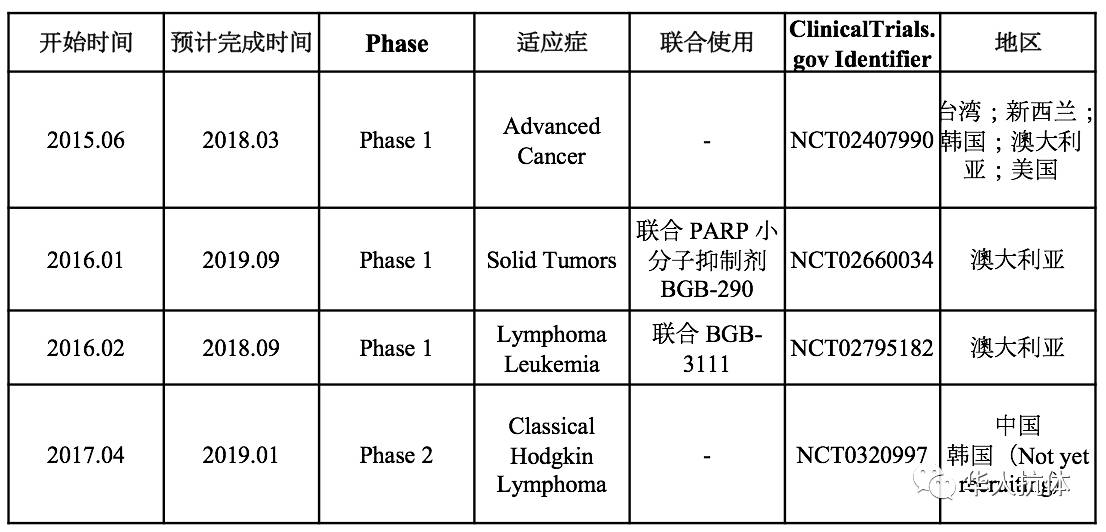
在BGB-A317开始临床试验之时,便着眼于全球布局。因此在临床试验中,BGB-A317将首选地定在澳大利亚,随后又在六个国家和地区展开了五项临床实验(表1)。当初选择在澳大利亚进行临床实验原因如下(在当时的情况下)[1]:1)绝大多数在澳大利亚进行的临床试验只需要伦理审查通过,并在该国药监部门(Therapeutic Goods Administration, TGA)备案就可以,等待时间短,这对于竞争激烈的PD-1/PD-L1研发领域而言非常重要。2)澳大利亚获取的临床数据可以获得FDA和EMA的承认,直接在欧美申请进一步临床实验。这就为未来的全球化布局提供了便利,其中在2017年能获得和新基的战略合作也跟这个战略分不开。3) 较于美国和欧盟国家,澳大利亚的临床试验费用和项目管理服务的费用更低。总结为三个字母,即RCF,众所周知,RCF对于离心机而言,就是相对离心力的意思,在此处却是指:Recognition(FDA和EMA等认可)、Cheap(相对便宜)和Fast(审批快速)[1]。正是因为利用澳大利亚临床试验的数据,才可以在国内临床试验中优化1期设计,加快进入后期临床。
表
1 BGB-A317
正在开展的临床试验
打铁还需自身硬,即使前期找到再多的战略伙伴,设计再精妙的临床试验策略,如果药物本身不具备优势,也很难在竞争中脱颖而出。为了使BGB-A317更具有竞争优势,百济神州的研发者在充分了解PD-1作用机理的基础上了做了进一步改造。同时通过结合表位的研究,做到使自己的产品不落入别人的表位专利范围之内(以实际专利分析为准)。



















