今日,国家药监局药品审评中心发布了《
关于公开征求“对我国《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》中关于多规格豁免BE药学评价标准“处方比例相似性”相关问题的问答”意见的通知
》
,如下:

原国家食品药品监督管理总局于2016年3月发布了《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》,规定多规格口服固体制剂可以基于其中某一规格的人体生物等效性试验结果,采用体外药学评价的方法豁免其他规格人体生物等效性研究,其中,豁免条件之一为“各规格制剂的处方比例相似”。
为更好地指导企业进行仿制药的开发,降低研发成本,提高研发效率,现对该指导原则中的“处方比例相似性”相关问题进行问答。
向各界征求意见,征求意见时效为1个月,相关意见可反馈至
[email protected]
。
国家药品监督管理局药品审评中心
2019年1月8日
对我国《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》中关于多规格豁免BE药学评价标准“处方比例相似性”相关问题的问答(征求意见稿)
原国家食品药品监督管理总局于2016年3月发布了《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》,该指导原则提出:对于多规格口服固体制剂(如,常释制剂:片剂和胶囊,调释制剂:肠溶片、缓释片剂、缓释胶囊等),可以基于其中某一规格(通常建议为最高规格)的人体生物等效性试验结果,采用体外药学评价的方法豁免其他规格人体生物等效性研究。药学评价方法包括:1)各规格制剂在不同pH介质中体外溶出曲线相似;2)各规格制剂的处方比例相似。其中处方比例相似是指以下两种情况:1)不同规格之间所有活性和非活性组分组成比例相似。2)对于高活性的药物(原料药在制剂中所占重量比例低):①不同规格的制剂重量一致(差异不超过10%);②各规格使用相同的非活性组分;③规格的变更系通过改变活性组分的用量以及一个或多个非活性组分的用量来实现。为更好的指导企业进行仿制药的开发,降低研发成本,提高研发效率,现对该指导原则中的“处方比例相似性”的相关问题进行解读。
1、“不同规格”、“各规格”的具体所指?
答:“不同规格”、“各规格”是指拟豁免规格与BE规格相比。
2、“组成比例相似”如何理解?
答:“组成比例相似”包括以下两种情况[3]:
①
不同规格之间所有活性和非活性组分组成比例完全相同
;
②
活性成分和非活性成分非等比例变化
,但是非活性成分相对于单剂量处方的比例的变化幅度在《已上市化学药品变更研究的技术指导原则(一)》辅料用量变更中的Ⅱ类变更允许的范围内[
3],此外,上述指导原则未包括的辅料的允许变化幅度为:
黏合剂±1%[4];延迟释放制剂和缓释制剂的各类非释药控制性辅料用量变化幅度同普通固体制剂[5],释药控制性辅料用量变化幅度一般为±10%,且是以释药控制性辅料总量为100%,计算释药控制性辅料比例变化幅度
[4]。
3、“高活性药物”如何判断?
“高活性药物”是活性成分的含量在制剂中相对较低的药物
,如,
活性成分的含量在片芯和胶囊内容物的占比<5%
[1,3]。
4、 不同规格之间非活性成分的变化幅度如何计算?
答:非活性组分是除活性成分外的其它成分[1,2],
当不同规格活性成分和非活性成分非等比例变化时,先计算不同规格的非活性成分相对于单剂量处方的比例,后计算不同规格间的差值[3,4,5]。当处方中非活性变化种类多于一种时,非活性成分的变化幅度应为各非活性成分变化量的绝对值之和
。
5、具体实例
1)例1:普通片剂1
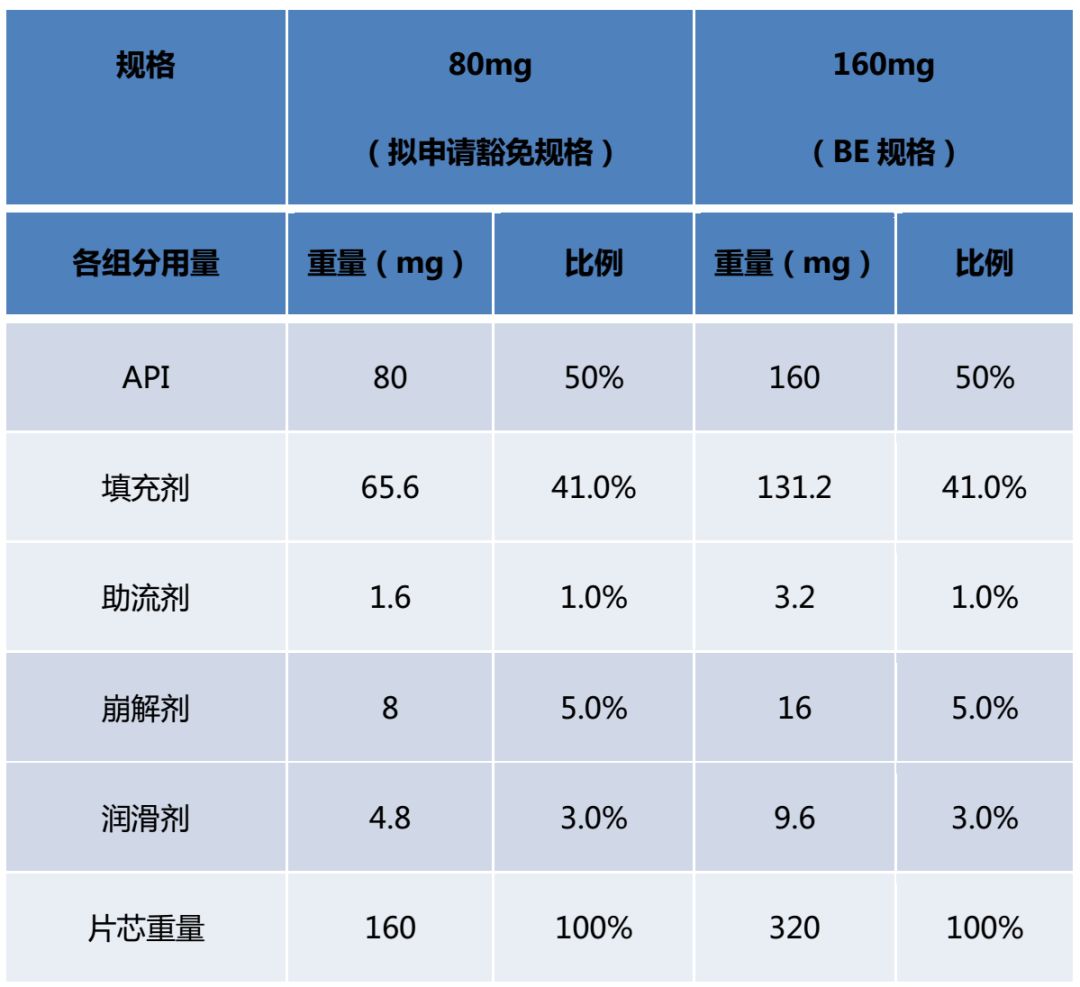
例1中160mg规格为BE规格。拟申请豁免的80mg规格与BE规格的所有活性和非活性组分组成比例完全相同,符合“组成比例相似”的第一种情形,结合BE规格制剂符合生物等效性要求,且各规格制剂在不同pH介质中体外溶出曲线相似的前提条件,可以豁免80mg规格的BE试验。
2)例2:普通片剂2
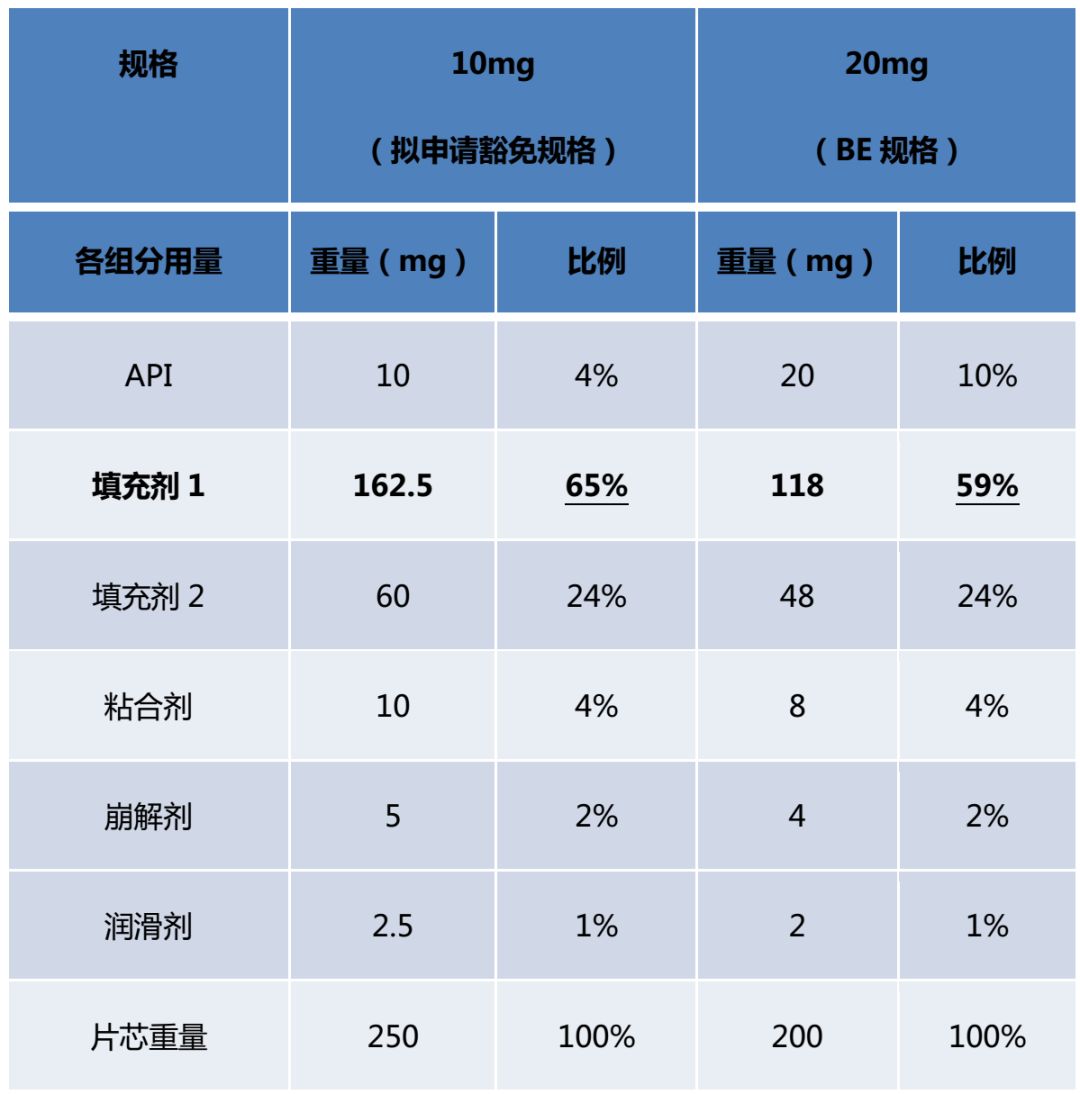
例2中20mg规格为BE规格。首先,拟申请豁免的10mg规格与BE规格相比,不是所有活性和非活性组分组成比例相同,故不属于“不同规格之间所有活性和非活性组分组成比例完全相同”的情形。其次,本品所有规格不属于“高活性药物”,且10mg规格与BE规格的处方中唯一比例不同的填充剂比例变化幅度为59%-65%=6%,小于《已上市化学药品变更研究的技术指导原则(一)》辅料用量变更中的Ⅱ类变更允许的范围(±10%)内,故10mg规格符合“组成比例相似”的第二种情形,可以豁免BE试验。
3)例3:
缓释制剂1

例3中200mg规格为BE规格。判断其他规格与BE规格的“组成比例相似性”时,首先发现其他规格与BE规格相比,不是所有活性和非活性组分组成比例相同,故不属于“不同规格之间所有活性和非活性组分组成比例完全相同”的情形。其次,150mg与BE规格的处方中唯一比例不同的填充剂(非释药控制性辅料)比例变化幅度为28.73%-25.23%=3.5%,小于《已上市化学药品变更研究的技术指导原则(一)》辅料用量变更中的Ⅱ类变更允许的范围(±10%)内,故150mg规格符合“组成比例相似”的第二种情形,可以豁免BE试验;而50mg与BE规格的处方中唯一比例不同的填充剂(非释药控制性辅料)比例变化幅度为44.89%-25.23%=19.66%,大于《已上市化学药品变更研究的技术指导原则(一)》辅料用量变更中的Ⅱ类变更允许的范围(±10%),故50mg规格不符合“组成比例相似”的第二种情形,且也不符合“高活性药物”的相关要求,不可以豁免BE试验。
4)例4缓释制剂2

例4中200mg规格为BE规格。判断其他规格与BE规格的“组成比例相似性”时,首先发现其他规格与BE规格相比,不是所有活性和非活性组分组成比例相同,故不属于“不同规格之间所有活性和非活性组分组成比例完全相同”的情形。其次,150mg与BE规格的处方中比例不同的非释药控制性辅料比例变化幅度为(24.9%-17.95%)+(1.45%-1.44%)=6.96%,小于《已上市化学药品变更研究的技术指导原则(一)》辅料用量变更中的Ⅱ类变更允许的范围(±10%)内,且释药控制性辅料的比例均无变化,故150mg规格符合“组成比例相似”的第二种情形,可以豁免BE试验;而400mg与BE规格的处方中比例不同的非释药控制性辅料的比例变化幅度为(17.95%-2.76%)+(1.45%-1.44%)=15.20%,大于《已上市化学药品变更研究的技术指导原则(一)》辅料用量变更中的Ⅱ类变更允许的范围(±10%),故400mg规格不符合“组成比例相似”的第二种情形,且也不符合“高活性药物”的相关要求,不可以豁免BE试验。
参考文献:
1、Guidance on the Investigation of Bioequivalence. European Medicines Agency. Janunary 2010.
2、§320.22 Criteria for waiver of evidence of in vivo bioavailability or bioequivalence.
3、Bioavailability Studies Submitted in NDAs or INDs — General Considerations Guidance for Industry(Draft Guidance). FDA February 2019.
4、SUPAC-IR: Immediate-Release Solid Oral Dosage Forms: Scale-Up and Post-Approval Changes: Chemistry, Manufacturing and Controls, In Vitro Dissolution Testing, and In Vivo Bioequivalence Documentation (I) 11/30/1995
5、SUPAC-MR: Modified Release Solid Oral Dosage Forms: Scale-Up and Postapproval Changes: Chemistry, Manufacturing, and Controls, In Vitro Dissolution Testing, and In Vivo Bioequivalence Documentation (I) 10/6/1997
6、Bioequivalence Studies with Pharmacokinetic Endpoints for Drugs Submitted Under an ANDA(Draft Guidance). FDA December 2013.
7、 Guidance for Industry:Bioavailability and Bioequivalence Studies Submitted in NDAs or INDs —General Considerations(Draft Guidance). FDA March 2014.














