根据咸达数据,本周(2017.10.16-10.22)正大天晴又一个1类新药承办,为本年度第5个申报临床的1类化药;赛诺菲降糖新药Sotagliflozin片首次在国内申报临床;丽珠制药PD-1单抗获批临床;奥赛康二进宫药品奥沙利铂脂质体注射液获批临床。此外,本周新增3个一致性评价的品种进入审评中心。
| 看点一
正大天晴和北京赛林泰医药联合申报又一个1类化药:
TQ05105及其片剂
,受理号CXHL1700213、CXHL1700214、CXHL1700215。截至本周,本年度正大天晴已经申报5个1类新药的临床,小编这里给大家列一下:
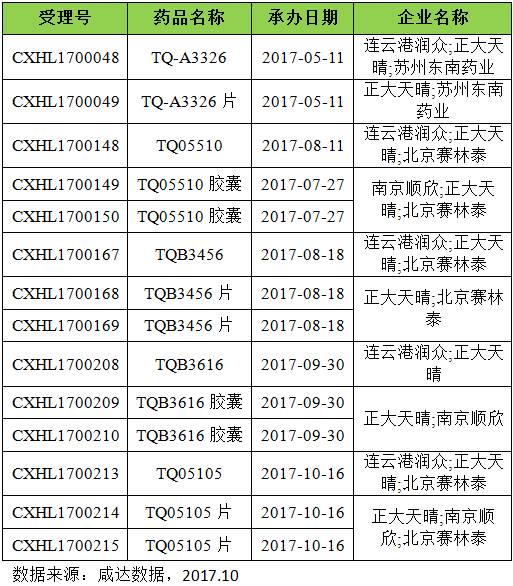
这些品种均排队待审评,遗憾的是,所有品种均不知道详细信息,坐等开做临床吧!
| 看点二
赛诺菲1类降糖新药
Sotagliflozin片
首次在国内申报临床,受理号JXHL1700194。
Sotagliflozin由美国莱斯康制药(Lexicon)开发,并于2015年11月授权于赛诺菲。本品是一种口服的双重SGLT1/SGLT2(1型和2型钠葡萄糖协同转运蛋白)抑制剂,SGLT1在胃肠道吸收葡萄糖过程中发挥作用,而SGLT2在肾脏重吸收葡萄糖过程中发挥作用,作用机制不依赖胰岛素。
本品尚未获批上市,一项名为inTandem2的3期临床显示:经sotagliflozin治疗24周后,与安慰剂相比,接受sotagliflozin(200mg)和sotagliflozin(400mg)治疗的患者平均降低A1C水平0.36%(p<0.001)和0.35%(p<0.001)。同时,在本研究中,sotagliflozin一般耐受性良好。如果该药最终获得审批,则是第一种用于辅助1型糖尿病患者胰岛素治疗的口服药。
| 看点三
丽珠单抗的
注射用重组人源化抗PD-1单克隆抗体
获批临床,本品2017年4月承办,非特殊审批药品,历经半年审评完毕。
目前国内在进行PD-1或PD-L1单抗临床试验的企业主要有恒瑞医药、信达生物、君实生物、百济神州、思路迪/康宁杰瑞、药明康德/誉衡药业、嘉和生物,获得临床批件未开展临床的包括基石药业/拓实药业、科伦药业、百奥泰生物、康方药业等。本次丽珠制药的PD-1单抗获批临床又可以为PD-1单抗的临床事业添砖加瓦啦。
| 看点四
江苏奥赛康的
奥沙利铂脂质体注射液
(5类)获批临床,本品2011年5月承办,历经6年多终于获批临床。本次申报属于二进宫,早在2010年10月奥赛康就对本品进行临床申请,不过2011年11月终止审批程序,脂质体目前在国内上市的品种依据不多(有盐酸多柔比星脂质体注射液、注射用紫杉醇脂质体以及注射用两性霉素B脂质体),奥赛康能坚持这么久也不容易啊,希望临床能成功进行。





