2017年6月2日,《国家食品药品监督管理总局药品医疗器械审评审批信息保密管理办法》(以下简称办法)发布,这是我国药品医疗器械审评审批制度改革中的一项重要措施,是关于“数据安全性”的一项重要法规,主要涉及法律法规、保密信息分类、具体保密政策和措施等方面。《办法》对完善我国药品医疗器械审评审批数据保护制度具有重要意义!
总局办公厅关于印发国家食品药品监督管理总局药品医疗器械审评审批信息保密管理办法的通知
食药监办法〔2017〕75号
总局机关各司局、各直属单位:
为维护药品、医疗器械注册申请人的合法权益,规范和加强药品、医疗器械审评审批信息保密管理,国家食品药品监督管理总局组织制定了《国家食品药品监督管理总局药品医疗器械审评审批信息保密管理办法》,现予印发,请遵照执行。
食品药品监管总局办公厅
2017年5月24日
国家食品药品监督管理总局药品医疗器械审评审批信息保密管理办法
第一条 为维护药品、医疗器械注册申请人的合法权益,规范和加强药品、医疗器械审评审批信息保密管理,根据《中华人民共和国药品管理法》《医疗器械监督管理条例》等法律法规,制定本办法。
我国药品医疗器械审评审批的各个环节都涉及到大量的数据和信息,数据和信息数据作为一种重要资源,往往涉及商业秘密,价值堪比石油。因此“保密管理”是这些部门、机构、人员的重要职责。只有做好这些,才能保持审评审批部门的权威和公信力和维护企业的合法权益。“保密管理”过程中明确了法律法规,做到了有法可依。
第二条 国家食品药品监督管理总局(以下简称食品药品监管总局)机关及直属事业单位从事药品、医疗器械注册受理、技术审评、现场检查、注册检验、行政审批(以下简称审评审批)的工作人员(含聘用人员)和参与审评审批的专家,对在审评审批工作中知悉的相关信息承担保密义务。
药品、医疗器械审评审批相关工作人员和参与审评审批的专家违反保密义务涉嫌犯罪的,依法移送司法机关处理;尚不构成犯罪的,按照相关规定和本办法处理。
审评审批过程中的所有人员(包括聘用人员)都必须知悉相关信息承担保密义务,如果违反规定,会视情节严重性予以处理。同时“机构”也同样负有保密责任。也就是说“机构”和“人员”都需要遵守保密政策与保密措施!
第三条 审评审批信息属于国家秘密的,按照《中华人民共和国保守国家秘密法》等法律法规和《国家食品药品监督管理总局保密工作管理办法》执行。
《办法》中涉及到了4项法律法规:《中华人民共和国药品管理法》《医疗器械监督管理条例》、《中华人民共和国保守国家秘密法》、《国家食品药品监督管理总局保密工作管理办法》。
第四条 审评审批过程中的下列信息属于本办法规定的保密信息:
(一)审评审批阶段申请人提交的信息和审评审批结束后的生产工艺、关键技术参数、技术诀窍、试验数据等信息,以及涉及个人隐私的信息;
(二)未获准对外披露的审评审批信息,包括按程序尚未签发的审评审批结论、按程序尚未公布的审评审批过程中的讨论意见、咨询意见及技术报告等;
(三)审评审批过程中投诉举报等信息。
食品药品监管总局药品、医疗器械审评机构结合工作实际,明确具体保密信息清单,报办公厅同意后公布。
本条列出了保密信息的分类,规定了哪些是保密信息。如(1)生产工艺、关键技术参数、技术诀窍、试验数据、个人隐私(如临床试验中的患者姓名、不良反应报告者的姓名以及个人社会保险号码、家庭住址和银行帐号等个人信息)等;(2)未获准对外披露的审评审批信息。当然对于不涉及保密的信息,是可以公开的,便于申请人或研发者查询使用,提供立题、研究方面的帮助,提高申报资料质量。(3)投诉举报信息。人们对于药品、医疗器械在研制、生产、流通、使用、审评审批等各个环节中的违法行为可以进行投诉举报,如通过12331,这些举报信息是保密的。
第五条 下列信息不属于本办法规定的保密信息:
(一)申请人提交的技术资料中属于专利事项或者中国药典等国家药品标准、医疗器械国家标准和行业标准中公开的事项;
(二)行业公知的信息;
(三)按照政府信息公开要求应当公开的信息;
(四)按照法定程序批准公开的信息。
本条列出了保密信息的分类,规定了哪些是非保密信息。如专利、国家标准、行业标准、行业公知信息、按规定和法定程序应当公开的信息等。在CDE网站信息公开中就包括了机构与办事规则、收审情况、上市药品信息、专家咨询会议、审评概述、审评结构、审评报告、进度查询、优先审评公式等公开信息。
第六条 从事审评审批的工作人员和参与审评审批的专家应当严格遵守保密规定,不得有下列行为:
(一)将保密信息载体擅自带离规定的工作场所或者擅自在指定网络、设备以外使用;
(二)擅自复制、拍摄、抄录、记录相关纸质资料和电子信息;
(三)将纸质资料、电子信息交给与该品种注册受理、技术审评、现场检查、注册检验、行政审批无关的人员以及其他与该品种监管无关的人员阅读或者使用,或者将相关信息透露给与该品种注册受理、技术审评、现场检查、注册检验、行政审批无关的人员以及其他与该品种监管无关的人员;
(四)涂改、伪造、替换、损毁、丢弃或者擅自销毁保密信息;
(五)利用相关资料或者信息从事与工作职责无关的活动。
规定了从事审评审批的人员和专家不应有的行为,内容很具体:如带离、复制、拍摄、抄录、泄露、涂改、替换、损毁、丢弃、非法获利等。
第七条 从事审评审批的工作人员和参与审评审批的专家未按法定程序批准,有下列情形之一的,视为泄露保密信息:
(一)披露申请人技术资料或者其他商业秘密的;
(二)使用申请人技术资料或者其他商业秘密用于非工作目的的;
(三)允许他人使用申请人技术资料或者其他商业秘密的;
(四)披露审评审批信息的。
对于泄露保密信息进行了规定,如披露或使用技术资料或商业秘密用于非工作目、披露审评审批信息等行为。
第八条 食品药品监管总局机关各司局、各直属事业单位负责保密信息日常管理,办公厅会同相关单位开展泄露保密信息案件的调查处理。
食品药品监管总局办公厅负责督促相关单位加强保密教育,落实保密制度,执行保密规定;每年组织涉密岗位工作人员进行保密知识测试。保密知识测试不合格的,应当按规定参加培训;培训后考核仍不合格的,调离相关工作岗位。
食品药品监管总局涉及审评审批的司局、直属事业单位负责本单位工作人员保密教育,制定保密制度并定期检查,发现泄密事件及时报告办公厅并提出处理意见。
本条中规定了“机构”应承担的保密管理工作内容。建立制度、对人员进行测试考核、教育、检查、处理等。
第九条 食品药品监管总局涉及审评审批的司局、直属事业单位应当采取有效措施加强保密信息载体管理,明确使用权限和使用程序。使用载有保密信息的档案,应当经本单位保密负责人书面同意,并记录使用时间、使用目的、使用人员等信息。
审评审批电子信息系统应当具有相应的安全防控措施,符合国家信息系统安全等级保护标准的要求,防止电子信息外泄。电子信息系统的管理部门和人员应当采取安全技术手段,保障信息系统登录和使用安全。
电子信息系统的管理部门和人员以及使用部门、使用人员应当对信息系统有关技术文件、图表、程序、数据以及相应设备上的密码、标识符和数据等承担保密义务。电子信息系统使用人员应当采取妥善措施,保管个人账号信息和登录密码,防止发生未经授权的访问。
任何部门和人员不得擅自更改、泄露与信息系统管理和运行有关的系统配置参数、所使用设备承载的各类信息。使用电子信息系统时,不得关闭追踪系统。
与审评审批无关的人员,不得接触审评审批保密信息;确因工作需要接触保密信息的,应当按程序经信息保管单位负责人和保密负责人书面同意,记录使用人、使用时间、使用目的,并按照相关法律法规和本办法规定承担保密义务。
CDE从2013年开始启动信息系统等级保护工作,在IT基础架构、数据传输安全、数据本地保护、数据远程容灾方面做了大量工作,保证数据安全。
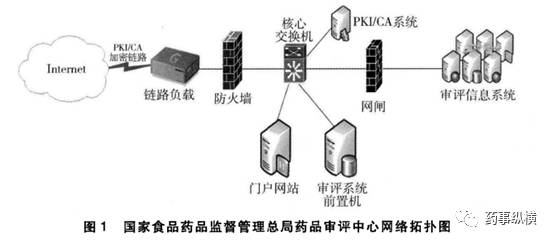
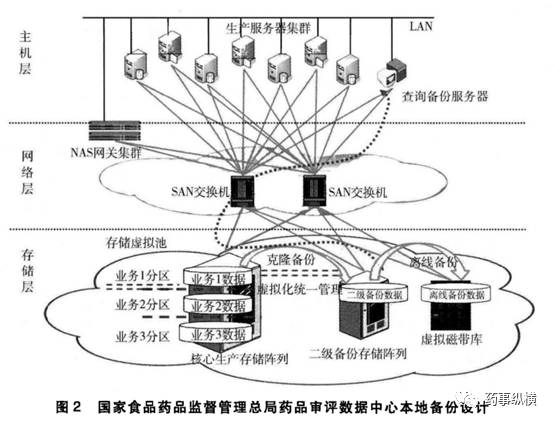
第十条 食品药品监管总局涉及审评审批的司局及直属事业单位工作人员入职时,应当接受保密教育,并与所在单位签署保密协议,承担保密责任。相关工作人员离开原工作岗位后,应当按照有关规定对相关信息承担保密责任。
保密协议由单位负责人与相关工作人员签署,其中司局及直属事业单位主要负责人保密协议由食品药品监管总局分管负责人与司局、直属事业单位主要负责人签署,食品药品监管总局分管负责人保密协议由食品药品监管总局主要负责人与分管负责人签署。
工作人员签署的保密协议由食品药品监管总局司局、直属事业单位综合部门保管,其中司局级干部签署的保密协议由食品药品监管总局办公厅保管。
参与审评审批的专家,应当与食品药品监管总局相关司局或者直属事业单位签署保密协议,承担保密责任。专家保密协议由食品药品监管总局相关司局或者直属事业单位保管。
食品药品监管总局保密协议样式由办公厅规定,有关司局和直属事业单位结合实际制定本单位保密协议的具体文本。
保密措施中对签署保密协议及其相关的管理措施进行了规定。
第十一条 有证据表明从事审评审批的工作人员违反本办法规定的,根据情节轻重,给予批评教育、调离工作岗位等处理或者警告、记过、记大过、降级、降低岗位等级、撤职、开除等处分:
(一)有本办法第六条第一项或者第二项行为,情节轻微的,给予批评教育;情节较重的,给予调离工作岗位处理或者警告、记过处分;屡教不改的,给予记过或者记大过处分;
(二)有本办法第六条第三项、第四项或者第五项行为,尚未造成后果的,给予记过或者记大过处分;造成后果的,给予降级、降低岗位等级、撤职或者开除处分;
(三)违反相关规定,擅自使用保密信息载体或者电子信息系统,或者关闭追踪系统的,给予记大过或者降低岗位等级处分;造成后果的,给予开除处分;
(四)有本办法第七条第一项、第二项或者第三项行为,故意泄露保密信息,涉嫌构成侵犯商业秘密罪的,移交司法机关依法追究刑事责任,并给予开除处分;
(五)有本办法第七条第四项行为,故意泄露保密信息,涉嫌构成滥用职权罪、玩忽职守罪或者泄露国家秘密罪的,移交司法机关依法追究刑事责任,并给予开除处分。
从事审评审批的工作人员受到记大过、降级、降低岗位等级或者撤职行政处分的,应当调离工作岗位。调离工作岗位的工作人员,经培训和考核合格后,方可从事原审评审批工作。
本条第一款所称泄露保密信息的证据包括能够证明相关工作人员违反本办法规定的书证、物证、视听资料、电子数据、证人证言以及其他证据。
第十二条 食品药品监管总局涉及审评审批的司局、直属事业单位发生泄露保密信息事件的,对单位予以通报批评,并依法对直接负责的主管人员、其他直接责任人员和保密负责人给予行政处分。
故意隐瞒泄密事件或者发现泄密事件不予处理的,依法对直接负责的主管人员、其他直接责任人员和保密负责人给予记大过、降级、撤职或者开除处分。
第十三条 食品药品监管总局涉及审评审批的司局、直属事业单位发生泄露保密信息事件,造成严重后果的,依法追究当事人所在单位直接责任人的管理责任。
第十四条 参与审评审批的专家违反本办法规定,泄露保密信息,涉嫌犯罪的,移交司法机关依法追究刑事责任。
有关专家泄露保密信息,给申请人或者食品药品监督管理部门造成损失的,申请人或者食品药品监督管理部门可以向人民法院提起诉讼,依法请求赔偿。
第十五条 申请人有证据证明相关单位或者工作人员、有关专家泄露保密信息给其造成损失的,有权向人民法院提起诉讼。
人民法院判决食品药品监督管理部门依法予以赔偿的,食品药品监督管理部门赔偿损失后,责令泄露保密信息的工作人员、专家承担部分或者全部赔偿费用。
第十六条 涉及审评审批工作人员泄露保密信息的投诉举报,以及泄露保密信息案件的立案调查,由食品药品监管总局办公厅会同相关单位依程序办理。调查终结后提出处理意见,认为应当移送司法机关的,提出移送建议,按程序报请食品药品监管总局决定。
第十七条 为审评审批提供信息存储、维护、转移、整理等服务的单位和人员以及其他可能接触审评审批信息的单位和人员,对其工作中知悉的应当保密的信息,按照相关法律法规和本办法规定承担保密义务;泄露保密信息的,按照本办法规定处理。
第11-17条中对各种违反本办法规定的行为,根据情节轻重,规定了相应的处分措施;对于申请人也给予相关权利。当发生上述问题时能够有法可依。
第十八条 各省、自治区、直辖市食品药品监督管理部门审评审批过程中的保密信息管理参照本办法执行。
第十九条 本办法自发布之日起实施。
作为WTO成员国之一,我国有义务对数据权人的数据进行保护!
2016年10月10日食品药品审核查验中心起草了《药品数据管理规范(征求意见稿)》,向社会公开征求意见;2016年07月25日《药品注册管理办法(修订稿)》第十七条中规定,食品药品监管部门、相关单位以及参与药品注册工作的人员,对申请人提交的技术秘密和数据负有保密义务;2017年05月12日国家食品药品监督管理总局商国务院有关部门组织起草了《关于鼓励药品医疗器械创新保护创新者权益的相关政策(征求意见稿)》(55号公告),向社会公开征求意见。上述征求意见稿,从不同角度体现了CFDA在数据保护制度完善方面做出的工作。
《国家食品药品监督管理总局药品医疗器械审评审批信息保密管理办法》具有如下意义:
1、落实相关工作人员保密责任。企业将试验数据经提交给管理部门后就意味着数据权人无法控制这些数据。如果监管不力或相关工作人员利用职务之便故意向第三方提供这些数据,那么将会对企业造成重大损失,因此企业往往不敢把真的资料送交审评,《办法》为提交真资料的企业打了一个强心针!
2、完善了数据保护制度。数据是企业的智力劳动成果,享有知识产权,从经济学角度来看,数据保护是企业的巨额研发投入能够获得利润的保障,如果不对数据进行保护,显然违反了公平竞争的市场经济秩序,因此数据保护作为知识产权保护的重要组成部分,必须对其采取适当的保护措施。目前我国药品和医疗器械行业的发展已经进入了一个非常关键的时期,企业对数据保护制度的建立具有强烈的需求,《办法》对数据保护制度的建立和完善起了铺垫作用。
3、药品审评报告中保密部分的依据。在审评部门公开的某个具体品种的审评报告中,一般会对生产工艺、关键技术参数、试验数据等进行保密,《办法》是药品审评报告起草的依据之一。
本文仅代表个人意见,如有异议欢迎探讨。
药事纵横——药品研发的信息窗,我们的网址是www.pharmaguider.cn, 点击原文链接可直达我们的首页,我们期待您的光临。

药事纵横是一个开放,由自愿者组成的团体,现有成员14名,分别为Voyager88,雷诺岛,三分话,Herman,Mzwinsunny,文竹,duke,巉巉之石,蓝色枫叶,ISAL,海角边,冯姝婷,yhqqqqq,陈小牛,欢迎有志之士加入我们团队。投稿、加专业微信群【合成、制剂、分析、注册、BD、一致性评价】请加微信442015666,QQ群:22711855/22711679(限加一个)

















