一旦激活,免疫细胞会改变代谢模式。而科学家们可以以此为靶点,开发新疗法。
为了治疗免疫疾病,研究人员正在开发让免疫细胞“饥饿”的药物。
大约 12 年前,安娜堡密歇根大学(University of Michigan)的免疫学家和化学生物学家 Gary Glick 和妻子发现儿子 Jeremy 似乎有些问题。Glick 指出,相比于他的双胞胎妹妹,Jeremy 似乎发育更迟缓些。虽然他们是一对双胞胎,一起成长,但 Jeremy 似乎停止了长高。当时 Jeremy 大概 9 岁或者 10 岁,看起来病态而苍白,并且胃部和其它器官开始出现持续疼痛的情况。
尽管 Glick 的妻子 Rachel Lipson Glick 是名医生,但她却无法诊断自己儿子的神秘疾病。其他医生也是如此。大约 3 年里,他们排除了各种癌症、内分泌功能障碍和其它潜在的原因,最终确定 Jeremy 患有克罗恩病(Crohn Disease)——一种由免疫细胞失调而引起的消化道炎症。
克罗恩病让 Jeremy 的生活日益艰难。现在他 22 岁,大学即将毕业。为了控制病情,Jeremy 需要定期注射抗体药阿达木单抗(Humira)。他的余生可能需要一直注射这种或其它具有相同效果的免疫抑制药物。
巧合的是,其中一种疗法可能源于他父亲的工作成果。越来越多的研究人员,包括 Gary Glick 都相信克罗恩病等免疫细胞驱动的疾病存在一个共同的、可以作为攻击靶点的特征:它们的新陈代谢与正常细胞不同。过去 20 年里,Glick 一直在寻找针对免疫细胞代谢适应的药物。Glick 创立的 Lycera 公司正在开展临床试验,以评估一种药物对牛皮癣和溃疡性结肠炎(一种与克罗恩病有关的肠道疾病)的治疗效果。
其他药企也在努力开发其它候选药物。研究人员也在考虑重用已有的、调节代谢的药物,如糖尿病药物二甲双胍和 2 - 脱氧葡萄糖(2DG)。约翰霍普金斯大学医学院(Johns Hopkins University's School of Medicine)免疫学家 Jonathan Powell 表示,这是一个非常激动人心的时刻,可能所有的免疫疾病都是代谢治疗的目标。
癌症研究人员试图破坏细胞代谢,甚至测试了一些免疫学家正在研究的药物。但许多科学家相信,代谢治疗对免疫疾病的效果可能比肿瘤好,因为免疫疾病中只需要抑制相对少量的过度增殖细胞,而不需要杀死它们。现有的抑制免疫细胞的药物,如阿达木单抗,可以危及我们身体抵御病原体的能力。Glick 和其他科学家则认为,代谢治疗不会存在这个问题。他强调,通过靶向过度活跃的免疫细胞的代谢,可以“直接瞄准这些细胞,同时不影响免疫功能”。

Gary Glick(左)发现了一种药物,可能对自身免疫性疾病有效,从而造福他的儿子 Jeremy(右)。
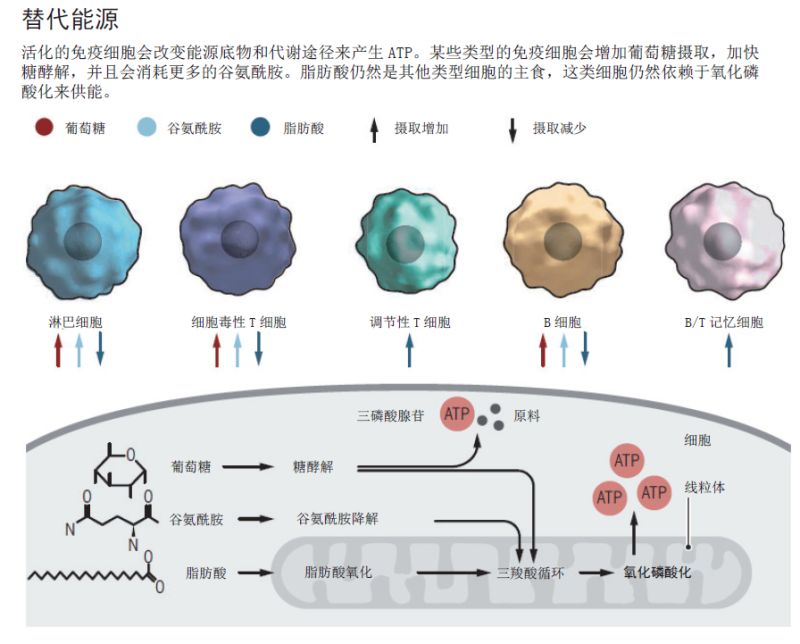
在 20 世纪 20 年代,德国医生和化学家 Otto Warburg 首次意识到,免疫细胞可以通过一种独特的方式来为自己提供能量。细胞活动需要能量,即需要产生能量分子三磷酸腺苷(ATP)。ATP 可以通过糖酵解(一种降解葡萄糖的生化途径)直接产生,或者通过一种更为复杂、在线粒体中发生的过程——氧化磷酸化——来产生 ATP。氧化磷酸化需要利用糖酵解或其它生化反应,如脂肪酸和谷氨酰胺等氨基酸降解产生的能量负荷分子作为原料。
正常的身体细胞通常依赖氧化磷酸化来满足其大部分能量需求,但是 Warburg 发现癌细胞的糖酵解速率大幅上升。他还注意到一些健康的细胞也依赖于糖酵解,这些细胞就是免疫细胞。
Warburg 的理论没有错,但研究人员现在知道,当免疫细胞不与病原体作斗争时,它们的新陈代谢就会比较慢,这时它们主要通过氧化磷酸化产生 ATP。当病原体出现,如流感病毒在肺部自我复制时,免疫细胞就会被激活,产生免疫响应。德国马克斯普朗克免疫生物学和表观遗传学研究所(Max Planck Institute of Immunobiology and Epigenetics)的免疫学家 Erika Pearce 指出,此时,免疫细胞会经历巨大的代谢变化。受刺激的细胞不仅需要更多的能量。被激活的 T 细胞每天可多次分裂,从而迅速产生数以百万计的后代。为了维持这种增殖能力,T 细胞还需要大量的原材料,例如 DNA、蛋白质和脂质的前体。
被激活的免疫细胞如何满足自身对能量和分子原料的巨大需求取决于具体的细胞类型。激活的辅助 T 细胞,作为免疫指挥官,似乎遵循 Warburg 的范式。它们摄取葡萄糖,并加速糖酵解,尽管它们也提高了氧化磷酸化的速度,并且消耗了更多的谷氨酰胺。负责杀死肿瘤细胞和病毒感染细胞的细胞毒性 T 细胞(Cytotoxic T cell)也采取类似的能量策略。相反,免疫抑制调节性 T 细胞继续从氧化磷酸化过程中获得大部分能量,即使在激活状态下,相比于氨基酸和葡萄糖,它们更喜欢脂肪酸。
事实上,记忆性免疫细胞和非记忆性免疫细胞的代谢模式又不一样。记忆性免疫细胞可以记忆数年之前入侵过身体的病原体,并在同一病原体再次入侵时,迅速引发免疫响应。非记忆性免疫细胞是短寿命的效应细胞,特化攻击某类微生物。两年前,Pearce 等人发表论文指出,记忆 T 细胞通常依赖于氧化磷酸化来提供能量,并消耗脂肪酸。相比之下,效应 T 细胞则依赖于糖酵解,并且主要依靠葡萄糖来供能——这些差异主要体现在它们的线粒体,也就是细胞内氧化磷酸化发生的场所。
Pearce 指出,尽管记忆 T 细胞“具有这些美丽、完整、线状的线粒体”,但是效应 T 细胞的线粒体则是分裂形态的。研究人员认为,线粒体是发生氧化磷酸化的细胞器,分解线粒体可能会使氧化磷酸化途径效率降低,并促进糖酵解。
代谢适应使免疫细胞能够发挥免疫保护作用,但有时也会使细胞出现功能障碍。例如,加州斯坦福大学(Stanford University)的免疫学家 Cornelia Weyand 指出,在类风湿性关节炎中,活化的 T 细胞会滑入关节。T 细胞会滞留在关节里,引发慢性组织炎症。
这种细胞行为反映了细胞代谢的变化。像其它活化的 T 细胞一样,引起类风湿性关节炎的 T 细胞依赖于糖酵解来供能。但它们降低了糖酵解速率,减少了 ATP 产生,增加了分子前体的产生,以支持细胞的快速分裂。结果,T 细胞缺乏活性氧——调控细胞行为的关键信号分子,并开始失调。它们加快分裂,并主要分化成促进炎症的细胞类型。
这些细胞也成为了更好的“体操运动员”,擅长于通过狭窄的空间滑入关节。Weyand 等人发现,异常 T 细胞的细胞膜会发生褶皱,使其能够进入组织深处。Weyand 指出,在关节内,这些 T 细胞会刺激其它细胞形成类似于不愈合伤口的损伤,并引起疼痛和进一步的关节退化。细胞的新陈代谢控制着它的行为,而这些行为会伤害病人的身体。
Pearce 指出,一些同事对于免疫细胞代谢干预策略心存怀疑,他们担心这会削弱人体的整个防御系统或伤害其它的重要细胞。这些同事问 Pearce,如果给病人服用糖酵解抑制剂,会不会产生致命的副作用?但纳什维尔范德比尔特大学医学中心(Vanderbilt University Medical Center)的免疫学家 Jeff Rathmell 表示,只有一小部分免疫细胞提高了糖酵解速率,并会受到代谢调节药物的影响,而大多数细胞则不受影响。
动物研究表明,针对免疫代谢是一种有前途的方法。在 2015 年的一项研究中,佛罗里达大学(University of Florida)的免疫学家 Laurence Morel 等人给小鼠进行了基因修饰,以使其发生通常使用脱氧葡萄糖和二甲双胍治疗的狼疮病。二甲双胍抑制氧化磷酸化,而脱氧葡萄糖抑制糖酵解。这些分子一起逆转了动物中的狼疮症状。例如,狼疮患者会产生攻击自身 DNA 的抗体。但在小鼠中,治疗开始后,这些抗体的水平下降约 50%。并且研究人员没有发现小鼠免疫能力降低的迹象。
在另一项研究中,Rathmell 等人将抑制糖酵解的二氯乙酸酯添加到模拟多发性硬化症(一种因免疫系统攻击神经的绝缘髓鞘引发的疾病)的小鼠的饮用水中。他们在 2014 年发表的论文指出,二氯乙酸酯可防止动物髓鞘破坏,减少肌肉无力等神经症状。
Powell 等人发现,阻碍细胞新陈代谢也可以抑制免疫系统对移植器官的攻击。他们给接受了皮肤或心脏移植的小鼠服用给二甲双胍、脱氧葡萄糖和一种阻断谷氨酰胺代谢的药物。治疗组小鼠的皮肤移植物存活时间比对照组长约 4 倍,事实上对照组很快会发生免疫排斥。该团队在 2015 年发表的《细胞通讯》(Cell Reports)文章中指出,移植的心脏在治疗组小鼠身上也可以工作更长的时间。
目前有几个临床试验正在测试一些已通过批准的、最常用的代谢调节药物,如二甲双胍对免疫类疾病患者的治疗效果。两年前,阿根廷研究人员的论文指出,30 例多发性硬化患者服用二甲双胍或另一种抑制氧化磷酸化的药物后,新发的脑损伤显著减少。中国研究人员的一项临床试验正在测试二甲双胍是否能治疗红斑狼疮。到目前为止,这些药物似乎是安全的。Rathmell 表示,二甲双胍本身对减少免疫力的作用很小,但可以减少慢性炎症。
怀疑论者指出,一些研究试图用二甲双胍和脱氧葡萄糖来阻断癌细胞的代谢,但得到的结果并不一致。不过,Powell 等人并不为此担心。他表示,与癌细胞不同,你实际上不需要杀死免疫细胞来改变其代谢。
德克萨斯大学西南医学中心(University of Texas Southwestern Medical Center)的癌症生物学家 Ralph DeBerardinis 补充,这些药物最初并不是用于调节免疫细胞的新陈代谢。鉴于此,如果它们无效,或特异性不够,他们也不会感到惊讶。













