表型鉴定在植物基因功能研究中具有至关重要的地位,能够帮助了解目的基因的功能及其在植物生长发育和环境适应中的作用。表型是基因表达和功能的直接体现,通过对植物的表型进行观察和分析,我们可以推断出目的基因的功能,进而深入研究其在植物生物学和农业生产中的应用潜力。
当我们获得转基因植株时,首要任务就是对表型进行鉴定。对于一些可能涉及到植物形态特征的基因,我们可以通过观察叶片形态、花色花香、植株大小等方面直观地评估植物的表型,此外,还可以通过观察一些微观结构,如细胞结构、细胞壁厚度和气孔密度等,以推断目的基因的功能。而对于一些可能参与植物应对生物或非生物胁迫防御相关的基因,我们需要给予适当的胁迫处理,然后观察植物的表型特征,并对处理前后的微观结构进行测定,以便进一步评估目的基因的功能。表型鉴定的结果对于深入了解基因的功能,并在植物遗传改良和生物技术应用中具有重要意义,这些结果有助于开发出更优良的植物品种,设计更有效的生产策略,从而为植物生产提供更大的改进空间。
被子植物的植物体一般由根、茎、叶、花、果实和种子等器官组成。植物形态特征的建成是这些器官发育后共同呈现的结果,形态结构的特征往往与形态性状、生殖性状和品质性状等息息相关。在本篇推文中,伯小远将给大家介绍植物形态特征表型鉴定中的相关指标。
植物的根大部分埋藏在地下,是植物至关重要的营养器官。根据根的发生时间和位置的不同,可以将其分为定根和不定根
。
定根是指发生于特定位置的主根和侧根,当种子萌发时,胚根突破种皮,向下生长所形成的根,称为主根。当主根生长到一定程度时,其侧边会形成许多分枝,称为侧根。此外,植物还能从茎、叶和胚轴上产生根,由于产生位置的不确定,因此这类根统称为不定根。根的主要生理功能是固定植株,保持其稳定性,并且通过吸收土壤中的水分和营养物质来满足植物的生长和发育需求。此外,根还能与土壤中的微生物形成共生关系,有助于改善土壤结构并促进植物的生长。
目前,对于根的研究主要集中在根系发育、离子转运以及根瘤固氮等方面。
对于根系的表型鉴定,通常依赖于对植物根系复杂的三维结构进行观察,这些结构包括主根、侧根和须根等。在观察的过程中,需要对主根和侧根等不同结构的长度和数量,以及根系总长度、表面积和体积等指标进行统计和分析。通过这些数据,可以评估目的基因对根系生长的影响。2023年5月,中国农业大学眭晓蕾课题组在
New Phytologist
杂志上发表了一篇题为“Disruption of the amino acid transporter CsAAP2 inhibits auxin-mediated root development in cucumber”的研究论文。作者通过生物信息学分析在黄瓜基因组中共鉴定出86个氨基酸转运蛋白,随后通过RT-qPCR实验对氨基酸转运蛋白家族的AAP亚家族进行组织表达分析,并从中挑选出一个在根中特异性表达的
CsAAP2
基因用于后续的研究。为了研究
CsAAP2
基因的功能,作者利用CRISPR/Cas9基因编辑技术获得了3个独立的突变体株系,并选择
aap2-1
#
和
aap2-2
#
株系用于后续的研究。与野生型相比,
aap2-1
#
和
aap2-2
#
株系在萌发6天和10天时均出现根长缩短和侧根数量减少等表型。此外,在萌发25天时,突变体株系总根长相比于野生型显著减少,地上和地下部分的生物量也显著降低。为了进一步分析
CsAAP2
基因对黄瓜植株生长的影响,通过共聚焦显微镜对根系结构进行观察发现,与野生型相比突变体株系主根分生组织的细胞分裂出现延迟,特别是静止中心细胞(QC)、外皮层/内皮层初始细胞(CEIs)和胶质干细胞。此外,突变体株系侧根根尖分生组织相比于野生型也呈现出细胞分裂延迟的表型。上述结果表明,
CsAAP2
可能参与了黄瓜的发育,特别是根的发育。
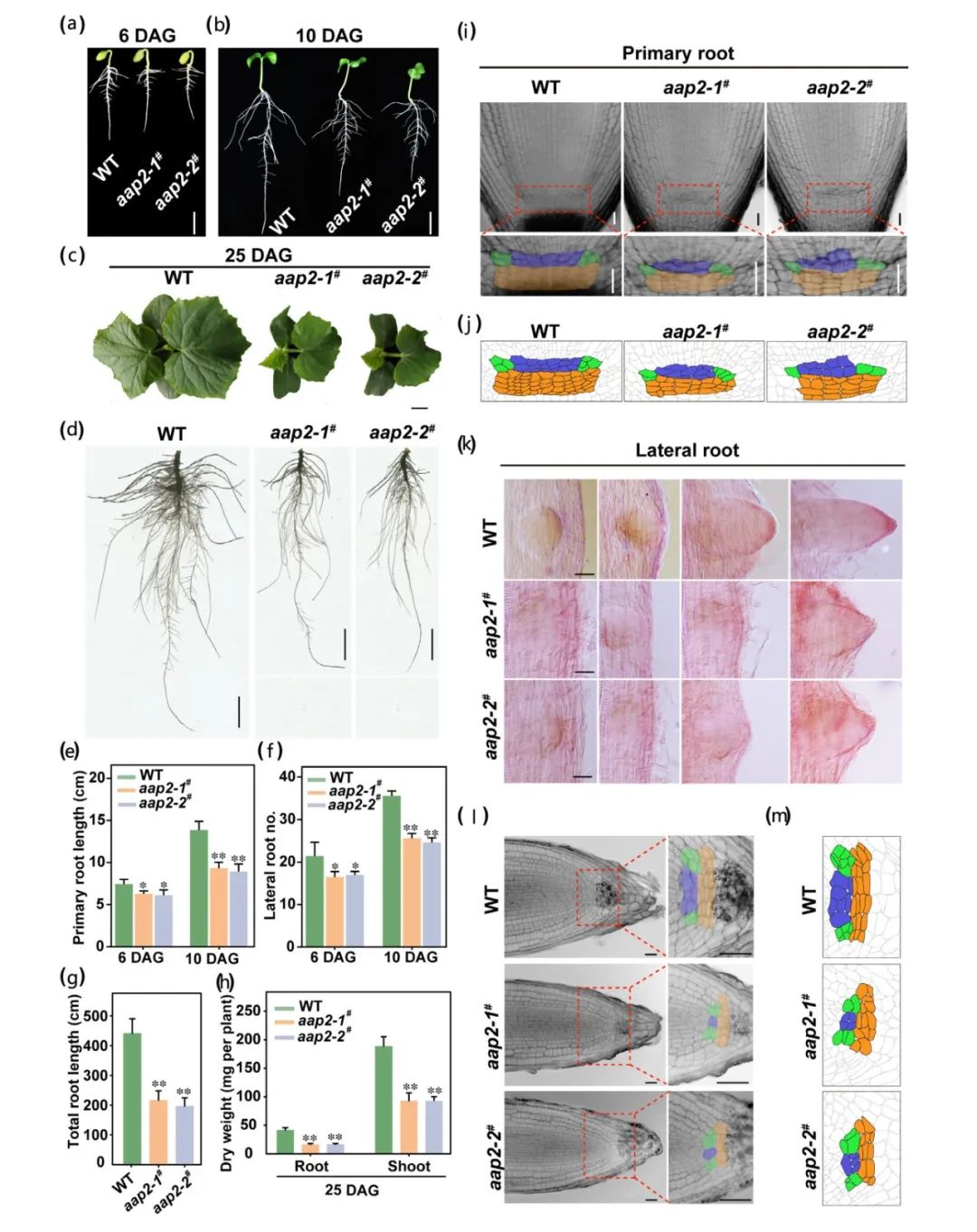
图1 黄瓜
aap2
突变株系表型分析(Yao et al., 2023)。(a-h)黄瓜幼苗形态及生长指数分析;(a-d)在发芽后6、10和25天后(Day after germination,DAG)对水培条件下植物进行观察,突变株系(
aap
2
-1
#
和
aap
2
-2
#
)和野生型(WT)植物幼苗的形态特征,比例尺:2cm
;
(e-h)在6、10和25DAG阶段对生长在营养液中的植物进行根系生长分析。在6和10DAG阶段测量主根长度和侧根数,以及25DAG时的总根长和幼苗干重;(i-m)在水培条件下,10DAG的突变株系和野生植物的根尖分析;(i)通过mPS-PI染色分析主根的分生区表型,下面的每张图片都是红框区域的放大图片,蓝色细胞代表静止中心细胞(QC),绿色和橙色区域分别代表外皮层/内皮层初始细胞(CEIs)和胶质干细胞,
比例尺:25μm;(j)是(i)的示意图;(k)成熟根区侧根原基形成率比较,用Schiff试剂将细胞染成粉红色,通过微分干涉对比显微镜(DICM)获得图像,比例尺:100μm;(l)通过mPS-PI染色分析侧根的分生区表型;(m)是(l)的侧根尖分化示意图模型。
植物的茎一般生长于地上或部分生于地下,起着连接根和叶的作用,是植物重要的支撑结构。除了支撑功能外,茎还承担着运输水分、营养物质和光合产物的重要功能。茎具有节点和节间之分,节点上通常着生叶片,这是根和茎的主要的区别之一。茎形态多样,包括直立茎、缠绕茎和匍匐茎等,这些形态是茎在长期进化的过程中所形成的。
目前,对于茎的研究主要集中在茎秆发育和茎秆抗病性等方面。
茎秆的表型鉴定通常侧重于对茎部结构的观察,包括茎高、茎节间距、茎形态(如形状和颜色等)以及茎秆硬度和分支情况等。通过对这些指标的测定和分析,可以全面评估茎部的生长状态和发育水平,进而推断目的基因对根系生长的影响。
2022年10月,扬州大学陶俊课题组在
Plant Physiology
杂志
上发表了一篇题为“The herbaceous peony transcription factor WRKY41a promotes secondary cell wall thickening to enhance stem strength”的研究论文。作者根据转录组的结果从芍药WRKY家族挑选出可能正向调控芍药茎强度的
PlWRKY41a
基因,并将其构建到TRV载体上,通过VIGS实验成功获得
PlWRKY41a
基因沉默的芍药植株。结果发现,与野生型和TRV空载对照相比,
P
l
WRKY41
a
-TRV沉默株系的茎秆强度、株高、茎粗和木质素含量均有所降低。此外,还通过显微镜对茎秆结构进行观察,结果发现
P
l
WRKY41
a
-TRV沉默株系的厚壁组织细胞壁厚度明显变薄。综上所述,
PlWRKY41a
基因正向调控茎秆强度。
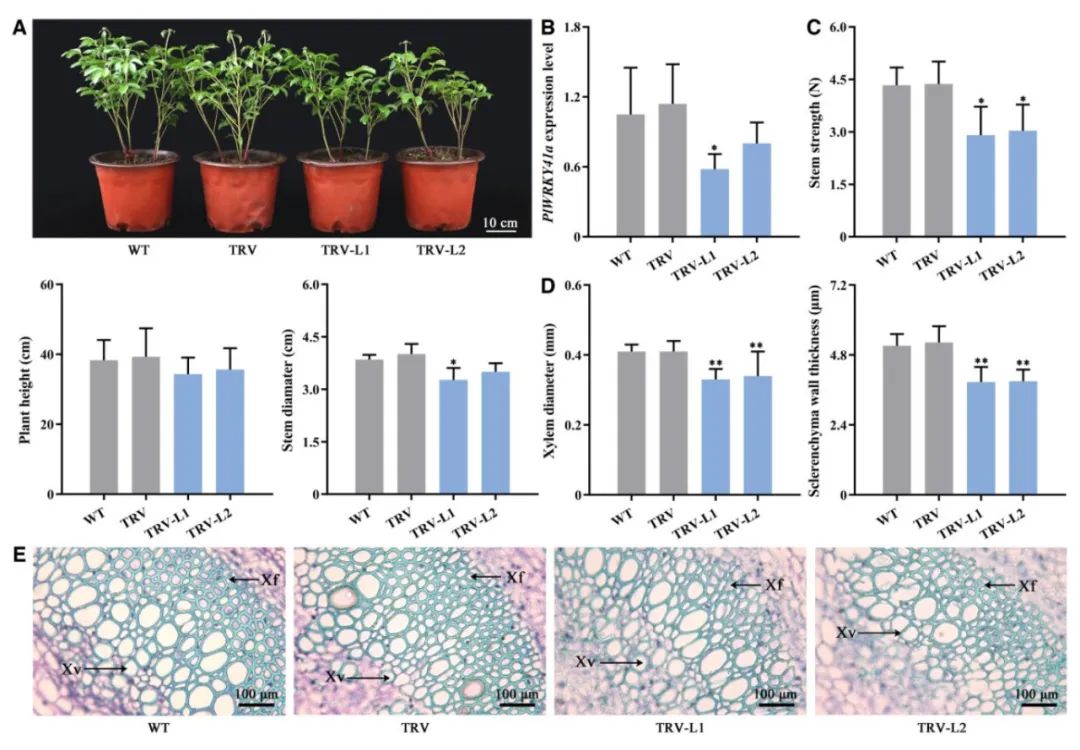
图2 TRV介导芍药
PlWRKY41a
基因沉默后表型鉴定(Tang et al., 2022)。(A)WT、TRV空载和沉默株系的表型;(B)
PlWRKY41a
的相对表达水平;(C)株高、茎粗和茎强等植物形态指标;(D)木质部直径和茎壁厚度的茎微观结构;(E)0.05%甲苯胺蓝溶液染色后用光学显微镜观察茎微结构。厚壁组织细胞,包括木质部导管和木质部纤维。Xv,木质部导管;Xf,木质部纤维。
此外,一些物种在长期演变的过程中由于环境的改变而形成变态的茎,如仙人掌的肉质茎、葡萄的茎卷须和马铃薯的块茎等。对于这类变态茎的表型鉴定,通常需要对茎的形态(包括茎的形状、颜色和质地)、结构以及大小和重量等指标进行测定。2023年12月,云南大学黄斌全课题组在
New Phytologist
杂志上发表了一篇题为“The tuber-specific
StbHLH93
gene regulates proplastid-to-amyloplast development during stolon swelling in potato”的研究论文。作者根据转录组分析的结果从马铃薯中找到一个块茎特异性表达的
StbHLH93
基因,并成功获得敲除(
StbHLH93
-KD)株系和过表达(
StbHLH93
-OX)株系。表型观察的结果显示敲除株系和过表达株系在块茎的数量和大小存在显著性差异,在株高和叶片形态上无明显差异。与野生型相比,敲除株系块茎数量和大小明显下降,表现为大果(≥15g)数量降低从而导致产量下降。
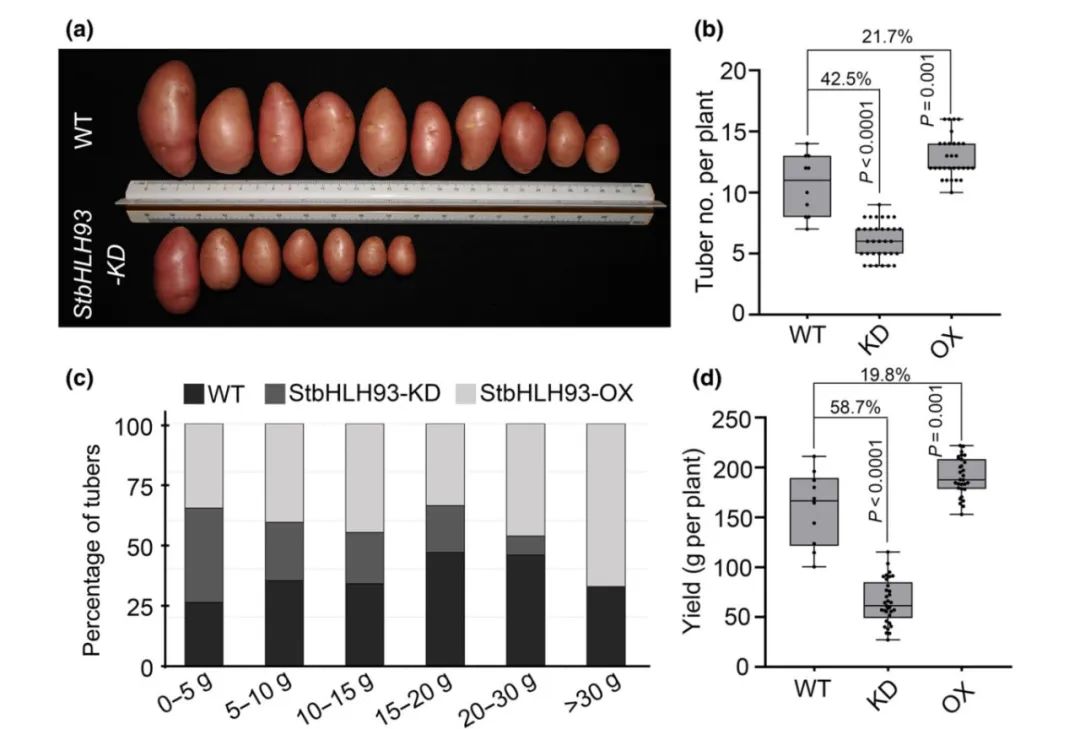
图3 马铃薯
StbHLH93
-KD和
StbHLH93
-OX转基因株系的表型(Yang et al., 2023)。(a)
StbHLH93
-KD转基因株系和野生型(WT)的块茎表型;(b)WT、
StbHLH93
-KD和
StbHLH93
-OX株系之间单株块茎数的比较;(c)WT、
StbHLH93
-KD和
StbHLH93
-OX株系块茎重量分布;(d)WT、
StbHLH93
-KD和
StbHLH93
-OX株系之间单株块茎产量的比较。
叶是植物中由芽的叶原基发育而成的重要器官,承担着光合作用和蒸腾作用等关键功能。叶一般由叶片、叶柄和托叶三部分组成,如果三个部分都齐全则称为完全叶,而缺少其中一个或两个部分的则称为不完全叶。
植物叶片的形状主要
由两个关键因素决定:长宽比和最宽处的位置。长宽比影响叶片的整体形态和延展性,而最宽处的位置则决定了叶片的轮廓和外形。
叶片的表型鉴定通常侧重于对叶片的结构和外观特征进行观察。这包括叶片的形状、大小、颜色以及叶缘的状态等。同时,也会关注叶片表面的光泽度、叶片的质地和厚度等特征。通过对这些指标的测定和分析,
可以判断目的基因对叶片形态的影响。2024年2月,广西大学张积森课题组在
The Crop Journal
杂志
上发表了一篇题为“A growth-regulating factor 7 (
GRF7
)-mediated gene regulatory network promotes leaf growth and expansion in sugarcane”的研究论文。作者对两个不同品种的甘蔗进行转录组分析,并从中挑选出一个在不同阶段均表达且在两个品种间存在显著性差异的
GRF7
基因。此外,组织表达分析的结果显示
GRF7
在嫩叶中表达最高,推测
GRF7
基因可能在甘蔗叶片发育中起着重要的作用。为了解析
GRF7
基因的在甘蔗叶片形成过程中的作用,作者在水稻中异源转化
GRF7
基因并成功获得过表达转基因水稻株系。与野生型相比,过表达(
SsGRF7
-OE)株系叶片长度和面积均有所增加。随后,通过扫描电子显微镜观察野生型和过表达株系的叶表皮细胞,结果发现,过表达株系叶表皮细胞相比于野生型增加了6.4%。上述结果表明,
SsGRF7
通过影响叶表皮细胞大小来影响甘蔗叶片形态。
图4 转基因水稻叶片和表皮细胞表型(wang et al., 2024)。(A)
SsGRF7
过表达(OE)品系和野生型(WT)水稻孕穗期表型 。比例尺:30cm;(B)
SsGRF7
-OE和WT的旗叶。标记的白色虚线框是用于叶表皮细胞观察的叶段示意图;(C)
SsGRF7
-OE和WT旗叶中表皮细胞观察。比例尺:100μm;
SsGRF7
-OE和WT旗叶的叶面积(D)、叶长(E)、表皮细胞面积(F)的比较。
除了叶片形态特征的研究外,对于叶片衰老的研究同样十分常见。叶片衰老是叶片发育的最后阶段,它受环境和内源激素等信号的调节,如高温、干旱、脱落酸和水杨酸等。叶片衰老时,叶片会发生一系列的改变,如代谢活动降低,叶肉细胞间隙变大,叶绿素分解和光合效率下降等。因此,除了对衰老叶片的形态特征进行鉴定外,还需要对叶绿素含量、叶片相对水分含量和最大光系统II效率等指标进行测量和分析。2022年6月,中国农业大学郭仰东/张娜课题组在
Journal of Experimental Botany
杂志发表了一篇题为“The transcription factor SlWRKY37 positively regulates jasmonic acid- and dark-induced leaf senescence in tomato”的研究论文。作者通过对茉莉酸甲酯 (MeJA
)
处理后的番茄叶片进行转录组分析,并从中挖掘到一个与茉莉酸(JA)信号相关的
WRKY
基因
SlWRKY37
,组织表达分析的结果显示
SlWRKY37
在叶片中表达最高。
为了进一步研究
SlWRKY37
的功能,作者在番茄中成功获得敲除(
SlWRKY37
-CR)株系和过表达(
SlWRKY37
-OE)株系。与野生型相比,MeJA处理后过表达株系叶片提前衰老;敲除株系则表现出延迟的叶片衰老表型。随后,进一步对不同株系材料的叶绿素含量、最大光系统II效率(Fv/Fm比值)、电导率和细胞死亡率进行分析,结果发现在MeJA处理后过表达株系叶绿素含量和Fv/Fm比值显著低于野生型和敲除株系,电导率和细胞死亡率显著高于野生型和敲除株系。综上所述,
SlWRKY37
依赖于MeJA信号促进叶片衰老。
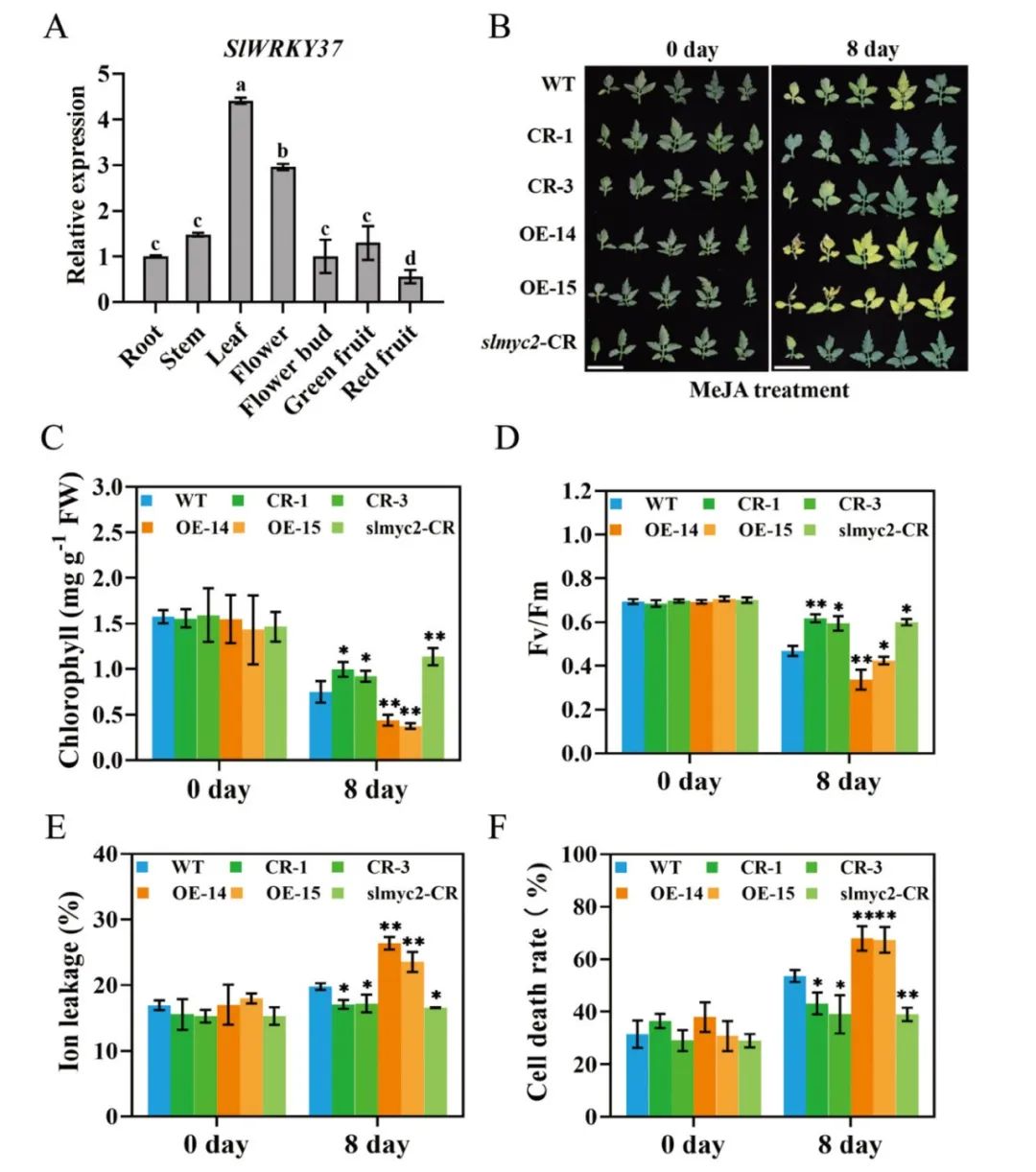
图5
SlWRKY37
正向调控MeJA介导的番茄叶片衰老(Wang et al., 2022)。(A)
SlWRKY37
组织表达分析;(B)MeJA(200μM)介导的6周龄野生型、敲除株系和过表达株系的叶片衰老;(C)200μM MeJA处理0d和8d时,6周龄野生型和转基因株系第四片真叶的叶绿素含量和(D)Fv/Fm;(E)MeJA处理后0d和8d时,6周龄野生型、敲除株系和过表达株系第五片真叶的电导率和(F)细胞死亡率。
花的形成标志着植物由营养生长转为生殖生长。被子植物的花发育包括三个连续的阶段:成花诱导、花原基形成和花器官发育,这些过程受到许多基因的调控
。Coen等人通过对拟南芥和金鱼草的突变体表型的研究,提出花发育的ABC模型
(Coen et al., 1991)
。在这个模型中,花的四轮结构是由3类基因共同决定的,其中萼片的发育由A类基因决定,花瓣的发育由A和B类基因共同决定,
雄蕊的发育由B和C类基因共同决定,雌蕊的发育由C类基因决定(Weigel et al., 1994)。随后,经过不断的补充和完善,在ABC模型的基础上提出了ABCDE模型,其中D类基因控制胚珠的发育,而E类基因则是对各个花器官均有调控作用(Thomson et al., 2019)。
在大多数植物中,花不仅是生殖器官,还是观赏器官。花的观赏性受多种因素的共同调控,如花色、花香和花器官形态等。在此,我们主要介绍花器官形态建成的基本原理。如果大家对花色和花香感兴趣的话,下次我们再单独介绍。
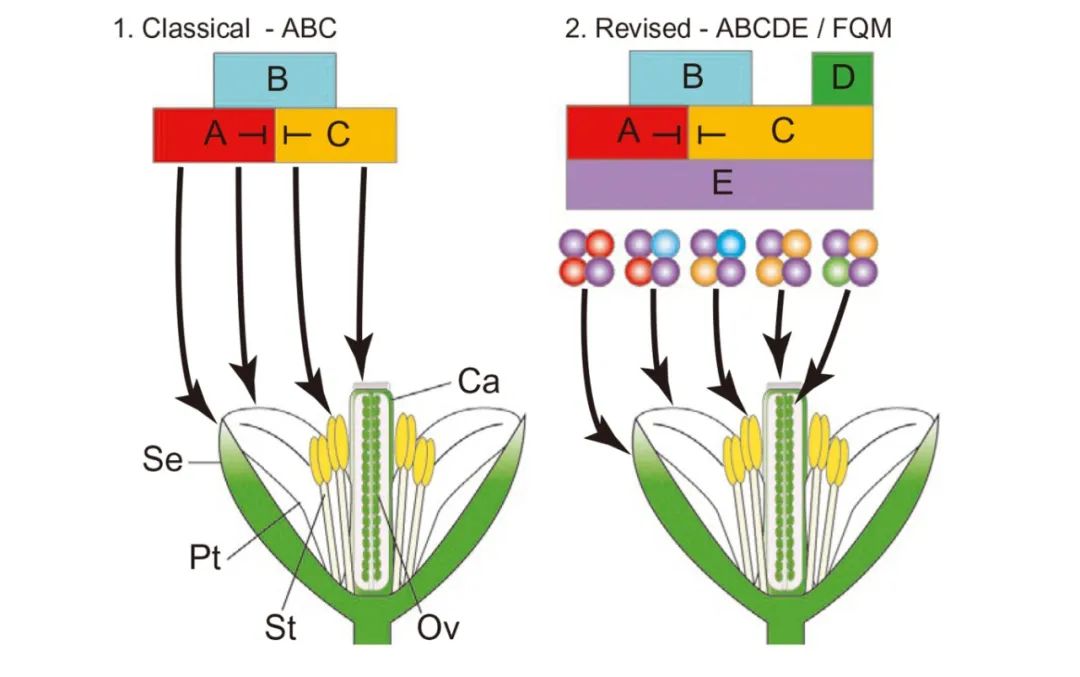
图6 拟南芥花发育的模型(Thomson et al., 2019)。Se,萼片;Pt,花瓣;St,雄蕊;Ca,雌蕊;Ov,胚珠。
花的表型鉴定通常侧重于对花的结构和外观特征进行观察。这包括花萼和花瓣的长度和宽度、雄蕊和雌蕊的长度和数量以及花径大小和花的开放程度等指标。通过对这些指标的测定和分析,可以判断目的基因对花的形态和性状的影响。
2024年3月,南京农业大学王长泉课题组
在
The Plant Journal
杂志
上发表了一篇题为“Telo boxes within the AGAMOUS second intron recruit histone 3 lysine 27 methylation to increase petal number in rose (
Rosa chinensis
) in response to low temperatures”的研究论文。作者发现月季的花瓣数量随着环境温度的升高而逐渐降低,为了探究温度对月季花发育的影响,对不同温度下的月季进行拍照观察,并统计了花瓣和雄蕊的数量。结果发现相比于低温环境,高温下花瓣数量降低、雄蕊数量升高。
由于拟南芥中C基因突变体
ag
拥有花瓣数量增加的表型,因此作者对
RcAG
基因的表达模式进行分析,结果显示
RcAG
主要在心皮和雌蕊中表达,并且随着环境温度的降低表达量也不断下降。为了研究
RcAG
与花瓣数量的关系,作者对
RcAG
基因进行沉默,并成功获得TRV:
RcAG
沉默株系。表型分析发现,无论是在22℃还是28℃条件下,沉默株系花瓣数量均高于TRV空载对照,雄蕊数量均低于TRV空载对照。此外,沉默株系在这两个温度下的表型并无明显差异。综上所述,可以发现
RcAG
对于不同温度下玫瑰花型的形成十分重要。
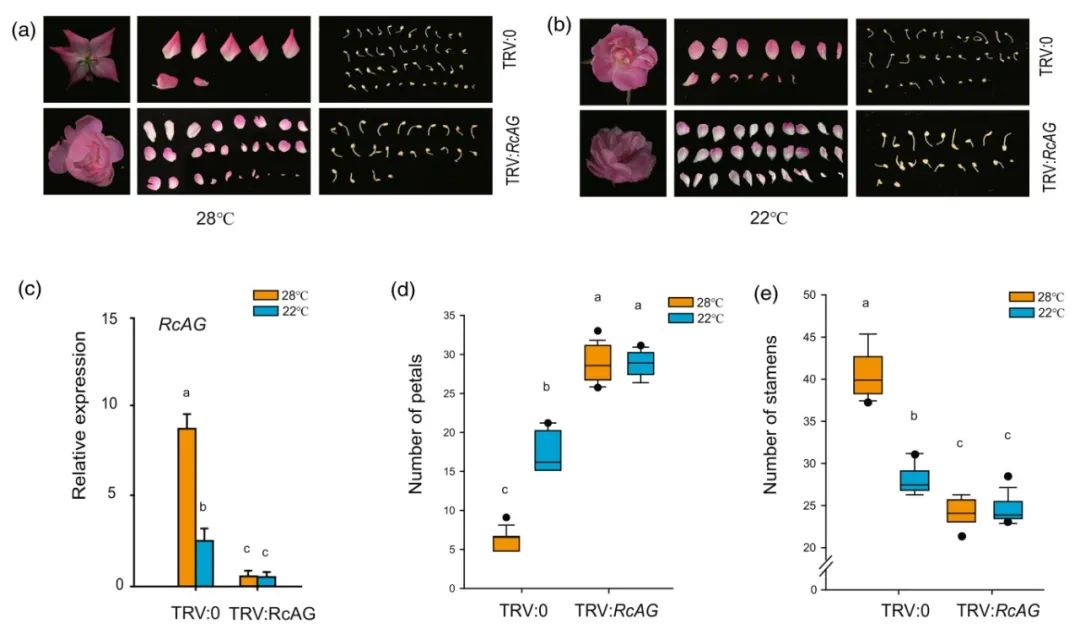
图7
RcAG
在温度调控玫瑰花瓣数量的过程中起着重要的作用
(Lu et al., 2024)
。(a、b)在28℃或22℃下生长的TRV:0和TRV:
RcAG
植株的花朵的表型观察。以TRV空载(pTRV:0)侵染的玫瑰植株作为对照;(c
)通过RT-qPCR测定在不同温度下生长的TRV:0和TRV:RcAG植株中的相对RcAG转录水平;(d、e)在22℃或28℃下生长的TRV:0和TRV:
RcAG
植株的花瓣数(d)和雄蕊数(e)。
被子植物的花在经过开花、传粉和受精后,子房内的胚珠开始发育成种子。受精后的胚珠在形成种子的过程中产生植物激素,如吲哚乙酸,刺激子房迅速生长膨大,并最终形成果实。种子和果实之间虽然存在着重要的相互关系,但它们不完全等同,在研究的侧重点上也有所不同。对于种子的研究通常涉及种子的结构、生理特性、萌发机制、遗传变异等方面。这些研究可以帮助人们理解种子的生物学功能、适应性特征,以及种子在植物生命周期中的作用和重要性。对于果实的研究通常涉及果实的形态结构、生理生化特性、发育过程和成熟调控等方面。这些研究可以帮助人们理解果实的形成机制、功能、营养价值以及对植物生长发育和环境适应性的影响。
果实的表型鉴定通常侧重于对果实的外观和内部结构进行观察。这包括果实的形状、大小、颜色、重量以及硬度和质地等。同时,也会关注果实的酸度、糖含量和植物激素含量等特征。通过对这些指标的测定和分析,可以判断目的基因对果实形态和品质的影响。2023年11月,华中农业大学伊华林/吴巨勋课题组
在
Plant Physiology
杂志
上发表了一篇题为“Transcription factor CsMYB77 negatively regulates fruit ripening and fruit size in citrus”的研究论文。作者基于课题组前期对晚熟脐橙芽变材料的转录组数据结果,从中鉴定出一个差异表达的
CsMYB77
基因。表达模式分析显示
CsMYB77
基因随着果实的成熟表达逐渐下调,推测其可能负向调控果实成熟。为了进一步研究
CsMYB77
基因的功能,作者在番茄中异源转化
CsMYB77
基因,表型分析的结果显示,与野生型相比,过表达株系果实成熟时间推迟3-5天,成熟期果实ABA、乙烯和类胡萝卜素含量下降,叶绿素含量上升。

图8 过表达
C
s
MYB77
延迟了转基因番茄果实成熟(Zhang et al., 2023)。(A)RT-qPCR检测过表达株系和WT(野生型)中
C
s
MYB77
的相对表达量;(B)Western b
lot
检测过表达株系和WT中CsMYB77的蛋白含量;(C)过表达株系和WT果实在不同时期的表型,比例尺:1cm;(D)过表达株系和WT果实从开花到成熟的天数;(E)过表达株系和WT果实中ABA含量、乙烯含量、叶绿素含量和类胡萝卜素含量。
随后,作者又在山金柑中过表达
CsMYB77
基因,转基因山金柑的表型与转基因番茄类似,同样推迟了果实的成熟时间。此外,作者还对
转基因山金柑果实大小等指标进行了观察,结果显示,与野生型相比,过表达株系果实更小、单果重更轻,形状指数也不同。同时作者还对转基因山金柑种子的表型进行观察,结果显示,与野生型相比,过表达株系种子重量降低,但是单果种子数并无明显差异。由于生长素常常报道与器官发育有关,于是作者又检测了不同株系间成熟期果实生长素含量差异,结果显示过表达株系生长素含量低于野生型。综上所述,
CsMYB77
基因可能参与生长素途径来调节柑橘果实形状以及成熟时间。

图9 过表达
Cs
MYB77
显著降低了转基因山金柑果实的大小(Zhang et al., 2023)。(A)在开花220天后(days after flowering,DAF),WT和过表达株系果实大小表型,比例尺:1cm;(B)果实重量和果实指数;(C)WT和过表达株系种子表型,比例尺:1cm;(D)果实的种子重量和平均种子数。
不同植物的种子虽然在大小、形状和颜色等方面存在差异,但其基本结构却是一致的,一般由种皮、胚和胚乳三部分组成。
胚胎是种子发育成植物的基础,包含着未来植物生长所需的初期组织和营养物质。种皮是种子的外层保护壳,保护胚胎不受外界环境的损害。而胚乳则是种子内部的储存组织,富含能量和营养物质,为胚胎的萌发和生长提供所需的能量和营养。
植物种子是由受精卵经过胚胎发育而形成的新个体,通常需要经过一段休眠期后才能形成幼苗。种子的休眠是植物长期进化的结果,具有多种原因,且不同植物休眠的原因也各不相同。如果大家对休眠感兴趣的话,我们可以在下次的介绍中再深入讨论。
种子的表型鉴定通常涉及对种子的形态、结构和外观特征进行观察和分析。这包括种子的大小、形状、颜色、胚乳大小和胚芽发育等方面。同时,也需要关注种子表面的光泽度、质地和硬度等特征。
通过对这些指标的测定和分析,可以判断目的基因对
种子的品质、营养储备和发育状态
的影响
,为种子的筛选、贮藏和利用提供重要依据。
2023年8月,华南农业大学刘向东/王兰课题组在
Plant Physiology
杂志上发表了一篇题为“Natural Allelic Variation in GRAIN SIZE AND WEIGHT 3 of Wild Rice Regulates the Grain Size and Weight”的研究论文。作者在华野3号的背景下通过CRISPR/Cas9技术成功获得
GSW3
敲除突变体,与野生型华野3号相比,突变体株系的株高、穗长、粒长和粒宽均显著增加。
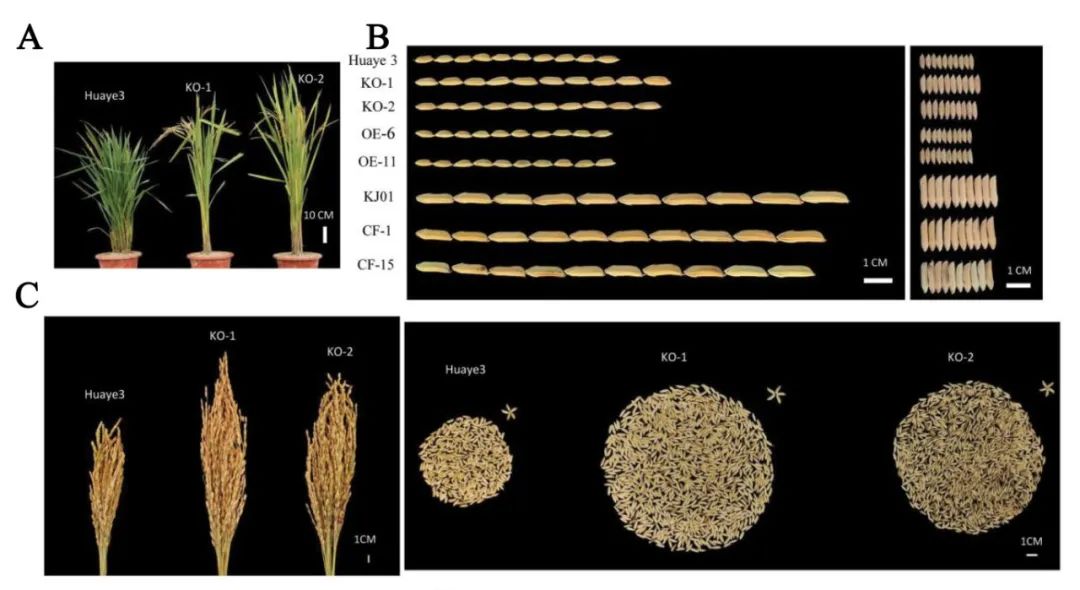
图10
GSW3
敲除突变体和野生型产量分析(Bai et al., 2023)。(A)
GSW3
敲除突变体和野生型植株表型;(B)不同株系种子长度和宽度分析;(C)
GSW3
敲除突变体和野生型种子数量分析。
为了进一步解析
GSW3
基因引起突变体株系和过表达株系种子形状改变的原因,作者先通过光学显微镜对突变体株系和野生型的种子中间横切面的结构进行观察,结果显示,相比于野生型,突变体株系平均单细胞面积增加、细胞数减少。随后,作者又通过扫描电镜对突变体株系和过表达株系成熟种子的外表皮进行观察,结果显示与野生型相比,突变体株系外表皮细胞变长变窄,并且外表皮细胞数量沿纵轴减少,沿横轴增加;过表达株系外表皮细胞变短变窄,外表皮细胞数量沿纵轴和横轴增加。综上所述,
GSW3
可能影响细胞扩增和细胞分裂进而影响水稻种子的大小。
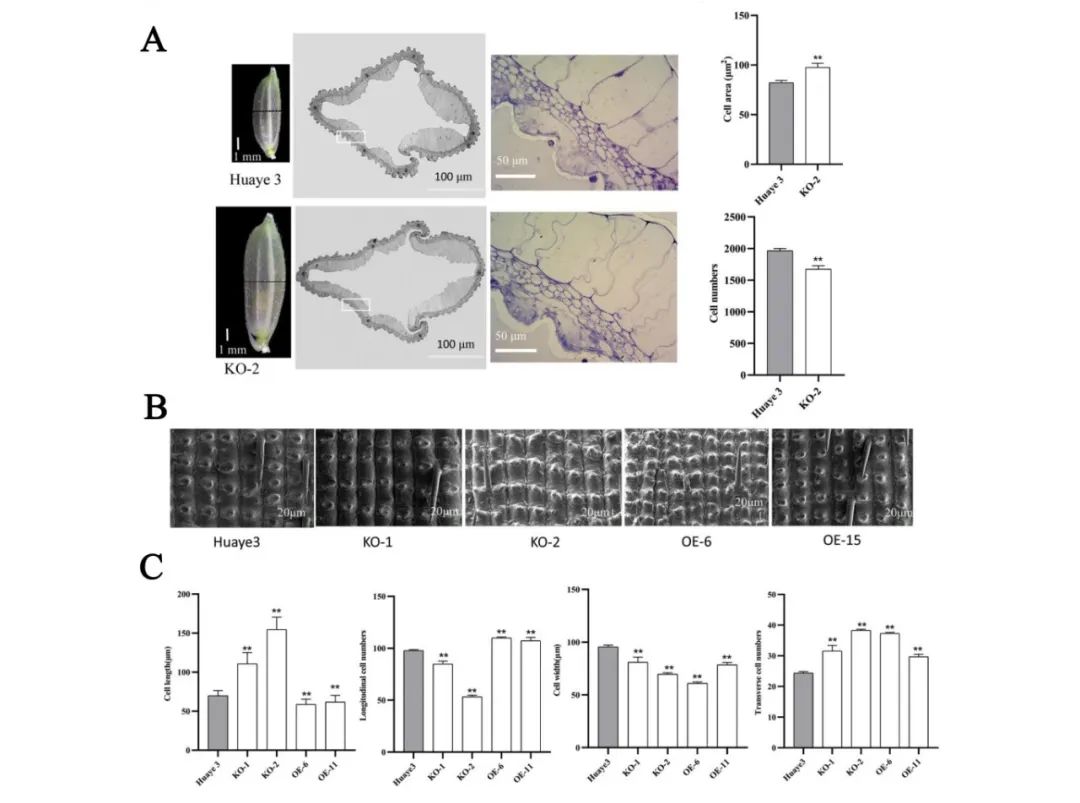
图11
GSW3
敲除突变体和过表达株系种子细胞学分析(Bai et al., 2023)。(A)利用光学显微镜观察野生型和敲除突变体种子外表皮并统计细胞面积和细胞数量;(B、C)利用扫描电镜观察野生型、敲除突变体和过表达种子外表皮细胞(B)并统计细胞长度、纵向细胞数、细胞宽度和横向细胞数(C)。
关于植物表型鉴定的分享即将告一段落啦。在本文中,伯小远分别对植物的六大器官进行了简要介绍,并通过文献分享了不同器官表型鉴定所涉及的一些指标。由于篇幅所限,这里只介绍了一些研究较多的方向,有些方向可能没有涉及到。
如果您对其中未涉及的内容感兴趣
,欢迎给伯小远留言,伯小远
将在后面对您感兴趣的主题进行更详细的探讨
。
正如前文所述,表型鉴定是植物基因功能研究中至关重要的一环,表型鉴定是建立在遗传转化的基础之上,在挑选出目的基因后,我们需要通过过表达、干扰、敲除或回补的方式来获得转基因株系,随后对这些转基因株系进行表型鉴定,以明确目的基因的功能。伯远生物作为植物基因功能研究一站式平台,能够提供24大物种的遗传转化,助力您的植物基因功能研究。
References
:
Bai F, Ma H, Cai Y, et al. Natural allelic variation in GRAIN SIZE AND WEIGHT 3 of wild rice regulates the grain size and weight[J].
Plant Physiology
, 2023, 193(1): 502-518.
Coen E S, Meyerowitz E M. The war of the whorls: genetic interactions controlling flower development[J].
Nature
, 1991, 353(6339): 31-37.
Lu J, Wang W, Fan C, et al. Telo boxes within the AGAMOUS second intron recruit histone 3 lysine 27 methylation to increase petal number in rose (
Rosa chinensis
) in response to low temperatures
[J]
.
The Plant Journal
, 2024.
Tang Y, Lu L, Huang X, et al. The herbaceous peony transcription factor WRKY41a promotes secondary cell wall thickening to enhance stem strength[J].
Plant Physiology
, 2023, 191(1): 428-445.
Thomson B, Wellmer F. Molecular regulation of flower development[J].
Current topics in developmental biology
, 2019, 131: 185-210.
Wang Q, Li Y, Lin D, et al. A growth-regulating factor 7 (
GRF7
)-mediated gene regulatory network promotes leaf growth and expansion in sugarcane[J].
The Crop Journal
, 2024.
Wang Z, Gao M, Li Y, et al. The transcription factor SlWRKY37 positively regulates jasmonic acid-and dark-induced leaf senescence in tomato[J].
Journal of Experimental Botany
, 2022, 73(18): 6207-6225.
Weigel D, Meyerowitz E M. The ABCs of floral homeotic genes[J].
Cell
, 1994, 78(2): 203-209.
Yang R, Sun Y, Zhu X, et al. The tuber‐specific StbHLH93 gene regulates proplastid‐to‐amyloplast development during stolon swelling in potato[J].
New Phytologist
, 2024, 241(4): 1676-1689.
Yao X, Li H, Nie J, et al. Disruption of the amino acid transporter
CsAAP2
inhibits auxin‐mediated root development in cucumber[J].
New Phytologist




